Soluciones para inhalación.
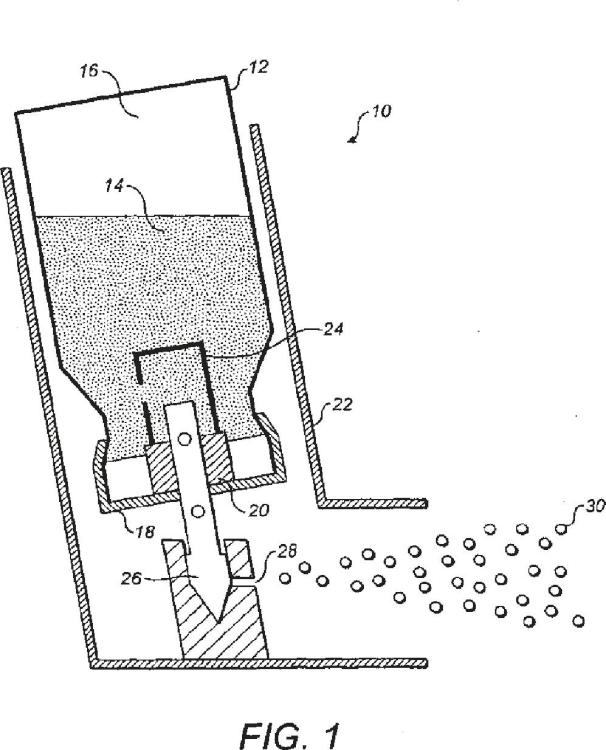
Un inhalador para una formulación para inhalación, que comprende un cartucho que contiene una composición farmacéutica presurizada;
una válvula dosificadora para la dosificación de dosis medidas de la composición desde el cartucho para su administración a un paciente que la necesita; y un accionador para accionar la descarga de las dosis medidas en el paciente; en donde el accionador incluye un orificio de descarga con un diámetro en el intervalo de entre 0,2 y 0,4 mm; y en donde la composición farmacéutica comprende un agente anticolinérgico y un propulsor farmacéuticamente aceptable, caracterizado por que la válvula dosificadora está configurada para dispensar las dosis medidas de la composición farmacéutica que contienen entre 2,5 y 18 microgramos del o de cada agente anticolinérgico.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2010/002126.
Solicitante: CIPLA LIMITED.
Nacionalidad solicitante: India.
Dirección: Cipla House, Peninsula Business Park, Ganpatrao Kadam Marg, Lower Parel Mumbai - 400013 INDIA.
Inventor/es: LULLA, AMAR, MALHOTRA, GEENA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/46 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Aza-8-biciclo[3.2.1]octano; Sus derivados, p. ej. atropina, cocaína.
- A61K9/12 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aerosoles; Espumas.
- A61P11/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 11/00 Medicamentos para el tratamiento de trastornos del aparato respiratorio. › Antiasmáticos.
PDF original: ES-2533535_T3.pdf
Fragmento de la descripción:
Soluciones para inhalación
Campo técnico de la invención
La presente invención se refiere a soluciones para inhalación presurizadas y al proceso de preparación de las mismas, y a su uso para el tratamiento del asma, de la EPOC (enfermedad pulmonar obstructiva crónica) y de otros trastornos respiratorios.
Antecedentes y técnica anterior El conocimiento del tamaño y de la distribución de las partículas producidas desde una formulación en aerosol es importante no solo desde el punto de vista de la optimización del producto, sino también por las potenciales características de inhalación tales como ciertos diseños del accionador, características de la válvula, propiedades del cartucho, etc.
La administración de formulaciones de medicamentos en aerosol por medio de inhaladores dosificadores presurizados (MDIs) se usa ampliamente en terapia, tal como en el tratamiento de enfermedades obstructivas de las vías respiratorias y del asma. En comparación con la administración oral, la inhalación proporciona un inicio más rápido de la acción minimizando los efectos secundarios sistémicos. Las formulaciones en aerosol pueden ser administradas mediante inhalación a través de la boca, o tópicamente mediante su aplicación en la mucosa nasal.
Las formulaciones para su administración en aerosol a través de MDIs pueden ser soluciones o suspensiones. Las formulaciones en solución ofrecen la ventaja de ser de naturaleza homogénea, estando el medicamento y el excipiente completamente disueltos en el vehículo propulsor. Las formulaciones en solución también obvian los problemas de estabilidad física asociados con las formulaciones en suspensión, y por lo tanto aseguran una administración uniforme de la dosis más coherente, eliminando a la vez la necesidad de tensioactivos.
La administración de formulaciones en solución en aerosol a través de MDIs depende de la fuerza propulsora del sistema propulsor usado en su elaboración. Tradicionalmente, el propulsor comprendía una mezcla de clorofluorocarbonos (CFCs) para proporcionar la solubilidad, la presión de vapor y la estabilidad deseadas para la formulación. Sin embargo, dado que en los últimos años se ha establecido que los CFCs son perjudiciales para el medio ambiente ya que contribuyen a la disminución de la capa de ozono de la Tierra, es deseable sustituir los propulsores de CFC perjudiciales para el medio ambiente por propulsores de hidrofluorocarbonos (HFC) seguros para el medio ambiente, o por otros propulsores no clorados, en las formulaciones para inhalación en aerosol. Por ejemplo, la Patente de EE.UU. Nº 4.174.295 desvela el uso de sistemas propulsores que consisten en combinaciones de HFCs, que también pueden contener un componente hidrocarbonado saturado, adecuado para su aplicación en los ámbitos de productos del hogar tales como lacas para el cabello, productos antitranspirantes, perfumes, desodorantes, pinturas, insecticidas y similares.
Muchas de estas aplicaciones, en las que se usan HFAs como propulsores, proponen la adición de uno o más coadyuvantes que incluyen compuestos que actúan como codisolventes, agentes tensioactivos que incluyen tensioactivos fluorados y no fluorados, agentes dispersantes que incluyen polietoxilatos de alquilo y estabilizantes.
La eficacia de un dispositivo en aerosol, por ejemplo, de un MDI, es función de la dosis depositada en el sitio apropiado de los pulmones. La deposición se ve afectada por diversos parámetros, de los cuales el más importante es la dosis de partículas finas (FPD) y el tamaño de partícula aerodinámico. Las partículas sólidas y/o las gotitas de una formulación en aerosol pueden ser caracterizadas por su diámetro aerodinámico de la mediana de la masa 50 (MMAD, el diámetro alrededor del cual se distribuyen igualmente los diámetros aerodinámicos de la masa) . La FPD proporciona una medida directa de la masa de partículas dentro de un intervalo de tamaños especificado, y está estrechamente relacionada con la eficacia del producto.
En la solicitud internacional Nº PCT/EP98/03533 depositada el 6 de octubre de 1998, el solicitante desvela 55 composiciones en solución para su uso en un inhalador en aerosol, que comprenden un material activo, un propulsor que contiene un hidrofluoroalcano (HFA) , un codisolvente y que comprende adicionalmente un componente de baja volatilidad para aumentar el diámetro aerodinámico de la mediana de la masa (MMAD) de las partículas del aerosol en la utilización del inhalador.
El documento WO 98/34596 desvela composiciones en solución para su uso en un inhalador en aerosol, que comprenden un material activo, un propulsor que contiene un hidrofluoroalcano (HFA) , un codisolvente y que comprende adicionalmente un componente de baja volatilidad para aumentar el diámetro aerodinámico de la mediana de la masa (MMAD) de las partículas del aerosol en la utilización del inhalador. Dicha solicitud no aborda el problema técnico de la estabilidad química del principio activo, sino que más bien se refiere a la administración del 65 fármaco en los pulmones.
El amplio uso de estas formulaciones está limitado por su inestabilidad química, que provoca la formación de productos de degradación.
La Patente de EE.UU. Nº 5.676.930 propone el uso de ácidos como estabilizantes para prevenir la degradación química del principio activo en las formulaciones en solución en aerosol que comprenden HFAs. De entre los medicamentos seleccionados se divulga el bromuro de ipratropio, para el que se proporcionan muchos ejemplos de composición, en que el principio activo está junto con un ácido orgánico o inorgánico.
El documento WO96/32099, el documento WO96/32150, el documento WO96/32151 y el documento WO96/32345
divulgan inhaladores dosificadores para la administración de diferentes principios activos en suspensión en el propulsor, en los que las superficies internas del inhalador están parcial o completamente recubiertas con uno o más polímeros fluorocarbonados, opcionalmente junto con uno o más polímeros no fluorocarbonados.
También es ampliamente conocido que las formulaciones en aerosol del tipo mencionado anteriormente a menudo se ven afectadas por la reducción del tamaño de partícula, por la reducción de la concentración de fármaco, por la inclusión de aditivos como tensioactivos en la formulación, por el aumento en la presión de vapor, y por ello juegan un papel importante en la identificación de la eficacia terapéutica que debe conseguirse en los pacientes, según se analiza en el Journal of Pharmaceutical Sciences Vol. 58, Nº 4, abril de 1969, titulado "Influence of formulation on Aerosol Particle Size" de Polli et al.
Las sales anticolinérgicas de amonio cuaternario, tales como el bromuro de oxitropio, el bromuro de tiotropio y el bromuro de ipratropio, se prescriben habitualmente en forma de formulaciones para inhalación, en pacientes que padecen trastornos respiratorios, debido a sus acciones broncodilatadoras, antisecretoras y de prevención del broncoespasmo.
Dichos fármacos, particularmente el bromuro de ipratropio, inducen una broncodilatación menos rápida que los agonistas beta-2 convencionales, pero proporcionan un pico de la respuesta mayor y una duración de la acción más larga. Dichas características los hacen particularmente adecuados para el tratamiento crónico en lugar del agudo (Ferguson G. et al. N Engl J Med 1993, 328, 1017 -1022) .
Aunque la dosis óptima individual para la administración de bromuro de ipratropio nebulizado en el tratamiento de la EPOC se ha establecido en 0, 4 mg (Gross N J et al. Am Rev Respir Dis 1989, 139, 1188 -1191) , la dosis a través de inhaladores dosificados presurizados todavía no se ha establecido unívocamente. Algunos autores (Ferguson G. et al, passim) han sugerido sin embargo que el tratamiento de dicha enfermedad podría beneficiarse del uso de unas dosis mayores que las recomendadas (54 -109 microgramos) . Estudios recientes (Ikeda A et al. Thorax 1996, 51, 48 -53; Shivaram U et al. Resp Med 1997, 91, 327 -334; Wood F et al. Amer J Resp Crit Care Med 1999, 159, A 523) han demostrado que la administración de unas dosis individuales que varían entre 80 y 320 microgramos es beneficiosa para mejorar la función pulmonar, la carga máxima y el consumo de oxígeno.
Sin embargo, ninguna de las técnicas anteriores enseña la reducción de la dosis del principio activo que se va a administrar a través de inhaladores dosificadores sin comprometer la FPD necesaria de las partículas activas / partículas del aerosol en la formulación, poniendo énfasis particularmente en los parámetros, según se analiza en la solicitud internacional Nº PCT/EP98/03533. Particularmente,... [Seguir leyendo]
Reivindicaciones:
1. Un inhalador para una formulación para inhalación, que comprende un cartucho que contiene una composición farmacéutica presurizada; una válvula dosificadora para la dosificación de dosis medidas de la composición desde el 5 cartucho para su administración a un paciente que la necesita; y un accionador para accionar la descarga de las dosis medidas en el paciente; en donde el accionador incluye un orificio de descarga con un diámetro en el intervalo de entre 0, 2 y 0, 4 mm; y en donde la composición farmacéutica comprende un agente anticolinérgico y un propulsor farmacéuticamente aceptable, caracterizado por que la válvula dosificadora está configurada para dispensar las dosis medidas de la composición farmacéutica que contienen entre 2, 5 y 18 microgramos del o de cada agente anticolinérgico.
2. Un inhalador de acuerdo con la reivindicación 1, en el que el anticolinérgico se elige de entre tiotropio, ipratropio, oxitropio, aclidinio, sus sales o solvatos farmacéuticamente aceptables y mezclas de los mismos.
3. Un inhalador de acuerdo con las reivindicaciones 1 o 2, en el que el agente anticolinérgico es bromuro de tiotropio.
4. Un inhalador de acuerdo con cualquiera de las reivindicaciones anteriores, en el que el propulsor incluye uno o más propulsores de HFC farmacéuticamente aceptables, y/o uno o más propulsores hidrocarbonados 20 farmacéuticamente aceptables.
5. Un inhalador de acuerdo con cualquiera de las reivindicaciones anteriores, en el que la composición incluye adicionalmente un codisolvente, que preferiblemente es un codisolvente polar.
6. Un inhalador de acuerdo con la reivindicación 5, en el que el codisolvente comprende uno o más alcoholes alifáticos C2-6 y/o polioles.
7. Un inhalador de acuerdo con cualquiera de las reivindicaciones anteriores, en el que la composición farmacéutica comprende adicionalmente uno o más agentes beta adrenérgicos. 30
8. Un inhalador de acuerdo con cualquiera de las reivindicaciones anteriores, en el que la composición farmacéutica comprende adicionalmente uno o más corticoesteroides.
9. Un inhalador de acuerdo con la reivindicación 1, en el que la composición farmacéutica comprende tiotropio o una
sal del mismo, uno o más propulsores de HFC farmacéuticamente aceptables, y/o uno o más propulsores hidrocarbonados farmacéuticamente aceptables, y uno o más excipientes farmacéuticamente aceptables.
10. Un inhalador de acuerdo con la reivindicación 9, en el que la composición farmacéutica comprende adicionalmente uno o más agentes beta adrenérgicos. 40
11. Un inhalador de acuerdo con las reivindicaciones 9 o 10, en el que la composición farmacéutica comprende adicionalmente uno o más corticoesteroides.
12. Un inhalador según se reivindica en cualquiera de las reivindicaciones anteriores adecuado para su uso en el 45 tratamiento de un trastorno respiratorio.
13. Un inhalador de acuerdo con una cualquiera de las reivindicaciones 1 a 11, adecuado para su uso en el tratamiento del asma y/o de una enfermedad pulmonar obstructiva crónica.
Patentes similares o relacionadas:
Derivados de 5-[2-(piridin-2-ilamino)-1,3-tiazol-5-il]-2,3-dihidro-1H-isoindol-1-ona y su uso como inhibidores dobles de fosfatidilinositol··3-cinasa delta y gamma, del 15 de Julio de 2020, de ASTRAZENECA AB: Compuesto de formula (I) **(Ver fórmula)** donde X es C(O) o SO2; Y es SO2NHR5 o SO2R6; R1 se selecciona de alquilo C1-4, […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Compuestos de diaminopirimidilo sustituidos, composiciones de los mismos y procedimientos de tratamiento con ellos, del 17 de Junio de 2020, de SIGNAL PHARMACEUTICALS LLC: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal, un tautómero, un isotopólogo o un estereoisómero farmacéuticamente aceptable […]
Cadena alfa del receptor de IgE de alta afinidad de fusión Fc, del 13 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Una proteína de fusión Fc que comprende: (i) una cadena α del receptor de IgE de alta afinidad; y (ii) la región Fc de IgG1, en donde la región del fragmento […]
Derivados de piperidin-4-IL azetidina como inhibidores de JAK1, del 6 de Mayo de 2020, de Incyte Holdings Corporation: Un compuesto, que es {1-{1-[3-Fluoro-2-(trifluorometil)isonicotinoil]piperidin-4-il}-3-[4-(7H-pirrolo[2,3-d]pirimidin-4-il)-1H-pirazol-1-il]azetidin-3-il}acetonitrilo,…
Compuestos heterocíclicos tricíclicos útiles como inhibidores de TNF, del 22 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable o un solvato del mismo, en donde: X […]
Compuestos heterocíclicos tricíclicos sustituidos, del 22 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable o un solvato del mismo, […]
Compuestos heterocíclicos útiles como inhibidores de TNF, del 22 de Abril de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de fórmula (I) **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable o un solvato del mismo, […]