Reorientación de parvovirus de rata H-1PV hacia células oncológicas mediante manipulación genética de su cápside.
Un parvovirus de rata H-1 (H-1PV) que contiene una mutación en la secuencia de polipéptidos de las proteínas VP,
donde la mutación está en la posición I367 y/o H373 de la proteína VP2 de H-1PV, donde el parvovirus comprende además un péptido foráneo o una proteína foránea con alta afinidad por un receptor expresado en una célula tumoral, donde el péptido foráneo o la proteína foránea contienen la secuencia de aminoácidos de RGD.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/005229.
Solicitante: DEUTSCHES KREBSFORSCHUNGSZENTRUM.
Nacionalidad solicitante: Alemania.
Dirección: IM NEUENHEIMER FELD 280 69120 HEIDELBERG ALEMANIA.
Inventor/es: ROMMELAERE,JEAN, LEUCHS,BARBARA, EL-ANDALOUSSI,NAZIM, MARCHINI,ANTONIO, ALLAUME,XAVIER.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/76 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Virus; Partículas subvirales; Bacteriófagos.
- C07K14/015 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Parvoviridae, p. ej. virus de la panleucopenia felina, parvovirus humano.
- C12N7/00 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
PDF original: ES-2531581_T3.pdf



Fragmento de la descripción:
Reorientación de parvovirus de rata H-1PV hacia células oncológicas mediante manipulación genética de su cápside Esta invención proporciona un parvovirus de rata H-1 (H-1PV) que puede ser genéticamente reorientado mediante modificación de su cápside, que es útil en el tratamiento del cáncer.
Los parvovirus (PV) son virus de ADN monocatenario, pequeños y sin envoltura, que infectan a una gran variedad de especies animales, desde insectos hasta seres humanos (1) . Desde la observación original de que el parvovirus, virus minuto de ratón (MVM) , puede destruir las células humanas transformadas (2) , se describió que otros parvovirus autónomos de roedor, como H-1PV de rata, tienen actividades oncolíticas y oncosupresoras en diversos cultivos celulares y en modelos animales (3, 4) , sin ser patógenos para los seres humanos.
La actividad antineoplásica de los PV no se debe a la mejor absorción de los virus por las células transformadas sino a una replicación viral más deficiente en estas células. Esto se debe principalmente al hecho de que la replicación de los PV y la expresión génica viral son dependientes de factores celulares tales como E2F, CREB, ATF, ciclina A (5) y otros, que se sabe que están todos aumentados en las células oncológicas. Por otra parte, los PV no desarrollan estrategias capaces de contrarrestar los mecanismos celulares de defensa antiviral (6) . Como las células oncológicas suelen ser deficientes en estas vías antivirales, proporcionan un entorno más favorable para el ciclo de vida viral.
Además de su actividad antineoplásica, otro aspecto positivo del uso de PV de roedor en el tratamiento contra el cáncer es que generalmente los seres humanos no han estado expuestos previamente a la infección por parvovirus y esto evita el problema de una eliminación rápida del virus resultante de una inmunidad antiviral preexistente (7) . Esto coloca a los PV en una mejor posición respecto a otros vectores utilizados en el tratamiento contra el cáncer que se basan en patógenos humanos (ej.: adenovirus, HSV, VSV, etc.) . En conjunto, estas propiedades hacen a estos virus muy atractivos como antineoplásicos.
Aunque el potencial antineoplásico del H-1PV es respaldado por un amplio conjunto de estudios preclínicos, puede esperarse que la eficacia sea un factor limitante en las aplicaciones clínicas. Una limitación importante es el hecho de que los PV aún pueden ingresar a las células normales. La absorción del virus por las células no tumorales secuestra una porción significativa de la dosis viral administrada fuera del tumor que es el objetivo. Dirigir la entrada del PV a las células tumorales aumentaría así la eficacia de los tratamientos a base de parvovirus y proporcionaría seguridad adicional contra posibles efectos secundarios sobre las células normales.
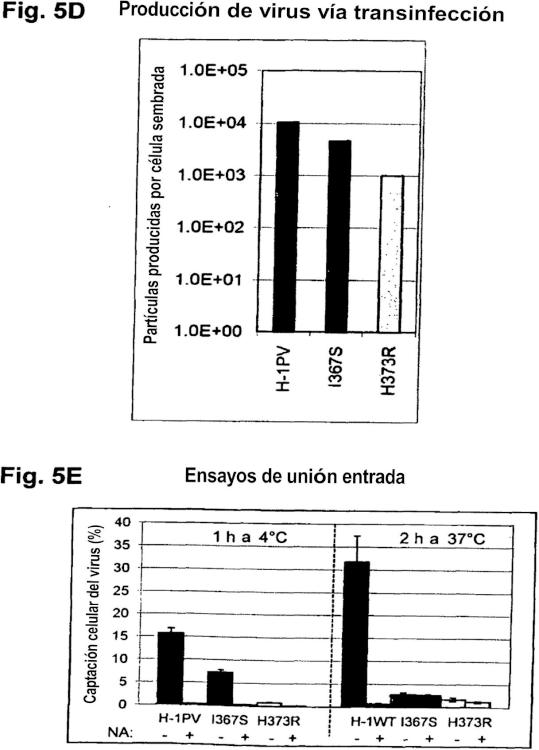
Se ha descrito recientemente un nuevo mutante de H-1PV que surgió espontáneamente después de múltiples pasajes en serie de líneas celulares derivadas de glioma humano infectadas por H-1PV (72) . Se encontraron varias mutaciones (eliminación de 84 nucleótidos en el gen NS, varias sustituciones dentro del gen VP) en los genomas de la variante de H-1PV aislada, incluida una mutación en el gen VP que conduce a la sustitución de H373Y.
Se hicieron varios intentos de modificar la entrada natural de los PV a las células, basándose en la adaptación de las cepas naturales a nuevos tipos de células en experimentos en cultivo celular (8) o in vivo (9, 10) . Estos métodos, sin embargo, carecen de previsibilidad, se limitan a líneas celulares previamente semipermisivas para el virus y tropismos virales ya existentes. Alternativamente, también se han generado PV con tropismo alterado mediante la sustitución de toda la cápside con la de un virus relacionado (11) . No obstante, esta estrategia tiene la limitación de que la modificación no es heredable y que los virus de la progenie no mantienen las mismas habilidades de reorientación de la dosis viral inicial. Un método para aumentar el oncotropismo del virus sería reorientar genéticamente la entrada a la célula del virus hacia los receptores específicos de las células oncológicas. Esta estrategia ha demostrado ser exitosa en la reorientación de otros virus sin envoltura para genoterapia o con fines oncoterapéuticos, por ejemplo con el virus adeno-asociado relacionado (AAV) (12-15) , o el adenovirus (16-18) , pero no se han dado a conocer aún intentos de reorientación de miembros del subgrupo de los parvovirus autónomos.
Por lo tanto, es el objetivo de la presente invención proporcionar parvovirus reorientados que aumenten la eficacia de los tratamientos a base de parvovirus y proporcionen seguridad adicional contra posibles efectos secundarios sobre las células normales.
Según la invención esto se logra mediante los tópicos definidos en las reivindicaciones. Por consiguiente, la presente divulgación proporciona H-1PV genéticamente reprogramado para mejorar su afinidad por las células tumorales humanas. Por analogía con la estructura cristalina resuelta del parvovirus MVM estrechamente relacionado, se desarrolló un modelo 3D por computadora de la cápside del H-1PV natural (en inglés wild type) . Basándose en este modelo, se identificaron los aminoácidos para el reconocimiento de la membrana celular y la entrada del virus a nivel del eje de simetría binario de la cápside, dentro de la región denominada "hoyuelo". La mutagénesis in situ de estos residuos redujo significativamente la unión y la entrada de H-1PV a células permisivas. Luego, se diseñó la cápside viral con deficiencia para entrar y se insertó a nivel de la espina de su eje ternario, un
péptido cíclico 4C-RGD. Este péptido se une a las integrinas αvβ3 y αvβ5, que se sabe que son sobreexpresadas en células oncológicas y vasos sanguíneos en multiplicación. La inserción del péptido rescató la infectividad viral hacia las células que sobreexpresan las integrinas αvβ5 que fueron eficazmente destruidas por el virus rediseñado.
Un ejemplo dado a conocer en este documento se refiere al H-1PV de rata que infecta y destruye numerosas líneas celulares de tumores humanos por ejemplo de origen cerebral (19) , colónico (20) , de cuello de útero (21) , mamario (22, 23) y que está actualmente en evaluación en ensayos clínicos de fase I y II para el tratamiento de pacientes con glioblastoma multiforme recurrente (5) . Se ha demostrado que dependiendo del tipo de célula y de las condiciones experimentales, H-1PV tiene la capacidad de inducir diferentes vías de muerte celular en las células oncológicas, que varian entre necrosis (24) , apoptosis (25-28) y muerte celular dependiente del lisosoma (29) , excluyendo simultáneamente las células no transformadas. Hemos dado a conocer la capacidad del virus para inducir estrés oxidativo en las células oncológicas, llevando a daño del ADN, detención del ciclo celular y apoptosis. Estos efectos son mediados por la proteína no estructural NS1 (28) .
El método descrito en el presente documento consta de dos pasos. En primer lugar, se suprime el tropismo natural del virus para evitar que éste entre en las células originalmente permisivas para él. Esto se puede lograr modificando los residuos de la cápside que intervienen en el reconocimiento de la célula y la unión a la misma. En segundo lugar, el virus es reorientado específicamente hacia las células oncológicas mediante injerto en la cápside viral de un péptido foráneo con alta afinidad por los receptores que se expresan sólo, o preferencialmente, en las células oncológicas. Este paso requiere la identificación de una posición dentro de la cápside viral, que tolere la inserción del péptido y permita la reorientación del virus manteniendo su potencial oncolítico. Ambos pasos son muy desafiantes debido a las restricciones estructurales que impone la cápside icosaédrica del virus; de hecho los cambios en la cápside son a menudo incompatibles con el ensamblaje eficiente de las partículas. Los pasos de reorientación también implican un conocimiento preciso de los elementos estructurales y funcionales de la cápside, y en particular de la región o regiones involucradas en la unión a uno o varios receptores celulares específicos, todos los cuales hasta el momento no han sido estudiados en el caso de H-1PV.
La cápside de la familia Parvoviridae consta de 60 copias de dos o tres secuencias de polipéptidos anidados ensambladas en una simetría icosaédrica T = 1 (30) . En el caso de H-1PV, los capsómeros VP-1 y VP-2 están codificados por transcriptos empalmados alternativamente, que comparten una secuencia central C-terminal pero que tienen extensiones N-terminales de diferentes longitudes. La arquitectura... [Seguir leyendo]
Reivindicaciones:
1. Un parvovirus de rata H-1 (H-1PV) que contiene una mutación en la secuencia de polipéptidos de las proteínas VP, donde la mutación está en la posición I367 y/o H373 de la proteína VP2 de H-1PV, donde el parvovirus comprende además un péptido foráneo o una proteína foránea con alta afinidad por un receptor expresado en una célula tumoral, donde el péptido foráneo o la proteína foránea contienen la secuencia de aminoácidos de RGD.
2. El parvovirus de rata H-1 de acuerdo con la reivindicación 1, en el cual la mutación es una mutación I367S.
4. El parvovirus de rata H-1 de acuerdo con la reivindicación 1, en el cual el péptido foráneo o la proteína foránea se inserta en la posición A 441 de la proteína VP2 (correspondiente a A583 de la proteína VP1) del parvovirus. 6. El parvovirus de rata H-1 de acuerdo con las reivindicaciones 1 a 4 destinado al tratamiento del cáncer. 8. El parvovirus de rata H-1 de acuerdo con cualquiera de las reivindicaciones 1 a 4 destinado a ser utilizado según 25 la reivindicación 7 caracterizado porque su uso está destinado al tratamiento de un glioblastoma. 3. El parvovirus de rata H-1 de acuerdo con la reivindicación 1, en el cual la mutación es una mutación H373R.
5. Una composición farmacéutica que contiene un parvovirus de rata H-1 de acuerdo con cualquiera de las reivindicaciones 1 a 4.
7. El parvovirus de rata H-1 de acuerdo con las reivindicaciones 1 a 4 destinado a ser utilizado según la reivindicación 6 caracterizado porque su uso está destinado al tratamiento de un melanoma, un tumor cerebral, un carcinoma mamario o un carcinoma de cuello de útero.
Patentes similares o relacionadas:
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Nueva especie de tobamovirus, del 17 de Junio de 2020, de Nunhems B.V: Un tobamovirus cuyo genoma comprende al menos 83% de identidad de secuencia con la SEQ ID NÚM.: 1 y en el que el virus causa síntomas sistémicos en plantas homocigotas […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Métodos para la transducción y el procesamiento de células, del 27 de Mayo de 2020, de Juno Therapeutics, Inc: Un método de transducción, que comprende incubar, en una cavidad interna de una cámara de centrífuga, una composición de entrada que comprende células y partículas […]
Composiciones para tratar MPSI, del 22 de Abril de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector que lleva un casete de expresión que comprende un gen de la alfa-L-iduronidasa humana (hIDUA) que tiene la secuencia de nucleótidos de SEQ ID NO: […]
Métodos mejorados para producir terapias celulares adoptivas, del 22 de Abril de 2020, de Bluebird Bio, Inc: Un método in vitro para producir un producto terapéutico de células T que comprende: a) proporcionar una población de células mononucleares […]
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ26 (KCCM11464P) que tiene una capacidad específica para matar Salmonella. Una composición que comprende el bacteriófago ΦCJ26 (KCCM11464P) según […]