Nuevos hidratos cristalinos de fluoroglicósidos heteroaromáticos, productos farmacéuticos que comprenden estos compuestos, y su empleo.
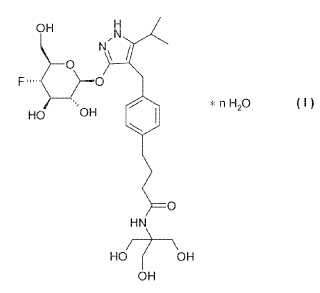
hidrato cristalino de la fórmula I,**Fórmula**
en la cual n tiene un valor de 2,1 a 2,5
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2010/062461.
Solicitante: SANOFI.
Nacionalidad solicitante: Francia.
Dirección: 54, RUE LA BOETIE 75008 PARIS FRANCIA.
Inventor/es: BECKER, BERND, RIGAL,DAVID, FETH,Martin, FISCHER,FRANCESKA, NAGEL,NORBERT, BAUMGARTNER,BRUNO, BRÖCKELMANN,MARTIN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H17/02 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 17/00 Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido. › Radicales heterocíclicos que contienen solamente nitrógeno como heteroátomos del ciclo.
PDF original: ES-2443016_T3.pdf
Fragmento de la descripción:
Nuevos hidratos cristalinos de fluoroglicósidos heteroaromáticos, productos farmacéuticos que comprenden estos compuestos, y su empleo La invención se refiere a los hidratos cristalinos de un fluoroglicósido heteroaromático.
Ya se han descrito fluoroglicósidos heteroaromáticos amorfos en el documento EP1758914 A1. Uno de estos fluoroglicósidos heteroaromáticos es el compuesto de fórmula II;
H N N
O
F OH
O
OH
HO
O
HN
HO OH
OH
II
En ese momento no se conocían hidratos cristalinos de estos fluoroglicósidos. Era un objeto de la invención proporcionar un fluoroglicósido aromático que, comparado con los descritos en el documento EP1758914 A1, tuviese propiedades mejoradas. Otro objeto era incrementar la estabilidad durante el almacenamiento del fluoroglicósido heteroaromático amorfo del documento EP1758914 A1, que constituye un parámetro crucial para formular productos farmacéuticos.
El objeto se alcanza proporcionando un hidrato cristalino de la fórmula I
H
OH
N N
O F
O
! n H2O HO
OH
O HN
HO
OH OH
I en la cual n tiene un valor de 2, 1 a 2, 5. Se da preferencia al hidrato cristalino del compuesto de la fórmula I, en el cual n tiene un valor de 2.25. Al proporcionar los hidratos cristalinos de la fórmula I de acuerdo con la invención, el ingrediente activo
∀ es más fácil de purificar (por ejemplo por recristalización) ∀ puede tener una pureza definida requerida para la aprobación de un producto farmacéutico ∀ se puede detectar e identificar fácilmente por métodos habituales, tales como XRPD (difracción en polvo de rayos X - siglas en inglés) , espectro Raman, IR (espectro infrarrojo) , y posee ∀ una calidad física reproducible
∀ tiene mayor estabilidad química durante el almacenamiento a 40°C en condiciones de sequedad (viales cerrados) y 75% HR (humedad relativa) .
∀ es menos higroscópico a 80% HR (25°C) que la forma amoría.
Los ingredientes activos cristalinos son generalmente más estables que los ingredientes activos amorfos. Esto evita 5 problemas con la degradación de los ingredientes activos y se evitan por tanto los productos de degradación que se forman.
La forma amoría de un ingrediente activo puede comprender, además, un contenido indeseado de disolventes. Éstos son generalmente difíciles de eliminar, ya que no es posible la recristalización.
La forma amoría contiene más energía que la forma cristalina. Esto puede conducir a un modelo aleatorio de distribución de las moléculas de la forma amoría que se puede reorganizar espontáneamente con liberación de energía y disipación parcial de la energía. Esto puede conducir a cambios en la actividad del ingrediente activo, sin que ello sea directamente evidente en un parámetro medible del ingrediente activo. La consecuencia es un efecto significativo sobre la fiabilidad del ingrediente activo y, por tanto, un riesgo para el paciente.
Es difícil demostrar que lotes diferentes del ingrediente activo amorfo sean idénticos.
Una realización adicional de la invención comprende un hidrato cristalino de la fórmula I, en donde la XRPD, medida con radiación CuKα, tiene un pico principal de 5, 8 grados 2 theta ± 0, 2 grados 2 o .
Una realización adicional de la invención comprende un hidrato cristalino de la fórmula I, en donde la XRPD medida con radiación CuKα tiene al menos picos de los siguientes valores 2 theta:
5, 8, 10, 3, 14, 2 ± 0, 2 grados 2 theta.
Una realización adicional de la invención comprende un hidrato cristalino de la fórmula I, en donde la XRPD medida con radiación CuKα tiene al menos picos de los siguientes valores 2 theta:
5, 8, 7, 1, 10, 3, 14, 2, 19.7 ± 0, 2 grados 2 theta.
Una realización adicional de la invención comprende un hidrato cristalino de la fórmula I, en donde la XRPD medida con radiación CuKα tiene al menos picos de los siguientes valores 2 theta:
5, 8, 7, 1, 10, 3, 14, 2, 19, 9, 19, 7, 21, 8 ± 0, 2 grados 2 theta.
Formulaciones La cantidad de un compuesto de fórmula I necesaria para lograr el efecto biológico deseado depende de una serie de factores, por ejemplo, el compuesto específico elegido, el uso que se tenga como fin, el modo de administración y la afección clínica del paciente. Generalmente, la dosis diaria se sitúa en el intervalo de 0, 01 mg a 100 mg
(típicamente de 0, 05 mg a 50 mg) por día y por kilogramo de peso corporal, por ejemplo, 0, 05 -10 mg/kg/día.
Las formulaciones de dosis única que pueden ser administradas por vía oral tales como, por ejemplo, comprimidos o cápsulas, pueden contener, por ejemplo, de 1, 0 a 1000 mg, típicamente de 5 a 600 mg. Para la terapia de los estados antes mencionados, los compuestos de la fórmula I se pueden utilizar como el compuesto propiamente dicho, pero preferiblemente se encuentran en forma de una composición farmacéutica junto con un vehículo 35 aceptable. Por supuesto, el vehículo debe ser aceptable, en el sentido de ser compatible con los otros ingredientes de la composición, y no ser nocivo para la salud del paciente. El vehículo puede ser un sólido, un líquido o ambos, y preferiblemente se formula con el compuesto en forma de una sola dosis, por ejemplo en forma de un comprimido, que puede contener de 0, 05% a 95% en peso del ingrediente activo. Se prefiere el vehículo en estado sólido. A su vez, pueden estar presentes otras sustancias farmacéuticamente activas, entre ellas compuestos adicionales de la fórmula I. Las composiciones farmacéuticas de la invención pueden producirse por uno de los métodos farmacéuticos conocidos, que esencialmente consisten en mezclar los ingredientes con vehículos y/o excipientes farmacológicamente aceptables.
Las composiciones farmacéuticas de la invención son aquellas adecuadas para la administración oral y peroral.Los recubrimientos adecuados resistentes al jugo gástrico comprenden acetato-ftalato de celulosa, poli (acetato-ftalato de 45 vinilo) , ftalato de hidroxipropilmetil-celulosa y polímeros aniónicos de ácido metacrílico y metacrilato de metilo.
Los compuestos farmacéuticos adecuados para la administración oral pueden adoptar la forma de unidades separadas tales como, por ejemplo, cápsulas, obleas, comprimidos para chupar o comprimidos, cada uno de los cuales contiene una cantidad definida del compuesto de la fórmula I; como polvos o gránulos; o como una suspensión en un líquido acuoso o no acuoso. Estas composiciones, como ya se ha mencionado, pueden 50 prepararse por cualquier método farmacéutico adecuado que incluya una etapa en la que se pongan en contacto el ingrediente activo y el vehículo (que puede consistir en uno o más ingredientes adicionales) . En general, las composiciones se producen por mezcla uniforme y homogénea del ingrediente activo con un vehículo líquido y/o sólido finamente dividido, después de lo cual el producto se moldea si es necesario. Por lo tanto, se puede preparar un comprimido, por ejemplo, por compresión de un polvo o de gránulos del compuesto, según sea adecuado con uno o más ingredientes adicionales. Los comprimidos se pueden producir por compresión del compuesto en forma fluida, tal como, por ejemplo, un polvo o gránulos, cuando sea adecuado mezclado con un aglutinante, deslizante, diluyente inerte y/o uno (o más) agente (s) tensioactivo (s) /dispersante (s) , en una máquina adecuada.
Las composiciones farmacéuticas que son adecuadas para la administración por vía oral (sublingual) comprenden comprimidos para chupar que contienen un compuesto de la fórmula I con un saporífero, normalmente sacarosa y goma arábiga o tragacanto, y pastillas que comprenden el compuesto en una base inerte tal como gelatina y glicerol
o sacarosa y goma arábiga.
Combinación con otros ingredientes activos El compuesto o los compuestos de la invención (I) también se pueden administrar en combinación con principios activos adicionales.
Otros ingredientes activos adecuados para los productos de combinación son:
Todos los antidiabéticos que se mencionan en la Rote Liste 2.007, capítulo 12, todos los agentes reductores de peso/supresores del apetito que se mencionan en la Rote Liste 2005, capítulo 1; todos los agentes reductores de lípidos que se mencionan en la Rote Liste 2007, capítulo 58. Pueden combinarse con el compuesto de la invención de la fórmula I, en particular para una mejora sinérgica del efecto. La combinación del ingrediente activo puede administrarse bien por administración... [Seguir leyendo]
Reivindicaciones:
1. Un hidrato cristalino de la fórmula I,
en la cual n tiene un valor de 2, 1 a 2, 5.
2. El hidrato cristalino de la fórmula I según la reivindicación 1, en donde n tiene un valor de 2, 5.
3. El hidrato cristalino de la fórmula I según una o más de las reivindicaciones 1 a 2, en donde el XRPD medido con radiación CuKα tiene un pico principal de 5, 8 grados 2 theta ± 0, 2 grados 2 theta.
4. El hidrato cristalino de la fórmula I según una o más de las reivindicaciones 1 a 3, en donde el XRPD medido con radiación CuKα tiene al menos picos de los siguientes valores 2 theta:
5, 8, 10, 3, 14, 2 ± 0, 2 grados 2 theta.
5. El hidrato cristalino de la fórmula I según las reivindicaciones 1 a 4, en donde el XRPD medido con radiación CuKα tiene al menos picos de los siguientes valores 2 theta:
5, 8, 10, 3, 14, 2, 19, 7 ± 0, 2 grados 2 theta.
6. El hidrato cristalino de la fórmula I según las reivindicaciones 1 a 5, en donde el XRPD medido con radiación 15 CuKα tiene al menos picos de los siguientes valores 2 theta:
5, 8, 7, 1, 10, 3, 14, 2, 19, 9, 19, 7, 21, 8 ± 0, 2 grados 2 theta.
7. Un medicamento en forma de una suspensión que comprende uno o más de los compuestos reivindicados en una o más de las reivindicaciones 1 a 6.
8. Un medicamento en estado sólido que comprende uno o más de los compuestos reivindicados en una o más de 20 las reivindicaciones 1 a 6.
9. Un medicamento en forma de una suspensión, que comprende uno o más de los compuestos según una o más de las reivindicaciones 1 a 6 y uno o más ingredientes activos hipoglucemiantes.
10. Un medicamento en estado sólido, que comprende uno o más de los compuestos según una o más de las reivindicaciones 1 a 6 y uno o más ingredientes activos hipoglucemiantes.
11. El compuesto según una o más de las reivindicaciones 1 a 6, para uso en un método de tratamiento de diabetes de tipo 1 y de tipo 2.
12. El compuesto según una o más de las reivindicaciones 1 a 6, para uso en un método de tratamiento para disminuir el nivel de glucemia.
13. El compuesto según una o más de las reivindicaciones 1 a 6 en combinación con al menos otro ingrediente 30 activo hipoglucemiante, para uso en un método de tratamiento de la diabetes de tipo 1 y de tipo 2.
14. El uso del compuesto según una o más de las reivindicaciones 1 a 6 en combinación con al menos otro ingrediente activo hipoglucemiante, para uso en un método de tratamiento para disminuir el nivel de glucemia.
15. Un procedimiento para producir un medicamento que comprende el compuesto según una o más de las reivindicaciones 1 a 6, que comprende mezclar el ingrediente activo con un vehículo farmacéuticamente adecuado, y convertir esta mezcla en una forma adecuada para la administración.
16. El compuesto según una o más de las reivindicaciones 1 a 6, para uso como producto farmacéutico.
Diagrama 1
S1H1821 SAR474832 F-75005-30 Sieb oben S1H/762
Intensidad relativa (%)
Relative Intensity (%)
100.0
80.0
60.0
40.0
20.0
0.0
2.0 6.0 10.0 14.0 18.0 22.0 26.0 30.0 2Theta
ººººººººººººººº
Diagrama 2: Espectro IR del hidrato cristalino de fórmula I
4000 3.500 3000 2500 2000 1500 1000 500 Números de Onda
Diagrama 3Espectro Raman de dispersión del hidrato cristalino de fórmula I
1600 140012001000800600400-
Desplazamiento Raman (cm-1)
Diagrama 4Curva TGA del hidrato cristalino de la fórmula I
50 100 150 200 250 Temperature (°C) Universal V4.2E TA Instruments Temperatura (ºC)
Peso (%)
Weight (%)
30 31 32
Diagrama 7 Termograma DSC de un hidrato cristalino de la fórmula I^exo I1064 -01 20.06.2008 14:10:42
Lab: frasvcwxp STAR e SW 9.10
Intensidad Absoluta
34
Diagrama 9Espectro Raman de dispersión de la forma amoría del compuesto de fórmula II
1600 140012001000800600400Desplazamiento Raman (cm-1)
Diagrama 10Curva TGA de la forma amoría por rayos X del compuesto de fórmula II
Peso (%)
Weight (%)
0 50 100 150 200 250
Temperature (°C) Universal V4.2E TA Instruments Temperatura (ºC)
Patentes similares o relacionadas:
Un nuevo derivado de quinolina para su uso en el tratamiento y la prevención de infecciones virales, del 12 de Febrero de 2020, de ABIVAX: Derivado de quinolina de la fórmula **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables.
Compuestos de 1-(beta-d-glucopiranosil)-1h-indol, del 8 de Mayo de 2019, de ELI LILLY AND COMPANY: Un compuesto de fórmula:**Fórmula** o una sal farmacéuticamente aceptable del mismo.
Acetato de 4-{4-[(1E)-4-(2,9-diazaespiro[5.5]undec-2-il)but-1-en-il]-2-metilbencil}-5-(propan-2-il)-1H-pirazol-3-il beta-D-glucopiranosido, del 13 de Marzo de 2019, de ELI LILLY AND COMPANY: Un compuesto de fórmula**Fórmula** o hidrato del mismo.
Intermedio para la síntesis de 1-(2-desoxi-2-fluoro-4-tio-beta-d-arabinofuranosil)citosina, intermedio para la síntesis de tionucleósido y métodos para producir estos intermedios, del 27 de Febrero de 2019, de FUJIFILM CORPORATION: Un metodo para producir un compuesto representado por la formula [1E] siguiente:**Fórmula** en donde R1A, R1B, R2A, R2B, R3A y R3B tienen los mismos significados […]
Derivados de oligosacáridos sulfatados novedosos, del 27 de Abril de 2016, de Progen PG500 Series Pty Ltd: Un compuesto de la fórmula general:**Fórmula** donde: X e Y son cada uno una unidad monosacárida donde cada grupo hidroxilo no comprendido en un enlace glucosídico es […]
 Monosebacato de un derivado de pirazol, del 9 de Septiembre de 2015, de KISSEI PHARMACEUTICAL CO., LTD.: Un compuesto representado mediante la fórmula estructural**Fórmula**
Monosebacato de un derivado de pirazol, del 9 de Septiembre de 2015, de KISSEI PHARMACEUTICAL CO., LTD.: Un compuesto representado mediante la fórmula estructural**Fórmula**
Derivados de coelenterazina y métodos de uso de los mismos, del 3 de Junio de 2015, de PROMEGA CORPORATION: Un compuesto de fórmula (II):**Fórmula** en la que R2 es -(CH2)n-T o alquilo C1-5; R6 se selecciona entre el grupo que consiste en -H, -OH, -NH2, […]
Compuestos novedosos, del 15 de Octubre de 2014, de MITSUBISHI TANABE PHARMA CORPORATION: Un compuesto de fórmula:**Fórmula** en la que el anillo A y el anillo B son el anillo A es un anillo heterocíclico monocíclico insaturado […]