Formulación de liberación controlada para evitar un uso indebido.
Una composición sólida para la administración oral de al menos un agente farmacéuticamente activo,
que comprende:
(a) una primera capa que comprende una primera población de micropartículas de liberación controlada que tienen un agente farmacéuticamente activo dispuesto en su interior;
(b) una segunda capa que comprende un agente farmacéuticamente activo dispuesto en su interior; y
(c) un material superabsorbente dispuesto en el interior de la primera capa, de la segunda capa, o tanto de la primera capa como de la segunda capa, en la que la composición,
(i) cuando está intacta y se expone a un entorno acuoso, inicialmente, el agente farmacéuticamente activo dispuesto en la segunda capa se libera a una velocidad más rápida que el agente farmacéuticamente activo dispuesto en la primera capa, y
(ii) cuando se tritura y se expone a un entorno acuoso, el material superabsorbente se hincha para crear un gel duro que atrapa las micropartículas, después de lo cual el gel duro, las micropartículas o tanto el gel duro como las micropartículas, permiten la liberación controlada de al menos el agente farmacéuticamente activo dispuesto en el interior de las micropartículas.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2009/001823.
Solicitante: Paladin Labs Inc.
Nacionalidad solicitante: Canadá.
Dirección: 6111 Royalmount Avenue, Suite 102 Montreal, QC H4P 2T4 CANADA.
Inventor/es: GERVAIS,SONIA, RAHMOUNI,MILOUD, SMITH,DAMON, SANT,VINAYAK, DUFFAYET,FRÉDÉRIC, RUSTOM,SHAMS, EL-JAMMAL,ALI, NDONG,JEAN-MICHEL, BOURSIQUOT,BOBBY-ERNST, BICHARA,ALI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/36 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Polisacáridos; Sus derivados, p. ej. gomas o resinas, almidón, alginato, dextrina, ácido hialurónico, quitosano, inulina, agar o pectina.
- A61K9/24 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en dosis unitarias constituidas por capas u hojas.
- A61K9/28 A61K 9/00 […] › Grageas; Píldoras o comprimidos con revestimientos.
- A61K9/30 A61K 9/00 […] › Revestimientos orgánicos.
PDF original: ES-2509497_T3.pdf




Fragmento de la descripción:
Formulación de liberación controlada para evitar un uso indebido Solicitudes relacionadas La presente solicitud reivindica el beneficio y la prioridad de la patente de EE. UU. en trámite 2010239662.
Campo de la invención La presente invención se refiere de forma general a una formulación de liberación controlada para la administración de al menos un agente farmacéuticamente activo y, más específicamente, la invención se refiere a una formulación de liberación controlada para evitar un uso indebido, que mantiene sus propiedades de liberación controlada para al menos un agente farmacéuticamente activo incluso cuando se divide en dos o se tritura y se expone a diversos medios.
Antecedentes de la invención Aunque se han realizado avances significativos en el campo de la administración de fármacos, sigue existiendo preocupación por los fármacos objeto de toxicomanías (por ejemplo, analgésicos opioides) . Además, el número de pacientes legítimos que usan estos fármacos de forma indebida, ya sea deliberadamente o de forma accidental, representa un problema médico grave. En particular, puede aumentar el riesgo de los pacientes cuando se usan formulaciones de liberación controlada porque, típicamente, en estas formulaciones se incorporan cantidades mayores del agente farmacéuticamente activo para facilitar la frecuencia de dosificación reducida. Sin embargo, aunque las formulaciones de liberación controlada ofrecen más comodidad y, con frecuencia, un perfil de acontecimientos adversos mejorado, se pueden producir problemas graves si el mecanismo de liberación controlada se ve afectado de algún modo, por ejemplo, si se mastica o se muele accidentalmente o se daña de otro modo el comprimido o si se toma junto con alcohol. En estas situaciones, la liberación inmediata del agente farmacéuticamente activo seguida de la absorción rápida de hasta la dosis diaria total del agente farmacéutico pueden tener consecuencias potencialmente mortales.
Si bien se han probado varios planteamientos para abordar el abuso y el uso indebido de determinados fármacos, incluidos, por ejemplo, el uso de formulaciones aversivas, formulaciones agonistas/antagonistas y formulaciones de profármaco, la comercialización de estos planteamientos ha estado limitada hasta la fecha.
Las formulaciones aversivas son formulaciones que contienen una sustancia nociva, tal como capsaicina, un emético, o niacina. El objetivo es evitar el abuso deliberado al causar una reacción dolorosa o desagradable de otro modo en caso de que se triture o dañe de otro modo la formulación antes de su ingesta. Por ejemplo, las publicaciones de patente de EE. UU. Nº 2003/0068370, 2003/0068392 y 2007/0020188 describen la incorporación de agentes aversivos (p. ej., un agente amargo, un irritante o un agente emético) en una dosificación que contiene un analgésico opioide. Los agentes aversivos disuaden al toxicómano de manipular la forma farmacéutica y a continuación inhalar o inyectarse la dosificación manipulada. En este tipo de formulaciones no se aborda el riesgo potencial de estos aditivos para el consumidor legítimo que daña accidentalmente el comprimido.
Las formulaciones antagonistas contienen inhibidores (antagonistas) del fármaco terapéutico. Cuando se tritura la formulación, se pretende que los inhibidores impidan o anulen la acción del agente farmacéuticamente activo, de modo que se reduzca o elimine todo beneficio para usos no médicos. Por ejemplo, la naloxona se combina con pentazocina (Talwin®, comercializado por Sanofi-Winthrop) para disuadir del abuso de pentazocina por vía parenteral. Se pretende que la naloxona bloquee la unión de la pentazocina a los receptores opioideos. De modo similar, se ha añadido naloxona a una formulación que contiene buprenorfina (Temgesic®, comercializado por Reckitt & Colman) . Además, se ha añadido naltrexona, un antagonista de los receptor opioideos, a una formulación que contiene morfina (Embeda®, comercializado por King Pharmaceuticals, Inc.) . No obstante, se entiende que este planteamiento puede exponer a los pacientes legítimos a fármacos innecesarios y, potencialmente, puede inhibir el tratamiento eficaz debido a que se pueden liberar los inhibidores durante el paso normal a través del tubo gastrointestinal. Estas formulaciones también asumen que se puede lograr la inhibición eficaz (es decir, que se pueden hacer coincidir la biodisponibilidad, la farmacocinética y las afinidades relativas del agonista y el antagonista con el fin de provocar una inhibición eficaz en el receptor al que se destinan) . En las patentes de EE. UU. Nº
3.773.955 y 3.966.940, por ejemplo, se describen formulaciones que contienen combinaciones de agonistas y antagonistas opioideos, en las que el antagonista no bloquea el efecto terapéutico cuando la mezcla se administra por vía oral, pero bloquea la analgesia, la euforia o la dependencia física cuando un toxicómano se la administra por vía parenteral en forma triturada.
Las formulaciones de profármaco se basan en la conversión metabólica in vivo del profármaco en el fármaco activo por enzimas que se encuentran, por ejemplo, en el tubo gastrointestinal. Aunque estas formulaciones pueden evitar la euforia por administración por vía intravenosa o nasal del fármaco, no abordan los problemas relacionados con la posible intoxicación (por ejemplo, intoxicación con alcohol) tras la administración oral.
Debido a estas limitaciones con las tecnologías existentes, sigue existiendo la necesidad de proporcionar
formulaciones de liberación controlada para evitar un uso indebido que puedan reducir el riesgo de abuso intencionado y de uso indebido accidental de formulaciones que contienen un agente farmacéuticamente activo.
Sumario de la invención La invención se basa, en parte, en el descubrimiento de que es posible crear un soporte de administración de fármacos donde las composiciones son formas farmacéuticas orales que permiten la liberación controlada de al menos un agente farmacéuticamente activo dispuesto en la formulación después de seccionarlo (por ejemplo, dividirlo en dos) o triturarlo. El soporte es particularmente útil para la administración de agentes farmacéuticamente activos que son susceptibles de un uso indebido (ya sea deliberado o accidental, pero en cualquier caso que provoque daños) , abuso y/o que tenga un índice terapéutico estrecho. Los agentes susceptibles de un uso indebido dañino o abuso incluyen, por ejemplo, analgésicos (por ejemplo, analgésicos opioides) , agentes hipnóticos, agentes ansiolíticos y agentes estimulantes del sistema nervioso central (SNC) y el aparato respiratorio. Los ejemplos de fármacos de índice terapéutico estrecho incluyen teofilina, carbonato de litio y digoxina.
En un aspecto, la invención proporciona una composición sólida (forma farmacéutica oral) para la administración oral de al menos un agente farmacéuticamente activo. La composición comprende (a) una primera capa que comprende una primera población de micropartículas de liberación controlada que tienen al menos un agente farmacéuticamente activo dispuesto en su interior; (b) una segunda capa que comprende un agente farmacéuticamente activo dispuesto en su interior; y (c) un material superabsorbente dispuesto en el interior de la primera capa, de la segunda capa o tanto en la primera capa como en segunda capa. En otro aspecto, la invención proporciona una composición sólida (forma farmacéutica oral) para la administración oral de al menos un agente farmacéuticamente activo. La composición comprende (a) una primera capa que comprende un material superabsorbente y una primera población de micropartículas de liberación controlada que tienen al menos un agente farmacéuticamente activo dispuesto en su interior; y (b) una segunda capa que comprende un agente farmacéuticamente activo dispuesto en su interior.
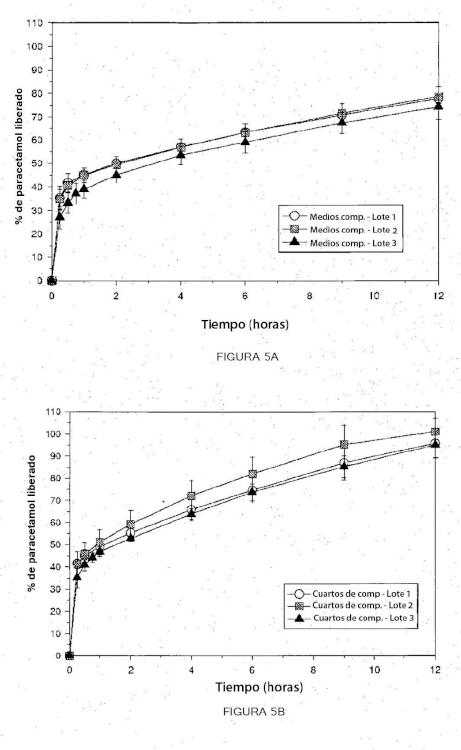
En cada uno de los aspectos anteriores, cuando se expone la composición intacta a un entorno acuoso, inicialmente, el agente farmacéuticamente activo dispuesto en la segunda capa se libera a una velocidad más rápida que el agente farmacéuticamente activo dispuesto en la primera capa. Se libera al menos un agente farmacéuticamente activo de la formulación intacta a lo largo de un periodo de tiempo prolongado (por ejemplo, durante al menos 6 horas, al menos 8 horas, al menos 12 horas, al menos 18 horas o al menos 24 horas) . En determinados modos de realización, se evita que al menos 50 %, preferentemente el 60 %, más preferentemente el 70 % y aún más preferentemente el 80 % de al menos un agente farmacéuticamente activo se libere de forma sustancialmente inmediata (por ejemplo, en un plazo de 30 minutos) a partir de la formulación intacta.
Además,... [Seguir leyendo]
Reivindicaciones:
1. Una composición sólida para la administración oral de al menos un agente farmacéuticamente activo, que comprende:
(a) una primera capa que comprende una primera población de micropartículas de liberación controlada que tienen un agente farmacéuticamente activo dispuesto en su interior;
(b) una segunda capa que comprende un agente farmacéuticamente activo dispuesto en su interior; y
(c) un material superabsorbente dispuesto en el interior de la primera capa, de la segunda capa, o tanto de la primera capa como de la segunda capa, en la que la composición,
(i) cuando está intacta y se expone a un entorno acuoso, inicialmente, el agente farmacéuticamente activo dispuesto en la segunda capa se libera a una velocidad más rápida que el agente farmacéuticamente activo dispuesto en la primera capa, y
(ii) cuando se tritura y se expone a un entorno acuoso, el material superabsorbente se hincha para crear un gel duro que atrapa las micropartículas, después de lo cual el gel duro, las micropartículas o tanto el gel duro como las micropartículas, permiten la liberación controlada de al menos el agente farmacéuticamente activo dispuesto en el interior de las micropartículas.
2. La composición de la reivindicación 1, en la que el material superabsorbente se dispone en el interior de la primera capa.
3. La composición de la reivindicación 1 o 2, en la que el material superabsorbente se dispone en el interior de la segunda capa.
4. La composición de una cualquiera de las reivindicaciones 1 a 3, en la que el agente farmacéuticamente activo dispuesto en la segunda capa está presente en una segunda población de micropartículas de liberación controlada.
5. La composición de una cualquiera de las reivindicaciones 1 a 4, en la que el agente farmacéuticamente activo presente en la primera capa y el agente farmacéuticamente activo presente en la segunda capa son iguales.
6. La composición de una cualquiera de las reivindicaciones 1 a 4, en la que el agente farmacéuticamente activo presente en la primera capa y el agente farmacéuticamente activo presente en la segunda capa son diferentes.
7. La composición de una cualquiera de las reivindicaciones 1 a 6, en la que la primera capa está adyacente a la segunda capa.
8. La composición de la reivindicación 7, en la que la composición es una bicapa.
9. La composición de una cualquiera de las reivindicaciones 1 a 6, en la que se dispone una tercera capa entre la primera capa y la segunda capa.
10. La composición de una cualquiera de las reivindicaciones 1 a 9, en la que la primera capa, la segunda capa, o tanto la primera y segunda capas, comprenden además un agente de liberación controlada.
11. La composición de una cualquiera de las reivindicaciones 1 a 10, en la que la composición comprende además un recubrimiento que encapsula la primera capa y la segunda capa.
12. La composición de la reivindicación 11, en la que el recubrimiento es un recubrimiento de liberación controlada.
13. La composición de la reivindicación 12, en la que el recubrimiento de liberación controlada comprende una tercera población de micropartículas que tienen un agente farmacéuticamente activo dispuesto en su interior.
14. La composición de la reivindicación 13, en la que la tercera población de micropartículas es igual que la primera población de micropartículas.
15. La composición de la reivindicación 13 o 14, en la que la tercera población de micropartículas es igual que la segunda población de micropartículas.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
 Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Composición farmacéutica en forma de solución oral de la sal de ibuprofeno con lisina, del 27 de Julio de 2020, de MMC INTERNATIONAL HEALTH HOLDING, S.L: La presente invención se refiere a una composición farmacéutica en forma de solución oral de la sal de ibuprofeno con lisina, que comprende un sistema viscosizante […]
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Nanopartículas estabilizadas con composiciones de ácido nitrofenilborónico, del 15 de Julio de 2020, de CALIFORNIA INSTITUTE OF TECHNOLOGY: Una nanopartícula que comprende un polímero que contiene un poliol y un polímero que contiene un ácido nitrofenilborónico, en donde el polímero que contiene […]
Formulaciones de productos biológicos para instilación intravesical, del 1 de Julio de 2020, de ALLERGAN, INC.: Composición farmacéutica que comprende una cantidad terapéuticamente eficaz de un derivado de Clostridium y al menos un agente de permeabilización, en la que […]
Tratamiento de disfunción eréctil y otras indicaciones, del 1 de Julio de 2020, de STRATEGIC SCIENCE & TECHNOLOGIES, LLC: Una composición para su uso en un método de tratamiento de la disfunción sexual en un sujeto, preferiblemente un sujeto humano, comprendiendo la composición: […]