Ensayo para medir los complejos de factor VIIa-antitrombina.
Procedimiento para la medición de la concentración de complejos de factor VIIa-antitrombina en una muestraplasmática de un paciente que comprende las etapas siguientes:
mezclar una cantidad de dicha muestra plasmática con un anticuerpo de captura primario fijado a una fase sólida,estando dicho anticuerpo primario caracterizado porque presenta una capacidad de unión
a) a la parte de factor VIIa o
b) a la parte de antitrombina
de los complejos de factor VIIa-antitrombina que pudieran estar presentes en dicha muestra plasmática, e incubardicha mezcla bajo unas condiciones que promuevan la unión entre dicho anticuerpo de captura y dichos complejosde factor VIIa-antitrombina que pudieran estar presentes en dicha muestra plasmática para formar complejos defactor VIIa-antitrombina unidos y una mezcla no unida;
extraer dicha muestra no unida;
mezclar dichos complejos de factor VIIa-antitrombina unidos con un anticuerpo secundario caracterizado porquepresenta una capacidad de unión
a) a la parte de antitrombina o
b) a la parte de factor VIIa, respectivamente,
de dichos complejos de factor VIIa-antitrombina unidos para formar complejos de factor VIIa-antitrombinaanticuerposecundario unidos y una mezcla de anticuerpo secundario no unido;
extraer cualquier mezcla de anticuerpo secundario no unido;
determinar la cantidad de anticuerpo secundario unido; y
comparar la cantidad de anticuerpo secundario unido con una cantidad estándar de anticuerpo secundario unidodeterminada para los complejos de factor VIIa-antitrombina unidos de una concentración conocida.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/021081.
Solicitante: OKLAHOMA MEDICAL RESEARCH FOUNDATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 825 N.E. 13TH STREET OKLAHOMA CITY, OK 73104 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MORRISSEY, JAMES, H.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/37 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › peptidasa o proteinasa.
PDF original: ES-2407355_T3.pdf
Fragmento de la descripción:
Ensayo para medir los complejos de factor VIIa-antitrombina.
Campo técnico de la invención La presente invención se refiere a ensayos in vitro de trastornos de la coagulación de la sangre.
Antecedentes Se han diseñado varios ensayos clínicos para medir el grado de reemplazo del sistema de coagulación de la sangre. Estos ensayos se utilizan de forma rutinaria para evaluar la severidad de coagulopatías como la coagulación intravascular diseminada (CID) . Muchos de estos ensayos también se están estudiando por su utilidad para la predicción de estados hipercoagulables que pueden predisponer a una persona a desarrollar trombosis venosa profunda (TVP) , ataques de corazón, apoplejía isquémica, u otros trastornos trombóticos o tromboembólicos. Los ejemplos de estos ensayos son las mediciones de los niveles plasmàticos del fibrinopéptido A, los complejos trombina-antitrombina, el fragmento de protrombina 1+2, los dímeros-D, y el factor VIIa (Amiral, J and Fareed, J. (1966) . “Thromboembolic diseases: biochemical mechanisms and new possibilities of biological diagnosis”, Semin Thromb Hemost 22 Suppl, 1:41-48; Gouin-Thibault, I. and Samana, M.M. 1999. “Laborator y diagnosis of the thrombophilic state in cancer patients”, Semin Thromb Hemost 25: 167-172; Morrissey, J. H. et al. 1993. “Quantitation of activated factor VII levels in plasma using a tissue factor mutant selectively deficient in promoting factor VII activation”, Blood 81: 734-744; and Morrissey, J. H. 1996. “Plasma factor VIIa: Measurement and potential clinical significance”, Haemostasis 26: 66-71. Estos ensayos permiten conocer in vivo el grado de la activación en curso del sistema de coagulación de la sangre. Por ejemplo, los niveles de fibrinopéptido A y dímero D reflejan el grado en el que el fibrinógeno se convierte en fibrina. Los niveles de complejos trombina-antitrombina y del fragmento de protrombina 1+2 reflejan in vivo el grado en el que la protrombina se convierte en trombina. No se pueden medir los niveles de actividad de la trombina en plasma directamente porque la enzima activa presenta una vida media en plasma muy corta (debido al elevado contenido en plasma de los inhibidores de la proteasa) . Por consiguiente, los niveles de los complejos trombina-antitrombina reflejan la tasa en curso de la activación de trombina in vivo ya que la antitrombina (conocida anteriormente como antitrombina III ó ATIII) es un importante inhibidor de la trombina en plasma, y porque estos complejos presentan una vida media mucho más elevada que la trombina. Asimismo, el fragmento de protrombina 1+2 se libera a partir de la protrombina cuando se activa por la trombina, y estos fragmentos pueden circular en plasma a niveles mensurables. Por estas razones, se piensa que las mediciones tanto de complejos trombina-antitrombina como del fragmento de protrombina 1+2 en plasma reflejan la tasa en curso de la generación de trombina in vivo.
Además de estos ensayos específicos sobre la activación de la trombina, también se han desarrollado ensayos para medir los marcadores plasmàticos de otros factores de la coagulación de la sangre. En el caso de los factores IX y X, así como con la trombina, las proteasas activas (factores IXa y Xa) presentan una vida media en plasma muy corta y por consiguiente no es posible medir sus niveles directamente. Sin embargo, como con la protrombina, los ensayos se han desarrollado para evaluar el grado de activación de los factores IX y X. Un grupo de procedimientos implica la medición de los niveles plasmàticos de los péptidos de activación liberados por los factores IX, X cuando se convierten en factores IXa y Xa. Estos péptidos de activación circulan con una vida media más larga que las proteasas activadas en sí mismas, y los ensayos basados en la medición de los niveles de estos péptidos de activación se han desarrollado y se han aplicado en varios estudios epidemiológicos (Bauer, K.A. 1994, "New markers for in vivo coagulation", Curr Opin Hematol 1:341-346; Bauer K. A. 1999. “Activation markers of coagulation”, Baillieres Best Pract Res Clin Haematol 12: 387-406; and Cooper, J. A. et al. 2000. “Comparison of novel hemostatic factors and conventional risk factors for prediction of coronar y heart disease”, Circulation 102: 2816-2822) .
Otra forma de evaluar la tasa en curso de la activación de los factores IX o X es mediante la medición de los niveles de complejos de circulación del factor IXa o del factor Xa con sus inhibidores plasmàticos. Esto se ha hecho con los complejos factorIXa-antitrombina (Takahashi, et al. 1991 “Activated factor IX-anthithrombin III complexes in human blood: quantification by an enzyme-linked differential antibody immunoassay and determination of the in vivo halflife”, J Lab Clin Med 118: 317-325) y con los complejos factor Xa-antitrombina (Gouien-Thibault, I. et al. 1995. “Measurement of factor Xa-antithrombin III in plasma: relationship of prothrombin activation in vivo”, Br J Haematol
90: 669-680; Bauer, K. A. 1994. “New markers for in vivo coagulation”, Curr Opin Hematol 1: 341-346; y Bauer, K. A. 1999. “Activation markers of coagulation”, Baillieres Best Pract Res Clin Haematol 12: 387-406) . Además, también se ha desarrollado ensayos para medir los niveles de circulación de complejos entre el factor Xa y el inhibidor de la vía del factor tisular (IVFT) (Okugawa, Y. et al. 2000. “Increased plasma levels of of tissue factor pathway inhibitoractivated factor X complex in patients with disseminated intravascular coagulation”, Am J Hematol 65: 210-214; Iversen, N. et al. 2000. “Tissue factor pathway inhibitor (TFPI) in disseminated intravascular coagulation: low levels of the activated factor X-TFPI complex”, Blood Coagul Fibrinolysis 11: 591-598; Iversen, N. et al. 2000. “Tissue factor pathway inhibitor (TFPI) in disseminated intravascular coagulation: low levels of the activated factor X-TFPI complex”, Blood Coagul Fibrinolysis 11: 591-598; y Miller, G. J. 2000. “Haemostatic factors in human peripheral afferent lymph”, Thromb Haemost 83: 427-432) .
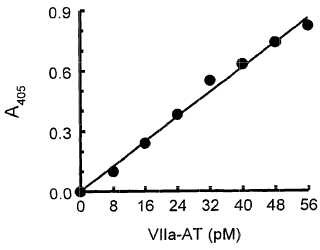
El factor de coagulación VII se convierte en la forma activada, factor VIIa, mediante la proteólisis de la unión de un solo péptido (Morrissey, J. H. 2001. “Tissue factor and factor VII initiation of coagulation”, Hemostasis and Thrombosis: Basic Principles and Clinical Practice, R. W. Colman et al. eds., Philadelphia: Lippincott Williams & Wilkins, pp. 89-101) . Por esta razón no es posible monitorizar la activación del factor VII utilizando un ensayo de activación del péptido, como se ha hecho con la protrombina o los factores IX o X. Sin embargo, el factor VIIa presenta una vida media relativamente elevada (aproximadamente 2 horas) , y por lo tanto ha sido posible desarrollar un ensayo de coagulación (basándose en una forma mutada del factor tisular) que puede medir específicamente los niveles del factor activo VIIa en plasma (Morrissey, J. H. et al. 1993. “Quantitation of activated factor VIIa in plasma using a tissue factor mutant selectively deficient in promoting factor VII activation”, Blood 81: 734-744) .
La medición de los niveles plasmáticos del factor VIIa es de interés porque el sistema de coagulación de la sangre se inicia cuando el factor VII o VIIa se une al factor tisular (una proteína de membrana integral) en las superficies celulares. El complejo de unión de membrana resultante del factor VIIa y el factor tisular es el iniciador de la coagulación de la sangre más potente que se conoce. El factor tisular está presente normalmente sólo en células fuera del sistema vascular, y desencadena la coagulación sanguínea en una hemostasia normal que sigue a una lesión vascular, lo que permite de esta forma que la sangre entre en contacto con el factor tisular. La expresión del factor tisular se puede inducir en células monocíticas y endoteliales mediante mediadores de la inflamación. Se cree que la expresión inducida del factor tisular es la responsable de la activación patológica de la coagulación sanguínea que desencadenan varios trastornos trombóticos (Morrissey, J. H. 2001. “Tissue factor and factor VII initiation of coagulation”, in Hemostasis and Thrombosis: Basic Principles and Clinical Practice, R. W. Colman et al. eds., Philadelphia: Lippincot Williams & Wilkins, pp. 89-101) .
El factor VIIa presenta una vida media plasmática elevada porque es esencialmente no reactivo frente los otros inhibidores de la proteasa en el plasma en ausencia de su cofactor, el factor tisular (Morrissey, J. H. 2001. “Tissue factor and factor VII initiation of coagulation”, in Hemostasis and Thrombosis:... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la medición de la concentración de complejos de factor VIIa-antitrombina en una muestra plasmática de un paciente que comprende las etapas siguientes:
mezclar una cantidad de dicha muestra plasmática con un anticuerpo de captura primario fijado a una fase sólida, estando dicho anticuerpo primario caracterizado porque presenta una capacidad de unión a) a la parte de factor VIIa o b) a la parte de antitrombina de los complejos de factor VIIa-antitrombina que pudieran estar presentes en dicha muestra plasmática, e incubar dicha mezcla bajo unas condiciones que promuevan la unión entre dicho anticuerpo de captura y dichos complejos de factor VIIa-antitrombina que pudieran estar presentes en dicha muestra plasmática para formar complejos de factor VIIa-antitrombina unidos y una mezcla no unida;
extraer dicha muestra no unida;
mezclar dichos complejos de factor VIIa-antitrombina unidos con un anticuerpo secundario caracterizado porque presenta una capacidad de unión a) a la parte de antitrombina o b) a la parte de factor VIIa, respectivamente,
de dichos complejos de factor VIIa-antitrombina unidos para formar complejos de factor VIIa-antitrombinaanticuerpo secundario unidos y una mezcla de anticuerpo secundario no unido;
extraer cualquier mezcla de anticuerpo secundario no unido;
determinar la cantidad de anticuerpo secundario unido; y
comparar la cantidad de anticuerpo secundario unido con una cantidad estándar de anticuerpo secundario unido determinada para los complejos de factor VIIa-antitrombina unidos de una concentración conocida.
2. Procedimiento según la reivindicación 1, en el que dicha cantidad estándar de anticuerpo secundario unido se determina para una pluralidad de concentraciones conocidas de complejos de factor VIIa-antitrombina unidos mezclando una cantidad de dicha concentración conocida de complejos de factor VIIa-antitrombina con un anticuerpo de captura primario caracterizado porque presenta una capacidad de unión a) a la parte de factor VIIa o b) a la porción de antitrombina de los complejos de factor VIIa-antitrombina e incubando dicha mezcla bajo unas condiciones que promuevan la unión entre dicho anticuerpo de captura y dichos complejos de factor VIIa-antitrombina para formar los complejos de factor VIIa-antitrombina unidos; extrayendo la mezcla no unida; mezclando dichos complejos de factor VIIaantitrombina unidos con un anticuerpo secundario caracterizado porque presenta una capacidad de unión a) a la porción de antitrombina o b) a la parte de factor VIIa de dichos complejos de factor VIIa-antitrombina unidos; extrayendo cualquier anticuerpo de captura no unido; y
determinando la cantidad de anticuerpo secundario unido; y correlacionando dichas concentraciones conocidas de complejos de factor VIIa-antitrombina con dicha cantidad de anticuerpo secundario unido para formar una curva estándar.
3. Procedimiento según la reivindicación 1 ó 2, en el que dicho anticuerpo secundario es detectable mediante un marcador seleccionado de entre el grupo que consiste en marcador enzimático, marcador radioisotópico, marcador no radioactivo, marcador fluorescente, marcador de toxinas y marcador quimioluminiscente.
4. Procedimiento según las reivindicaciones 1 a 3, en el que un anticuerpo terciario caracterizado porque presenta una capacidad de unión a dicho anticuerpo secundario unido se hace reaccionar con dicho anticuerpo secundario unido, siendo dicho anticuerpo terciario detectable mediante un marcador seleccionado de entre el grupo que consiste en marcador enzimático, marcador por radioisotópico, marcador no radioactivo, marcador fluorescente, marcador de toxinas y marcador quimioluminiscente.
5. Procedimiento según la reivindicación 1, en el que se miden los cambios en la exposición intravascular del factor tisular de un paciente, que comprende en un primer momento, mezclar una cantidad de dicha muestra plasmática del paciente con un anticuerpo de captura primario fijado a una fase sólida, estando dicho anticuerpo de captura caracterizado porque presenta una capacidad de unión a complejos de factor VIIa-antitrombina que pudieran estar presentes en dicha muestra plasmática, e incubar dicha mezcla bajo unas condiciones que promuevan la unión entre dicho anticuerpo de captura y dichos complejos de factor VIIa-antitrombina que pudieran estar presentes en dicha muestra plasmática para formar los complejos de factor VIIa-antitrombina unidos y una mezcla no unida;
extraer dicha mezcla no unida;
mezclar dichos complejos de factor VIIa-antitrombina unidos con un anticuerpo secundario caracterizado porque presenta una capacidad de unión a dichos complejos de factor VIIa-antitrombina unidos para formar los complejos de factor VIIa-antitrombina-anticuerpo secundario unidos y el anticuerpo secundario no unido;
extraer dicho anticuerpo secundario no unido;
determinar la cantidad de anticuerpo secundario unido; y
comparar la cantidad de anticuerpo secundario unido con una cantidad estándar de anticuerpo secundario unido determinada para los complejos de factor VIIa-antitrombina unidos de una concentración conocida para obtener la concentración de complejos de factor VIIa-antitrombina en dicha muestra plasmática del paciente en dicho primer momento;
en una segundo momento, determinar la concentración de complejos de factor VIIa-antitrombina en dicha muestra plasmática del paciente mediante la repetición del procedimiento utilizado en dicho primer momento, y comparar la cantidad de complejos de factor VIIa-antitrombina en cada momento para comprobar si la cantidad aumenta, disminuye o permanece igual,
en el que un aumento en la concentración de complejos de factor VIIa-antitrombina en dicha muestra plasmática del paciente en dicho segundo momento en comparación con la concentración de complejos de factor VIIaantitrombina en dicha muestra plasmática del paciente en dicho primer momento representa un aumento en dicha exposición intravascular del factor tisular del paciente y en el que una disminución de la concentración de complejos de factor VIIa-antitrombina en dicha muestra plasmática del paciente en dicho segundo momento en comparación con la concentración de complejos de factor VIIa-antitrombina en dicha muestra plasmática del paciente en dicho primer momento representa una disminución en dicha exposición intravascular del factor tisular del paciente.
6. Procedimiento según la reivindicación 5, en el que dicho anticuerpo de captura unido se une a la parte de factor VIIa de un complejo de factor VIIa-antitrombina.
7. Procedimiento según la reivindicación 5, en el que dicho anticuerpo de captura unido se une a la porción de antitrombina de un complejo de factor VIIa-antitrombina.
8. Procedimiento según la reivindicación 1, en el que se mide el riesgo del paciente de entrar en un estado hipercoagulable, que comprende
medir la cantidad de complejos de factor VIIa-antitrombina en una muestra plasmática de dicho paciente en un primer momento;
medir la cantidad de complejos de factor VIIa-antitrombina en una muestra plasmática de dicho paciente en un segundo momento; y
comparar la cantidad de complejos de factor VIIa-antitrombina en una muestra plasmática de dicho paciente en dicho segundo momento con cantidad de complejos de factor VIIa-antitrombina en una muestra plasmática de dicho paciente en dicho primer momento,
en el que un aumento de la cantidad de complejos de factor VIIa-antitrombina en una muestra plasmática de dicho paciente en dicho segundo momento con respecto a la cantidad de complejos de factor VIIa-antitrombina en una muestra plasmática de dicho paciente en dicho primer momento indica un aumento del riesgo de dicho paciente de entrar en un estado hipercoagulable y en el que una disminución de la cantidad de complejos de factor VIIaantitrombina en una muestra plasmática de dicho paciente en dicho segundo momento con respecto a la cantidad de complejos de factor VIIa-antitrombina en una muestra plasmática de dicho paciente en dicho primer momento indica una disminución del riesgo de dicho paciente de entrar en un estado hipercoagulable.
9. Procedimiento para la monitorización de la eficacia de la terapia anticoagulante in vitro evaluando los complejos de factor VIIa-antitrombina mediante el procedimiento según la reivindicación 1 en un primer momento y en un segundo momento, y comparando los valores obtenidos en el que un aumento en dichos complejos en dicho segundo momento indica un posible fracaso de dicha terapia o la necesidad de un ajuste de dicha terapia para evitar la aparición de eventos de coagulación no deseados.
Patentes similares o relacionadas:
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Método para producir un nuevo Factor C recombinante, método para mitigar la inhibición de la reacción en ensayos de endotoxina, y método para medir endotoxina, del 5 de Febrero de 2020, de SEIKAGAKU CORPORATION: Un método para mitigar una inhibición de reacción en ensayo de endotoxina en presencia de un ion salino, comprendiendo el método: mezclar […]
Deshidrogenasa y toxina de Clostridium difficile como un biomarcador, del 18 de Diciembre de 2019, de TECHLAB, INC.: Un método para medir una cantidad de C. difficile en una muestra fecal, el método que comprende: medir cuantitativamente un nivel de lactoferrina, […]
Procedimientos de medición de la actividad del factor D y la potencia de los inhibidores del factor D, del 11 de Diciembre de 2019, de F. HOFFMANN-LA ROCHE AG: Un procedimiento de medición de la actividad del factor D en una muestra, que comprende realizar un ensayo de medición basado en proximidad, en el que el […]
Inducción apoptótica selectiva en células cancerosas incluyendo la activación de procaspasa-3, del 2 de Octubre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: Un compuesto de fórmula ZZ:**Fórmula** en donde n= 1 o 2; R, independientemente de otra R, es hidrógeno, halógeno, alilo o grupo alquilo que tiene de 1 […]
Ensayos de actividad de endopeptidasa redirigida basados en inmunología, del 2 de Octubre de 2019, de ALLERGAN, INC.: Método para detectar actividad endopeptidasa redirigida, comprendiendo el método las etapas de: a) tratar una célula de una línea celular establecida […]
Ensayos de actividad de serotipo A de toxina botulínica de base inmunológica, del 24 de Julio de 2019, de ALLERGAN, INC.: Método de detección de actividad de NTBo/A en un mamífero, que comprende las etapas de: a. tratar una célula de una línea celular establecida que expresa SNAP-25 con una muestra […]
Hemocultivo del mismo día con microscopia digital, del 3 de Julio de 2019, de Accelerate Diagnostics, Inc: Un método, que comprende las etapas de: a) introducir un medio de cultivo, un agente lítico y una enzima de escisión de desechos celulares en una muestra de sangre, […]