Procedimiento para la detección colorimétrica de lisozima en orina por nanopartículas agregadas de oro.
Procedimiento para la detección colorimétrica de lisozima en orina por nanopartículas agregadas de oro.
La presente invención tiene por objeto un procedimiento que permite detectar lisozima en orina, empleando nanopartículas de oro protegidas con iones citrato tras ser sometidas a un procedimiento de agregación.
Es una herramienta de diagnóstico médico eficaz que permitirá la detección de diversas patologías como algunos tipos de leucemia o enfermedades renales.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201400372.
Solicitante: UNIVERSIDAD DE SEVILLA.
Nacionalidad solicitante: España.
Inventor/es: CASTILLO HERNANDEZ,PAULA MARGARITA, PRADO GOTOR,Rafael.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/34 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que interviene una hidrolasa.
- G01N21/33 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 21/00 Investigación o análisis de los materiales por la utilización de medios ópticos, es decir, utilizando rayos infrarrojos, visibles o ultravioletas (G01N 3/00 - G01N 19/00 tienen prioridad). › utilizando la luz ultravioleta (G01N 21/39 tiene prioridad).
- G01N33/493 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › de orina.
Fragmento de la descripción:
Procedimiento para la detección colorimétrica de lisozima en orina por nanopartículas agregadas de oro.
Objeto de la invención
La presente invención es una adición a la patente P201300722 de título "Procedimiento para la detección colorimétrica de lisozima por nanopartículas agregadas de oro", y tiene por objeto un procedimiento que permite detectar lisozima en orina, empleando para ello nanopartículas de oro protegidas con iones citrato siguiendo el procedimiento patentado previamente en disolución acuosa y que se presenta aquí extendido en orina y con algunas modificaciones.
Es una herramienta de diagnóstico médico eficaz que permitirá la detección en orina, de diversas patologías asociadas a variaciones en la concentración de lisozima como algunos tipos de leucemia y enfermedades renales.
Estado de la técnica
La lisozima es una proteína catiónica, de carácter fuertemente básico, descrita por primera vez por Fleming en 1922 (On remarkable bacteriolytic element found in tissues and secretions. Fleming, A.. Proc. Roy. Soc., London, Series B, 93, 306 (1922)). Su principal propiedad es la de producir la lisis de la pared celular de ciertos tipos de bacterias, por lo que tiene una función relacionada con la respuesta inmunitaria del organismo, y se halla presente de forma natural en secreciones como las lágrimas. Sin embargo, pronto se encontró, una relación entre la presencia de lisozima y ciertas alteraciones del sistema inmunitario, encontrándose ésta particularmente ligada a los leucocitos al reportarse su presencia en pus de pacientes infectados con diversas afecciones, entre ellas tuberculosis (Observations on a bacterilolytic substance ("lysozyme") found in secretions and tissues. Fleming, A. Allison, V. D., , Brit. J. Exp. Path. 13, 252 (1922)).
La producción de un exceso de lisozima, detectadle en orina y otros fluidos biológicos (tales como el suero sanguíneo) fue determinada como síntoma propio de la leucemia monocítica y mielomonocítica (ambas subtipos de la leucemia mieloide aguda) en la década de 1960, atribuyéndose su aparición en orina a su pequeño peso molecular (Serum and Urinary Lysozime (muraminidase) in Monocytic and Monomyelocytic Leukemia. Ossermann, E. F. Lawlor, D. The
Journal of Experimental Medicine 124, 921-951P. LAWL (1966)) (Leukocyte Lysozyme Activity in Myelocytic Leukemia. Noble, R.E. Fudenberg, H. H. Blood 30: 465-473 (1967)). Aunque se trata de un rasgo compartido con otros trastornos renales, tales como el síndrome nefrótico o ciertas infecciones del tracto urinario, se encontró que la producción de lisozima detectada en orina y en suero para casos de leucemia de tipo monocítico era marcadamente superior (25 - 420 pg/ml en orina frente a 10 - 30 pg/ml para otros trastornos de tipo no leucémico) siendo este fuerte exceso de lisozima, por tanto, un buen indicador de la presencia de la enfermedad (Serum and Urinary Lysozime (muraminidase) in Monocytic and Monomyelocytic Leukemia. Ossermann, E. F. Lawlor, D. The Journal of Experimental Medicine 124, 921-951P. LAWL (1966)). A pesar de existir una fuerte vinculación entre este exceso de lisozima y una producción anormal de leucocitos, el estudio de otras enzimas presentes en los mismos tales como la fosfatasa, la (3- glucuronidasa o la catepsina en orina no arrojó valores anormales para pacientes leucémicos; esto puede deberse o bien a que los leucocitos asociados a trastornos leucémicos generan una cantidad excesiva de lisozima con respecto a los leucocitos normales, o bien a que el resto de proteínas, debido a sus características fisicoquímicas, no se excretan de forma tan marcada en la orina. También se ha postulado que pueden existir alteraciones de la función renal aparejadas a estos tipos de leucemia, que causarían una disminución de la reabsorción de la lisozima en el riñón provocando lisozimuria (Serum and Urinary Proteins, Lysozyme (Muramidase), and Renal Dysfunction in Mono- and Myelomonocytic Leukemia. Pruzanski, W. Platts, M. E.. The Journal of Clinical Investigation, 49 1694-1708 (1970)).
Además, se han reportado alteraciones de los niveles normales de lisozima ligados a otros tipos de leucemias; por ejemplo, diversos estudios, describen que la leucemia linfoblástica aguda, que es considerada actualmente el principal tipo de leucemia infantil, causa una fuerte disminución de la concentración de lisozima en suero, habiéndose encontrado valores experimentales de alrededor de la mitad frente a los casos de control (Leukocyte Lysozyme Activity in Myelocytic Leukemia. Noble, R.E. Fudenberg, H. H.. Blood 30: 465-473 (1967)), (Biochemistry of Human Cáncer. Bodansky, O., Academic Press Inc. Nueva York, , pgs 239-240(1975)), (Serum lysozyme activity in children with hematological and malignant disorders. Moe PJ, Haneberg B, Finne PH. Acta Paediatr Scand., 64(6):830-2. (1975))
(Recurso Web de la American Cáncer Society, http://www.cancer.org/cancer/leukemiainchildren/index . (2014)).
Los métodos de determinación de lisozima en muestras biológicas en la actualidad se basan, en su mayoría, en la actividad catalítica de la enzima; así, Smolelis y Hartsell (The Determination of Lysozime. Smolelis, A. N. Hartsell, S. E., J Bacteriol., 58(6): 731-736 (1949)), describen un método general basado en una suspensión celular de M. Lysodeikticus, que se mezcla con la muestra problema de lisozima; tras un periodo de incubación de 20 minutos, se mide la transmitancia de la disolución y se determina la concentración de la muestra por comparación con una recta patrón.
Ossermann et al.desarrollaron un método para la detección de lisozima en orina empleando como indicador, de nuevo, preparaciones de M. Lysodeikticus sobre soporte de agar (Serum and Urinary Lysozime (muraminidase) in Monocytic and Monomyelocytic Leukemia. Ossermann, E. F. Lawlor, D., The Journal of Experimental Medicine 124, 921-951P. LAWL (1966)). Por incubación durante 12- 18 horas a temperatura ambiente, la enzima causa la aparición de "claros" en la preparación bacteriana al hidrolizar la pared celular; el diámetro de estas marcas se considera proporcional al logaritmo de la concentración de lisozima en la muestra. Selsted y Martínez describen en 1980 una variante del mismo método, adaptada para detectar concentraciones de hasta 5 pg/ml (A simple and ultrasensitive enzymatic assay for the quantitative determination of lysozyme in the picogram range. Selsted, M. E. Martínez, R. J., Analytical Biochemistry 109 1, 67- 70 (1980)).
Actualmente no existe ningún procedimiento de detección de lisozima en orina, el Kit actualmente disponible es únicamente para muestras de suero sanguíneo, empleado en hospitales (Human Lysozyme `NL NANORID Radial Immunodiffusion Kit), sólo para uso hospitalario y diagnóstico in Vitro.
Además de la complicación relativa a la necesidad de la extracción y tratamiento para las muestras hospitalarias del método convencional, nuestro procedimiento aporta ventajas adicionales. Una importantísima, es el tiempo de respuesta. Con la metodología que proponemos la detección de lisozima es inmediata. Resultados muy recientes muestran además que se puede cuantificar
la proteína en orina sin problemas con la presencia de otros interferentes. El método existente en suero sanguíneo NANORID, se basa en las medidas de los diámetros de los aros de precipitado formados por la interacción del antígeno presente en una muestra y el anticuerpo suministrado en un gel de agarosa. El kit descrito, y el gel en concreto que contiene caros anticuerpos, requiere una conservación (limitada a 2-8°C) y una preparación exhaustiva que debe realizar personal cualificado. En el protocolo afirman que el método presenta problemas en la medida del aro de precipitado por lo que los resultados son variables y dependen del tiempo de incubación, temperatura y humedad. El método además presenta poca sensibilidad a bajas concentraciones y requiere la preparación de disoluciones y manipulación de reactivos potencialmente infecciosos, peligrosos y corrosivos.
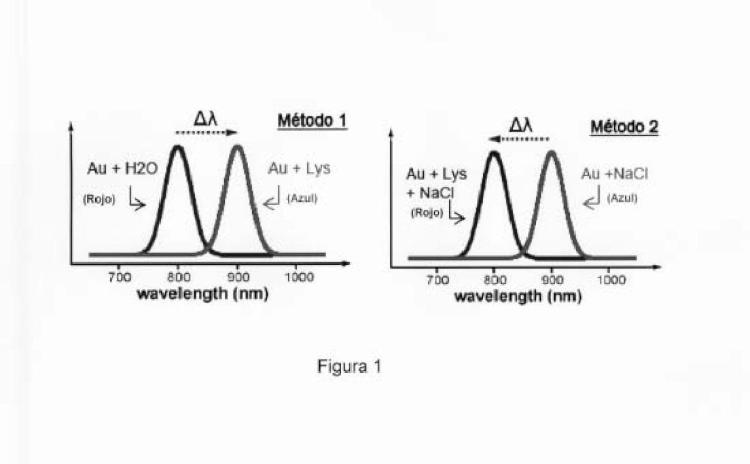
Nuestro método (Figura 1) no requiere personal cualificado, pues la medida final se basa en la observación colorimétrica y posterior comparación con colores de referencia (Figura 2). Pese a utilizar oro, la concentración de éste metal noble es tan pequeña que con 1 euro se podría preparar la cantidad de nanopartículas requerida para 30 pruebas. Ninguno de los reactivos que contiene nuestro método son peligrosos, ni corrosivos. Nuestro método permite además determinación al menos micromolar de la proteína en orina, superando la sensibilidad del método en suero y permitiendo la detección precoz de enfermedad renal (Figura 3). El método es rápido pues se determina por observación directa y no requiere compleja...
Reivindicaciones:
1Procedimiento colorimétrico para la detección y/o cuantificación de lisozima en orina, que comprende:
a) añadir un biosensor de color azul constituido por nanopartículas de oro protegidas con iones citrato (AuNPs) agregadas con NaCI, a una muestra problema de orina y
b) determinar el grado de desagregación de las nanopartículas a simple vista o mediante espectroscopia UV-visible tras el estudio del desplazamiento que se produce hacia menores valores en la longitud de onda (color rojo) en la muestra de orina que contiene lisozima.
2.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima en orina de acuerdo a la reivindicación 1, en el que las nanopartículas de Au tienen un diámetro de 10 nm y han sido sintetizadas mediante la reducción en medio acuoso de una sal de oro con citrato sódico.
3.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima en orina, de acuerdo a las reivindicaciones anteriores caracterizado porque las nanopartículas de oro están en disolución acuosa.
4.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima en orina de acuerdo a las reivindicaciones anteriores caracterizado porque en el procedimiento de preparación del biosensor se toman como punto de referencia las nanopartículas de oro que han sido agregadas de forma controlada.
5.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima en orina de acuerdo a la reivindicación 4, caracterizado porque el punto de referencia se establece mediante la adición sobre las nanopartículas de oro, de NaCI a una concentración 0.1 M y 10 minutos de espera para la estabilización. 6
6.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima en orina de acuerdo a las reivindicaciones anteriores caracterizado porque la determinación de la concentración de lisozima de la muestra problema de orina
requiere, el valor obtenido en el punto de referencia según la reivindicación 5 y el valor obtenido para la muestra problema, logrado con un orden tiempos y concentración fijados.
7.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima en orina de acuerdo a la reivindicación 6, caracterizado porque el orden de adición fijado para obtener el valor de la muestra problema de lisozima es: primero las nanopartículas de oro (7.9x10'9M), posteriormente la sal NaCI (0,1 M) y un tiempo de espera de 10 minutos para su estabilización.
8.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima en orina de acuerdo a las reivindicaciones anteriores, caracterizado porque la determinación de la concentración de lisozima en orina (al menos 10'6 M) se realiza a simple vista o calculada por diferencia, mediante espectroscopia UV-vis, tras el estudio del desplazamiento que se produce hacia menores valores en la longitud de onda en la muestra que contiene lisozima.
9.- Uso del procedimiento colorimétrico para la detección y/o cuantificación de lisozima en orina de acuerdo a las reivindicaciones 1-8, para detectar/cuantificar la presencia de lisozima en una muestra de orina.
Patentes similares o relacionadas:
Sistema y dispositivos de ensayo de actividad enzimática, del 1 de Julio de 2020, de Københavns Universitet (KU): Un dispositivo de actividad enzimática adecuado para la determinación de la actividad de degradación enzimática de los biopolímeros en una muestra líquida, […]
Método mejorado para la determinación de microorganismos, del 6 de Mayo de 2020, de STORA ENSO OYJ: Un método para determinar el contenido de microorganismos en un material que comprende celulosa en la industria de la pulpa y el papel que comprende las etapas de: […]
Procedimiento rápido de detección de enzimas y de microorganismos, del 20 de Noviembre de 2019, de Bio-Rad Europe GmbH: Procedimiento de detección in vitro de una enzima de un microorganismo a partir de una muestra biológica, estando la enzima que se va a detectar seleccionada entre el grupo […]
Método para predecir la respuesta al tratamiento farmacológico con chaperona de enfermedades, del 12 de Junio de 2019, de AMICUS THERAPEUTICS, INC: Un método para recopilar una tabla de tratamiento de referencia que indica la capacidad de respuesta de una o más mutaciones específicas de […]
Método para la prueba de disolución de composiciones sólidas que contienen enzimas digestivas, del 8 de Mayo de 2019, de Allergan Pharmaceuticals International Limited: Un proceso para medir una cantidad de enzimas digestivas liberadas de una composición sólida de pancrelipasa en un medio de disolución que comprende utilizar espectroscopía […]
Método para detectar condiciones bacteriolíticas en una muestra, del 17 de Abril de 2019, de UNIVERSITAT DE BARCELONA: Un método para detectar una condición bacteriolítica seleccionada del grupo que consiste en estrés físico, la presencia de bacteriófagos, la presencia […]
Inhibidores de glicosidasa, del 27 de Febrero de 2019, de MERCK PATENT GMBH: Un medicamento que comprende un compuesto de fórmula (I)**Fórmula** en la que X1 designa S u O; X2, W designan independientemente […]
 Métodos para usar sustratos enzimáticos marcados con bodipy, del 11 de Febrero de 2019, de THE GENERAL HOSPITAL CORPORATION: Un metodo para detectar la actividad de una enzima beta-lactamasa en una muestra, que comprende:
poner en contacto la muestra con una composicion […]
Métodos para usar sustratos enzimáticos marcados con bodipy, del 11 de Febrero de 2019, de THE GENERAL HOSPITAL CORPORATION: Un metodo para detectar la actividad de una enzima beta-lactamasa en una muestra, que comprende:
poner en contacto la muestra con una composicion […]