COMPOSICIONES DE VACUNA QUE COMPRENDEN VIROSOMAS Y UN ADYUVANTE DE SAPONINA.
Una composición que comprende una preparación de virosomas de influenza y QS21
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/005786.
Solicitante: GLAXOSMITHKLINE BIOLOGICALS SA.
Nacionalidad solicitante: Bélgica.
Dirección: RUE DE L'INSTITUT 89 1330 RIXENSART BELGICA.
Inventor/es: COLLER,Beth-Ann, HENDERICKX,Véronique, GARCON,Nathalie M.J.
Fecha de Publicación: .
Fecha Solicitud PCT: 26 de Mayo de 2005.
Clasificación PCT:
- A61K39/145 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Orthomyxoviridae, p. ej. virus de la influenza.
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61K47/46 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Ingredientes de constitución indeterminada o sus productos de reacción, p. ej. piel, hueso, leche, fibra de algodón, cáscara de huevo, bilis de buey (oxgall) o extractos de plantas.
- A61K47/48
- A61K9/127 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Liposomas.
Clasificación antigua:
- A61K39/145 A61K 39/00 […] › Orthomyxoviridae, p. ej. virus de la influenza.
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61K47/46 A61K 47/00 […] › Ingredientes de constitución indeterminada o sus productos de reacción, p. ej. piel, hueso, leche, fibra de algodón, cáscara de huevo, bilis de buey (oxgall) o extractos de plantas.
- A61K47/48
- A61K9/127 A61K 9/00 […] › Liposomas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2356744_T3.pdf





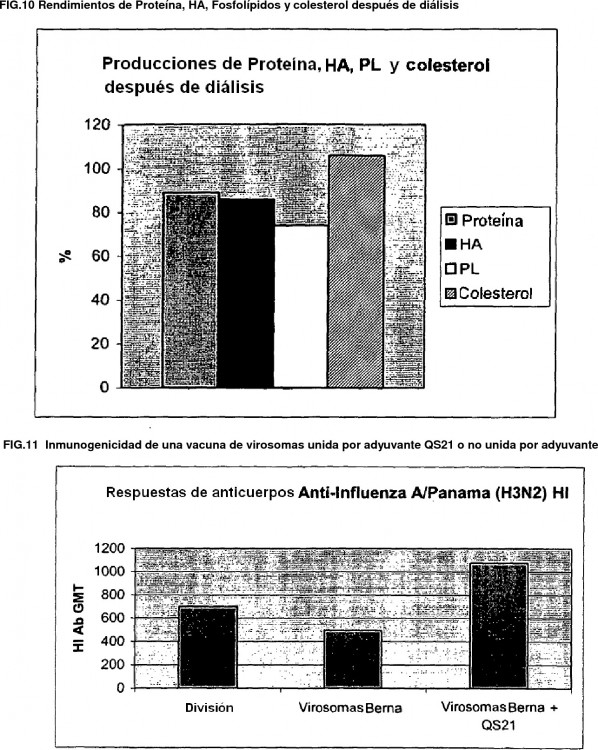
Fragmento de la descripción:
CAMPO TÉCNICO
La presente invención se refiere a composiciones que contienen virosomas de influenza, en particular virosomas unidos por adyuvantes, a procedimientos para prepararlos y a su uso en profilaxis o terapia. En particular la presente invención se refiere a composiciones que comprenden una preparación de virosomas de influenza, y 5 QS21.
ANTECEDENTES DE LA TÉCNICA
Un virus con envoltura es uno en el que el núcleo del virus está rodeado por una cubierta externa rica en lípidos que contiene proteínas virales. Entre tales virus están los virus de las siguientes familias: flaviviridae (es decir, virus dengue, virus de Hepatitis C HEV, virus de encefalitis Japonesa, virus de la fiebre amarilla, virus del Nilo 10 Oeste), Poxviridae (es decir, virus de Viruela bovina, virus de la Viruela de monos, virus vaccinia, virus de la Viruela), Retroviridae (es decir, virus de inmunodeficiencia HIVISIV, paramyxoviridae (es decir, virus del sarampión, virus de las paperas, virus de Parainfluenza, metapneumovirus, virus Sincitial Respiratorio RSV), y Orthomyxoviridae (es decir, virus de influenza) por ejemplo.
El virus Sincitial Respiratorio (RSV) humano es un miembro de la familia Paramyxoviridiae de los virus y 15 provoca enfermedad del tracto respiratorio inferior, particularmente en niños jóvenes y bebés. Las recientes reseñas sugieren que RSV es también un patógeno importante en adultos, particularmente los ancianos.
RSV es un virus con envuelta con un genoma de ácido ribonucleico (RNA) no segmentado, de cadena negativa de 15.222 nucleótidos que codifica 11 ARN mensajeros, cada uno codificando un único polipéptido. Tres de las once proteínas son proteínas superficiales transmembrana: las proteínas G (unión), F (fusión) y SH. Una 20 proteína es la proteína (M) de matriz de viriones, tres proteínas son componentes de la nucleocápsida (N, P y L), y 2 proteínas son no estructurales (NS1 y NS2). Existen dos proteínas adicionales M2-1 y M2-2. Existen dos subgrupos antigénicamente distintos de RSV, denominados A y B. Caracterización de cepas de estos subgrupos ha determinado que las diferencias principales residen en las proteínas G, mientras que las proteínas F están conservadas. 25
El virus de influenza es uno de los virus más ubicuos en el mundo, que afecta tanto a seres humanos como al ganado. El impacto económico de influenza es significativo.
El virus de influenza es un virus con envuelta de ARN con un tamaño de partícula de aproximadamente 125 nm de diámetro. Consta básicamente de nucleocápsida interna o núcleo de ácido ribonucleico (ARN) asociado a nucleoproteína, rodeado por una envuelta viral con una estructura bicapa de lípidos y glicoproteínas externas. La 30 capa interna de la envuelta viral está compuesta predominantemente de proteínas de matriz y la capa externa principalmente del material de lípido derivado de huésped. Las glicoproteínas superficiales neuraminidasa (NA) y hemaglutinina (HA) aparece en puntas, de 10 a 12 nm de longitud, en la superficie de las partículas. Son estas proteínas de superficie, particularmente la hemaglutinina, las que determinan la especificidad antigénica de los subtipos de influenza. 35
Las epidemias de tipo influenza provocan incrementos en la incidencia de neumonía y enfermedad respiratoria inferior como se atestigua mediante tasas crecientes de hospitalización o mortalidad. Los ancianos o aquellos con enfermedades crónicas subyacentes es lo más probable que experimenten tales complicaciones, pero los niños pequeños también pueden sufrir enfermedad grave. Por lo tanto estos grupos en particular necesitan estar protegidos. 40
Las vacunas de influenza de todos los tipos son clásicamente trivalentes y pueden tomar la forma de o bien vacunas atenuadas vivas o formulaciones inactivadas. Usualmente contienen antígenos derivados de dos cepas de virus de influenza A y una cepa de virus de influenza B. Un estándar de dosis inyectable de 0,5 ml en la mayoría de los casos contienen 15 μg de componente de antígeno de hemaglutinina (HA) de cada cepa, como se mide por inmunodifusión radial individual (SRD) (J.M. Wood et al.: An improved single radial immunodiffusion 45 technique for the assay of influenza haemagglutinin antigen: adaptation for potency determination of inactivated whole virus and subunit vaccines. J. Biol. Stand. 5 (1977) 237 - 247; J. M. Wood et al., International collaborative study of single radial diffusion and immunoelectrophoresis techniques for the assay of hemaglutinina antigen of influenza virus. J. Biol. Stand. 9 (1981) 317 - 330).
En ciertas circunstancias, tal como la aparición de una cepa de influenza pandémica, puede ser deseable 50 tener una vacuna que contiene solamente la cepa individual. Esto ayudará a la velocidad de respuesta a una
situación pandémica. Las cepas de virus de influenza a incorporarse en la vacuna de influenza cada estación se determinan por la Organización Mundial de la salud en colaboración con las autoridades sanitarias nacionales y fabricantes de vacuna.
Las vacunas de influenza actualmente disponibles son o bien vacunas de influenza inactivadas o vacunas de influenza atenuadas vivas. Las vacunas de influenza inactivadas comprenden uno de los tres tipos de 5 preparación de antígeno: virus entero inactivado, sub- viriones donde la membrana de las partículas de virus está rota con detergentes u otros reactivos para solubilizar la envuelta de lípidos (denominada vacuna 'dividida') o subunidades de vacunas (producidas o bien de manera recombinante o purificadas a partir de partículas virales rotas) en particular subunidad de vacuna HA y NA. Virosomas son otro tipo de formulación de influenza inactivada, cuando se reconstituye membrana viral después de la rotura. Estas vacunas inactivadas se administran en general 10 por vía parenteral, en particular por vía intramuscular (i.rn.), pero algunas formulaciones basadas en virosoma y vacunas atenuadas vivas se han administrado por vía intranasal.
Aunque la inmunogenicidad y eficiencia de vacunas de influenza administradas por vía parenteral (por ejemplo, por vía intramuscular) en general se reconocen que son completamente altas en adultos sanos (18 - 60 años de edad) (eficiencia estimada alrededor de 75%), estos parámetros se reducen en sujetos ancianos (> 60 15 años de edad) (eficiencia estimada alrededor de 50%).
Ya que los sujetos ancianos son las personas con mayor riesgo de enfermedad grave inducida por influenza, especialmente las que residen en instalaciones de tipo residencias, esto da lugar a una mejora significativa en la eficiencia vacuna de influenza en los ancianos. De este modo de un diseño novedosos de vacuna de influenza con una eficiencia creciente parra los sujetos ancianos sería una mejora importante sobre las vacunas 20 actualmente disponibles.
Las vacunas de influenza administradas por vía parenteral son en general inmunogénicas y bien toleradas, sin embargo el nivel de inmunogenicidad y reactogenicidad asociada varía entre las diversas composiciones con un mayor nivel de inmunogenicidad y reactogenicidad asociada observada en general en las formulaciones más complejas (virus entero y dividido frente a la subunidad y virosoma). Diseñando de esta manera 25 una formulación novedosa que podría mejorar sustancialmente la inmunogenicidad de las vacunas de influenza comercialmente disponibles mientras se mantiene un perfil de reactogenicidad aceptable tiene un desafío permanente.
Como se ha dicho anteriormente, las vacunas de influenza comercialmente disponibles actualmente mantienen la vacuna dividida administrada por vía intramuscular, la vacuna de virus completo, vacunas de 30 subunidad inyectable o virosomas. En particular, las vacunas divididas y de subunidad se preparan rompiendo la partícula de virus, en general con un disolvente orgánico o un detergente, y separando o purificando las proteínas virales hasta grados variables. Las vacunas divididas se preparan mediante fragmentación del virus de influenza entero, o bien infecciosa o inactivada, con concentraciones de solubilización de disolventes orgánicos o detergentes y posterior retirada del agente solubilizante y alguno o la mayoría del material lipídico viral. Las 35 vacunas divididas en general contienen proteína de matriz contaminante (M) y nucleoproteína (NP) y algunas veces lípido, así como las proteínas de la envuelta de membrana (tales como HA y NA). Las vacunas divididas usualmente contendrán la mayoría o todas las proteínas estructurales... [Seguir leyendo]
Reivindicaciones:
1. Una composición que comprende una preparación de virosomas de influenza y QS21
2. Una composición según la reivindicación 1 que adicionalmente comprende esterol exógeno.
3. Una composición de acuerdo con la reivindicación 2 en la que el esterol exógeno se selecciona entre la lista que consiste en: sitosterol, estigmasterol, ergosterol, ergocalciferol y colesterol.
4. Una composición de acuerdo con la reivindicación 2 ó 3, en la que QS21 se formula con el esterol para formar 5 una estructura de liposomas.
5. Una composición de acuerdo con la reivindicación 2 o reivindicación 3, en la que QS21 se formula con el esterol para formar una estructura de ISCOM.
6. Una composición de acuerdo con cualquiera de las reivindicaciones 1 a 5, en la que la preparación de virosomas comprende además un fosfolípido exógeno. 10
7. Una composición de acuerdo con la reivindicación 6, en la que el fosfolípido exógeno es fosfatidilcolina o un derivado del mismo.
8. Una composición de acuerdo con cualquiera de las reivindicaciones 1 a 7, que comprende además un adyuvante adicional.
9. Una composición según la reivindicación 8 en la que el adyuvante adicional se selecciona entre el grupo que 15 consiste en: un agonista de receptores de tipo Toll, hidróxido de aluminio, fosfato de aluminio, tocoferol, y una emulsión de aceite en agua o una combinación de dos o más de dichos adyuvantes
10. Una composición según la reivindicación 9 en la que el agonista de receptores de tipo Toll se selecciona entre el grupo que consiste en: en particular en particular agonista de receptor 2 de tipo Toll, agonista de receptor 3 de tipo Toll, agonista de receptor 4 de tipo Toll, agonista de receptor 7 de tipo Toll, agonista de receptor 8 de tipo Toll 20 y agonista de receptor 9 de tipo Tollt.
11. Un procedimiento para preparar una composición inmunogénica, que comprende combinar una preparación de virosomas de influenza con QS21.
12. Un procedimiento según la reivindicación 11, en el que la preparación de virosomas de influenza es según cualquiera de las reivindicaciones 1 a 10. 25
13. Una composición de acuerdo con cualquiera de las reivindicaciones 1 a 10 para su uso en medicina.
14. El uso de una preparación de virosomas de influenza, y de QS21 en la fabricación de un medicamento para la profilaxis de una infección o enfermedad provocada por dicho virus en un individuo susceptible a él.
15. Uso según la reivindicación 14, en el que el individuo es un paciente anciano
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]