Métodos para la preparación de Drospirenona y productos intermedios de la misma.
El proceso para la preparación de 6β,7β,15β,16β
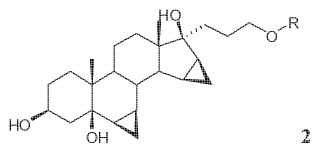
-dimetilen-3-oxo-17α-pregn-4-eno-21,17-carbolactona (Drospirenona, 5) a partir de un compuesto de la fórmula **Fórmula**
en donde R es un grupo protector hidroxilo seleccionado del grupo que consiste de un derivado de sililo Q3Si-, en donde cada Q, independientemente uno de otro, representa (C1-C6)alquilo, (C6-C10)arilo, (C1-C4)alquilarilo o (C1-C4)alcoxiarilo, dicho proceso comprende las siguientes etapas secuenciales: a) c): **Fórmula**
a) eliminación del grupo protector hidroxilo del compuesto de la fórmula 2 para dar 17β-(3-hidroxipropil)-6ß,7ß,15ß,16ß-dimetilen-5β-androstano-3β,5,17β-triol de la fórmula 3 **Fórmula**
b) reacción del compuesto de la fórmula 3 con un agente oxidante seleccionado de 1,3,5-tricloro-1,3,5-triazina-2,4,6-(1H,3H,5H)-triona (TCCA) en presencia de una base o con 1-hidroxi-1,2-benziodoxol-3(1H)-ona 1-óxido (IBX) para dar el compuesto de la fórmula 4 **Fórmula**
c) eliminación de agua de las posiciones C4-C5 del compuesto 4, con lo cual se obtiene Drospirenona 5;
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E10171743.
Solicitante: NEWCHEM S.P.A.
Nacionalidad solicitante: Italia.
Dirección: VIA DE AMICIS, 47 20123 MILANO ITALIA.
Inventor/es: MONTORSI,MAURO, Andriolo,Erika , Mariani,Edoardo , GAMBARIN,LUCA, ORRÙ,GIANMAURO, SCALAPRICE,ROMEO, MERLO,MASSIMO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07J53/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por condensación con ciclos carbocíclicos o por formación de un ciclo adicional por un enlace directo entre dos átomos de carbono cíclicos.
PDF original: ES-2419663_T3.pdf
Fragmento de la descripción:
Métodos para la preparación de Drospirenona y productos intermedios de la misma La invención se relaciona con un proceso para la preparación de Drospirenona y nuevos productos intermedios sintéticos de la misma. Los procesos involucran agentes oxidantes eficientes que permiten evitar el uso de oxidantes a base de metales pesados y obtener Drospirenona con altos rendimientos y pureza.
Antecedentes de la invención La Drospirenona es una progestina sintética ampliamente usada en terapia anticonceptiva. Químicamente conocida como 6β, 7β, 15β, 16β–dimetilen–3–oxo–17α–pregn–4–eno–21, 17–carbolactona, tiene la siguiente fórmula estructural
5.
Muchas vías sintéticas para la producción de Drospirenona se han propuesto hasta ahora, tales como, por ejemplo, las descritas en US6121465, WO2006/059168, WO2006/061309, US7585971B2, US7319154B2, US6933395, US4416985.
Los procesos de oxidación reportados en la materia anterior (WO2008/137050, US7585971B2, US7319154B2, EP075189/US4416985, US6933395BI y EP2019114A1) se realizaron comenzando a partir del compuesto 3 o a partir de una mezcla del compuesto 3y los epímeros de lactol 8
WO2008/137050 de Sicor describe la oxidación del producto intermedio 3 a Drospirenona usando permanganato potásico.
La preparación de Drospirenona 5 por oxidación del producto intermedio 3 y/o los lactoles epiméricos 8 usando reactivos tales como complejo de piridina–SO3 y TEMPO/hipoclorito cálcico, potasio terc–butilato/ciclohexanona, óxido de manganeso (IV) , o N–metilmorfolina N–óxido (NMMO) /Tetrapropilamonio perrutenato (TPAP) se describen en US7585971B2 de Industriale Chimica.
En US7319154B2 de Schering la oxidación del compuesto 3 a Drospirenona a través del producto intermedio 3– oxo–lactona 4usando TEMPO/hipoclorito sódico permite obtener Drospirenona 5 con 77% de rendimiento total.
EP075189/US4416985 de Schering describe la oxidación de 3 a 5 usando Cr (VI) O3/Pyr con 56% de rendimiento total.
US6933395B1 de Schering describe rendimientos totales de 65% para la oxidación de 3 a 5 usando bromato sódico como agente oxidante en presencia de cloruro de rutenio (III) .
Una conversión en dos etapas del producto intermedio 3 protegido en el grupo hidroxilo primario como el derivado de trimetilsililo (es decir, el compuesto 17α–[3– (trimetilsilaniloxi) propilo]–6β, 7β, 15β, 16β–dimetilen–5β–androstano– 3β, 5, 17β–triol 2a) en Drospirenona 5usando 1–hidroxi–1, 2–benziodoxol–3 (1H) –ona 1–óxido (ácido 2– yodoxibenzoico, IBX) seguido por el reactivo de Jones es describe en EP2019114AI de Newchem. La conversión procede con 51 % de rendimiento total.
WO 2010/118023, publicada después de la fecha de presentación de la presente solicitud pero reivindicando una prioridad anterior, describe el compuesto 17α–[3– (ter–butil–dimetilsilaniloxi) propil]–6β, 7β, 15β, 16β–dimetilen–5β– androstan–5, 17β–ol–3–ona.
Descripción de la invención De acuerdo con el proceso de la presente invención, la Drospirenona 5 se prepara comenzando a partir de un compuesto de la fórmula 2
en donde R es un grupo protector hidroxilo seleccionado del grupo que consiste de un derivado de sililo Q3Si–, en donde cada Q, independientemente uno de otro, representa (C1–C6) alquilo, (C6–Clo) arilo, (C1–C4) alquilarilo o (CI–
C4) alcoxiarilo, a través de una secuencia de etapas de oxidación, lactonización y eliminación de agua, en donde las etapas de oxidación y lactonización se realizan con 1, 3, 5–tricloro–1, 3, 5–triazina–2, 4, 6– (1H, 3H, SH) –triona (ácido tricloroisocianúrico, TCCA) , 1, 3–dicloro–1, 3, 5–triazina–2, 4, 6– (1H, 3H, 5H) –triona (ácido dicloroisocianúrico, DCCA) o una sal de metal alcalino de estos tal como la sal sódica dihidrato (sal sódica del ácido dicloroisocianúrico dihidrato, sal sódica de DCCA dihidrato) , o 1–hidroxi–1, 2–benziodoxol–3 (1H) –ona 1–óxido (IBX) .
En una primera modalidad de la invención, el proceso involucra la etapa inicial de eliminación del grupo protector hidroxilo R de un compuesto de la fórmula 2, seguido por las etapas de oxidación del 3β–hidroxi y del hidroxilo primario en posición C–22 con concomitante lactonización y la eliminación final del agua de las posiciones C4–5 para dar la Drospirenona 5.
En una segunda modalidad de la invención, el proceso involucra la eliminación del grupo protector hidroxilo R de un 5 compuesto de la fórmula 2 y las etapas concomitantes de oxidación del 3β–hidroxi y del hidroxilo en posición C–22, lactonización y eliminación de agua para formar directamente la Drospirenona 5.
En una tercera modalidad de la invención, el proceso involucra etapas secuenciales de oxidación del grupo 3β– hidroxi del compuesto 2, eliminación del grupo protector hidroxilo primario, oxidación/lactonización y eliminación final 10 de agua de las posiciones C4–5 para dar la Drospirenona 5.
De acuerdo con la primera modalidad, el proceso para la preparación de Drospirenona 5 a partir de un compuesto de la fórmula 2 involucra las siguientes etapas secuenciales: a) – c) :
a) eliminación del grupo protector hidroxilo del compuesto de la fórmula 2 como se definió anteriormente para dar 17α– (3–hidroxipropil) –6β, 7β15β, 16β–dimetilen–5β–androstano–3β, 5, 17β–triol de la fórmula 3
b) reacción del compuesto de la fórmula 3 con un agente oxidante seleccionado de TCCA en presencia de una base, o con IBX para dar el compuesto de la fórmula 4
c) eliminación de agua de las posiciones C4–C5 del compuesto 4, por lo cual se obtiene la Drospirenona 5. El proceso de acuerdo con la primera modalidad se resume en el siguiente Esquema 1:
Esquema 1
Los compuestos de la fórmula 2 se conocen y pueden prepararse a partir de 3β, 5–dihidroxi–6β, 7β, 15β, 16β– dimetilen–5β–androst–17–ona 1 como se describe en EP2019114A1.
En la etapa inicial a) compuesto 2 se desprotege para proporcionar el compuesto 3, es decir 17α– (3–hidroxipropil) – 6β, 7β, 15β, 16β–dimetilen–5β–androstano–3β, 5, 17β–triol.
Cuando el grupo protector R en 2 es (CH3) 3Si– (compuesto 2a) , la desprotección, si se desea, puede tener lugar durante la iniciación de la reacción a partir de la cual se obtiene 2a por 1, por contacto de2a con agua, como se describe en el Ejemplo 1.
Cuando R es –Si (CH3) 2[C (CH3) 3] (compuesto 2b) , la desprotección puede realizarse preferentemente por la reacción de 2 aislado con fluoruro de tetrabutilamonio en tetrahidrofurano, análogo al procedimiento descrito en el Ejemplo 10.
En la etapa b) , el compuesto 3 se oxida al compuesto 4 por tratamiento con TCCA o IBX.
Cuando el oxidante se representa por TCCA, la reacción se realiza preferentemente en un solvente orgánico escogido de cetonas, ésteres, amidas, solventes clorados o mezclas de estos, a una temperatura comprendida entre aproximadamente 0°C y aproximadamente 70°C, usando de 0.5 a 10, preferentemente 1.5, moles de TCCA por un mol de 3. La reacción de oxidación se realiza en presencia de una base, generalmente una amina. La base es preferentemente piridina usada en una cantidad de 1 a 8 moles por un mol del compuesto 3. Preferentemente, la reacción se lleva a cabo en una mezcla de diclorometano/acetona (relación 10/3 v/v) . Puede usarse además acetato de etilo, acetona y NN–dimetilformamida de manera favorable.
Cuando se usa IBX para oxidar 3 a 4, es necesario un ambiente de reacción muy polar debido a la baja solubilidad del reactivo en solventes orgánicos apolares. La reacción de oxidación se realiza preferentemente usando de 3 a 12, preferentemente 8.4, moles de IBX por un mol de 3, en un solvente seleccionado del grupo que consiste de dimetilsulfóxido, amidas entre ellas preferentemente N, N dimetilformamida, ésteres cíclicos entre ellos preferentemente tetrahidrofurano o metiltetrahidrofurano. Las mezclas binarias de estos solventes pueden usarse, también.
La reacción se realiza generalmente... [Seguir leyendo]
Reivindicaciones:
1. El proceso para la preparación de 6β, 7β, 15β, 16β–dimetilen–3–oxo–17α–pregn–4–eno–21, 17–carbolactona (Drospirenona, 5) a partir de un compuesto de la fórmula 2
en donde R es un grupo protector hidroxilo seleccionado del grupo que consiste de un derivado de sililo Q3Si–, en donde cada Q, independientemente uno de otro, representa (C1–C6) alquilo, (C6–C10) arilo, (C1–
C4) alquilarilo o (C1–C4) alcoxiarilo, dicho proceso comprende las siguientes etapas secuenciales: a) c) :
a) eliminación del grupo protector hidroxilo del compuesto de la fórmula 2 para dar 17α– (3– hidroxipropil) –6β, 7β, 15β, 16β–dimetilen–5β–androstano–3β, 5, 17β–triol de la fórmula 3
b) reacción del compuesto de la fórmula 3 con un agente oxidante seleccionado de 1, 3, 5– tricloro–1, 3, 5–triazina–2, 4, 6– (1H, 3H, 5H) –triona (TCCA) en presencia de una base o con 1–hidroxi– 1, 2–benziodoxol–3 (1H) –ona 1–óxido (IBX) para dar el compuesto de la fórmula 4
c) eliminación de agua de las posiciones C4–C5 del compuesto 4, con lo cual se obtiene Drospirenona 5;
o las siguientes etapas secuenciales a') – b') :
a') eliminación del grupo protector hidroxilo del compuesto de la fórmula 2 como se definió anteriormente para dar 17α– (3–hidroxipropil) –6β, 7β, 15β, 16β–dimetilen–5β–androstano–3β, 5β, 17β– triol de la fórmula 3
b') reacción del compuesto de la fórmula 3 con el agente oxidante 1, 3–dicloro–1, 3, 5– triazina–2, 4, 6– (1H, 3H, 5H) –triona (DCCA) , o una sal de metal alcalino de este, en presencia de un ácido con eliminación concomitante de agua de las posiciones C4–C5 para proporcionar Drospirenona 5.
o las siguientes etapas secuenciales a") – d") :
a") reacción de un compuesto de la fórmula 2 con un agente oxidante seleccionado de TCCA o IBX para dar a compuesto de la fórmula 6
en donde R es seleccionado del grupo que consiste de un derivado de sililo Q3Si–, en donde cada Q, independientemente uno de otro, representa (C1–C6) alquilo, (C6–C10) arilo, (C1–C4) alquilarilo o (C1– C4) alcoxiarilo;
b") eliminación del grupo protector hidroxilo del compuesto obtenido en la etapa a") , por lo cual se obtiene el compuesto 7
c") reacción del compuesto 7 con un agente oxidante seleccionado de TCCA o IBX para dar el compuesto de la fórmula 4
d") eliminación de agua de las posiciones C4–C5 del compuesto 4, por lo cual se obtiene la Drospirenona 5.
2. El proceso de la reivindicación 1 en donde el grupo protector hidroxilo es un derivado de sililo seleccionado del grupo de –Si (CH3) 3 o –Si (CH3) 2[C (CH3) 3].
3. El proceso de las reivindicaciones 1 y 2 en donde en la etapa a) o a') el grupo protector hidroxilo es – 30 Si (CH3) 3.
4. El proceso de las reivindicaciones 1 y 2 en donde en la etapa a) o a') , o a") y b") el grupo protector hidroxilo es –Si (CH3) 2[C (CH3) 3].
5. El proceso de acuerdo con las reivindicaciones 1–4 en donde en la etapa b) o en las etapas a") y c") el agente oxidante es TCCA.
6. El proceso de acuerdo con las reivindicaciones 1–4 en donde en la etapa b) en las etapas a") y c") el agente oxidante es IBX.
7. El proceso de acuerdo con las reivindicaciones 1–4, en donde en la etapa b') se usa la sal sódica de DCCA dihidrato.
8. El proceso de acuerdo con la reivindicación 5, en donde la oxidación se realiza a una temperatura entre aproximadamente 0°C y aproximadamente 70°C en un solvente orgánico seleccionado de cetonas, ésteres, amidas, solventes clorados y mezcla de estos, en presencia de un base.
9. El proceso de las reivindicaciones 5 y 8 en donde la oxidación se realiza en una mezcla de diclorometano y acetona y la base es piridina.
10. El proceso de las reivindicaciones 5 y 8 en donde la oxidación se realiza en acetato de etilo y la base es piridina.
11. El proceso de acuerdo con la reivindicación 6, en donde la oxidación se realiza a una temperatura entre aproximadamente 15°C y aproximadamente 70°C en un solvente orgánico seleccionado de dimetilsulfóxido, dimetilformamida, tetrahidrofurano y mezclas de estos.
12. El proceso de acuerdo con la reivindicación 7 en donde la oxidación se realiza en un solvente orgánico seleccionado del grupo que consiste de cetonas, ésteres, amidas, solventes clorados o mezclas de estos en presencia de agua en cantidades entre 10% y 50% v/v del solvente orgánico, a una temperatura entre aproximadamente 0°C y aproximadamente 30°C.
13. El proceso de acuerdo con la reivindicación 1, en donde en las etapas c) o d") la eliminación de agua de las posiciones C4–C5 del compuesto 4 para dar Drospirenona 5 se realiza por tratamiento ácido en un solvente orgánico.
14. El proceso de acuerdo con la reivindicación 13, en donde el tratamiento ácido se realiza con ácido p– toluensulfónico en acetato de etilo.
15. El compuesto 17α–[3–hidroxipropil]–6β, 7β;15β, 16β–dimetilen–5β–androstan–5, 17β–ol–3–ona de la fórmula
7.
Patentes similares o relacionadas:
Método para la separación de los constituyentes isoprénicos de guayule, del 6 de Noviembre de 2019, de versalis S.p.A: Método para la separación de al menos un constituyente isoprénico de la resina de una planta de guayule y/o de tipo guayule que comprende las etapas de: […]
 Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]
Composición farmacéutica que comprende una suspensión acuosa de un derivado de androstano para el tratamiento de afecciones inflamatorias y alérgicas, del 11 de Febrero de 2019, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende:
(i) una suspensión acuosa de un compuesto en partículas de fórmula (I)**Fórmula**
o un solvato de […]
Composiciones que comprenden un lofenol, del 23 de Enero de 2019, de MORINAGA MILK INDUSTRY CO., LTD.: Utilización no terapéutica de un compuesto de lofenol para mejorar o prevenir un síntoma de la piel seleccionado entre el grupo que comprende […]
Procedimiento de producción de 3-oxo-pregn-4-en-21,17-carbolactonas por la oxidación libre de metal de 17-(3-hidroxipropil)-3,17-dihidroxiandrostanos, del 3 de Enero de 2018, de Bayer Intellectual Property GmbH: Un procedimiento de producción de 3-oxo-17α-pregn-4-en-21,17-carbolactonas de fórmula IIIa **(Ver fórmula)** en la que R6a es hidrógeno o, junto con R7a, […]
Formulación farmacéutica que comprende un derivado de androstano y un agente de solubilización en un vehículo líquido acuoso, del 18 de Octubre de 2017, de GLAXO GROUP LIMITED: Una formulación farmacéutica que comprende un vehículo acuoso líquido que se ha disuelto en el mismo (a) un glucocorticoide de fórmula (I) **(Ver fórmula)** […]
Proceso para la preparación de drospirenona, del 13 de Septiembre de 2017, de INDUSTRIALE CHIMICA S.R.L.: Procedimiento para la preparación de drospirenona (I), que comprende la reacción de transformación de 17α-(3- hidroxipropil)-6ß,7ß;15ß,16ß-dimetilen-5ß-androstan-3ß,5,17ß-triol […]
Agente para mejorar la resistencia a la insulina, del 1 de Marzo de 2017, de MORINAGA MILK INDUSTRY CO., LTD.: Un agente para uso en el tratamiento de una enfermedad seleccionada de tolerancia anormal a la glucosa e hiperinsulinemia, que comprende un compuesto seleccionado de 9,19-ciclolanostan-3-ol […]
Proceso para la preparación de drospirenona, del 17 de Agosto de 2016, de INDUSTRIALE CHIMICA S.R.L.: 6ß,7ß;15ß,16ß-dimetilen-3ß,5ß-dihidroxi-17α-pregn-21,17-211α-carbolactol.