REDUCCION ESTEREOESPECIFICA DE SAPOGEN-3-ONAS.
Método para preparar de manera estereoespecífica una 3ß-hidroxi-5ß-H-sapogenina esteroidea o un derivado de la misma,
que comprende reducir una 3-ceto-5ß-H-sapogenina esteroidea usando un agente reductor que comprende un organoborano seleccionado de un trialquil o triarilborohidruro de metal alcalino, y en el que la 3ß-hidroxi-5ß-H-sapogenina esteroidea o un derivado de la misma es un compuesto de fórmula general:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2003/001780.
Solicitante: PHYTOPHARM PLC.
Nacionalidad solicitante: Reino Unido.
Dirección: CORPUS CHRISTI HOUSE 9 WEST STREET,GODMANCHESTER, CAMBRIDGESHIRE.
Inventor/es: GUNNING,PHILIP,JAMES C/O PHYTOPHARM PLC, TIFFIN,PETER,DAVID C/O PHYTOPHARM PLC.
Fecha de Publicación: .
Fecha Concesión Europea: 3 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07J71/00B
Clasificación PCT:
- C07J71/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno condensada con un heterociclo (heterocíclicos condensados en espiro C07J 21/00, C07J 33/00, C07J 43/00).
Clasificación antigua:
- C07J71/00 C07J […] › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno condensada con un heterociclo (heterocíclicos condensados en espiro C07J 21/00, C07J 33/00, C07J 43/00).
Fragmento de la descripción:
Reducción estereoespecífica de sapogen-3-onas.
Campo de la invención
La presente invención se refiere a la síntesis estereoespecífica de 3-hidroxi-5ß-H-sapogeninas esteroideas y sus derivados.
Antecedentes de la invención
Se ha mostrado que ciertas sapogeninas y sus derivados (más particularmente, sapogeninas que presentan un átomo de hidrógeno 5ß, y más particularmente compuestos que presentan un grupo 3-hidroxilo y un átomo de hidrógeno 5ß, tales como sarsasapogenina, episarsasapogenina, esmilagenina y epismilagenina) tienen utilidad en el tratamiento del deterioro cognitivo y otros estados. Tal actividad se describe, por ejemplo, en los documentos WO-99/48482, WO-99/48507, WO-01/49703, WO-02/079221 y WO-01/23406, las descripciones de los cuales se incorporan al presente documento como referencia. El esquema para nombrar el sistema de anillo y las posiciones de los carbonos usado en el presente documento es tal como se proporciona en estas publicaciones anteriores.
La bibliografía describe métodos para la síntesis de 3-hidroxi-esteroides y 3-hidroxi-sapogeninas esteroideas. Por ejemplo, se ha efectuado la síntesis de 3ß-hidroxi-5a-H-esteroides a partir de los 3-ceto-5a-H-esteroides correspondientes con borohidruro de sodio en tetrahidrofurano y metanol o mediante el uso de hidruro de aluminio y litio en dietil éter (Helv. Chim. Acta, 66, 192-217 (1983)).
La patente estadounidense n.º 3.875.195 (1975), cuya descripción se incorpora al presente documento como referencia, describe la reducción catalítica de 3-ceto-5ß-H-esteroides para dar 3ß-hidroxi-5ß-H-esteroides en un ácido carboxílico inferior con níquel Raney e hidrógeno a presión. Estos investigadores observan que la reducción de Meerwein-Ponndorf-Verley (MPV) conduce a mezclas de 3a- y 3ß-hidroxi-esteroides en partes iguales. Está descrito que la separación de tales mezclas es difícil.
Desde la introducción de la familia de agentes reductores de trialquilborohidruro altamente impedidos, comúnmente conocidos como Selectrides®, que comenzó a principios de la década de 1970 (Brown et al., J. Am. Chem. Soc. 94, 7159-7161 (1972)), han aparecido varias publicaciones en las que se han aplicado estos agentes reductores a ciertos métodos sintéticos de esterol. Por ejemplo, en Steroids, 36, 299-303 (1980), Steroids, 45, 39-51 (1985), J. Chem. Soc. Commun. 1239-1240 (1982), Tetrahedron, 40, 851-854 (1984), Helv. Chim. Acta, 66, 192-217 (1983), patente estadounidense n.º 6.150.336 (2000) y Tetrahedron, 45, 3717-3730 (1989), cuyas descripciones se incorporan al presente documento como referencia, se describen las reducciones estereoespecíficas de selectride de ciertos 3-ceto-5ß y 3-ceto-5a-esteroides para dar sus 3ß-OH, 5ß-H y 3a-OH, 5a-H-esteroles respectivos.
En relación con las sapogeninas esteroideas, la técnica describe la síntesis de esmilagenina mediante la reducción de esmilagenona con isopropóxido de aluminio en alcohol isopropílico, la reducción de MPV (Marker et al., J. Amer. Chem. Soc., 62, 2525 (1940)). Marker ha descrito la reducción de MPV de sarsasapogenona para dar una mezcla de sarsasapogenina y episarsasapogenina (Marker y Rohrmann, J. Amer. Chem. Soc., 61, 943 (1939)). Las descripciones de estas publicaciones se incorporan al presente documento como referencia.
La técnica también ha descrito ciertas hidrogenaciones catalíticas, tal como se muestra a modo de ejemplo mediante la preparación de Blunden de epitigogenina a partir de tigogenona usando la hidrogenación sobre un catalizador de Adams (óxido de platino (IV)) en ácido acético glacial que contiene ácido clorhídrico al 2% (J. Nat. Prod. 42, 478-482 (1979); Onderstepoort J. Vet. Res., 61, 351-359 (1994)). Marker ha descrito la hidrogenación de sarsasapogenona usando el catalizador de Adams en etanol para dar episarsasapogenina (Marker y Rohrmann, J. Amer. Chem. Soc., 61, 943 (1939)). La técnica también ha descrito la reducción con borohidruro de sodio, tal como se muestra a modo de ejemplo mediante la preparación de Miles de episarsasapogenina a partir de sarsasapogenona usando borohidruro de sodio (J. Agric. Food Chem., 41, 914-917 (1993)). La técnica también ha descrito la reducción con hidruro de litio y aluminio, tal como se muestra a modo de ejemplo mediante la preparación de Djerassi de epismilagenina a partir de esmilagenona (J. Am. Chem. Soc., 74, 422-424, (1952)) y la preparación de Lajis de episarsasapogenina a partir de sarsasapogenona (Steroids, 58, 387-389 (1993)). Las descripciones de estas publicaciones se incorporan al presente documento como referencia.
En las patentes estadounidenses n.ºs 5.703.052 (1997), 5.807.834 (1998) y 5.939.398 (1999), cuyas descripciones se incorporan al presente documento como referencia, describen métodos para la síntesis de 3a-hidroxi-5a-H-sapogeninas usando K-Selectride® a bajas temperaturas.
El documento WO-02/079221 (publicado el 10 de octubre de 2002), describe en el ejemplo 6, una síntesis de episarsasapogenina mediante la reducción de sarsasapogenona usando tri-terc-butoxialuminohidruro de litio. Sin embargo, esta publicación no es técnica anterior en todos los países.
La presente invención busca proporcionar una síntesis estereoespecífica mejorada de 3ß-hidroxi,5ß-H sapogeninas definidas y descritas en dichas publicaciones WO-99/48482, WO-99/48507, WO-01/49703, WO-02/079221 y WO-01/23406, así como sus derivados tales como, por ejemplo, las saponinas correspondientes y otras formas fisiológicamente aceptables que son sales y ésteres, que pueden servir como profármacos.
En una realización más preferida, la presente invención busca proporcionar una síntesis estereoespecífica eficiente de sarsasapogenina y esmilagenina.
Breve descripción de la invención
La presente invención proporciona en un primer aspecto un método para preparar de manera estereoespecífica una 3ß-hidroxi-5ß-H-sapogenina esteroidea o un derivado de la misma, que comprende reducir una 3-ceto-5ß-H-sapogenina esteroidea usando un agente reductor que comprende un organoborano impedido o un hidruro de organoaluminio.
La 3ß-hidroxi-5ß-H-sapogenina esteroidea formada inicialmente mediante dicha reducción estereoespecífica, puede convertirse luego en una forma derivada deseada, por ejemplo, usando técnicas de derivatización bien conocidas en la técnica. Dicha conversión puede tener lugar in situ o en un sistema de reacción diferente, y puede ser simultánea con la reducción o posterior a la misma.
La expresión "organoborano impedido" tal como se usa en el presente documento se refiere a agentes reductores de trialquil o triarilborohidruro de metal alcalino, tales como, por ejemplo, tri-sec-butilborohidruro de litio, trisiamilborohidruro de litio o trifenilborohidruro de litio, o a los agentes reductores correspondientes con litio sustituido por potasio o sodio. Preferiblemente, los grupos alquilo contienen desde 3 hasta 7 átomos de carbono. Preferiblemente, los grupos arilo contienen desde 6 hasta 12 átomos de carbono y pueden estar sustituidos con alquilo. Tales agentes reductores se denominan algunas veces colectivamente agentes reductores "Selectride", aunque debe entenderse que tal como se usa en el presente documento el término "Selectride" no pretende limitar la invención a un agente reductor obtenido de cualquier fabricante o fuente particular, y pueden usarse tales agentes reductores de cualquier fabricante o fuente. Para una discusión más detallada, véase "Reductions by the Alumino- and Borohydrides in Organic Synthesis", por J. Seyden-Penne (VCH Publishers, Inc). Los organoboranos impedidos preferidos para su uso en la presente invención son tri-sec-butilborohidruro de litio (L-Selectride), tri-sec-butilborohidruro de potasio (K-Selectride), tri-sec-butilborohidruro de sodio (N-Selectride), trisiamilborohidruro de litio (LS-Selectride), trisiamilborohidruro de potasio (KS-Selectride), trifenilborohidruro de potasio y trifenilborohidruro de litio.
Mediante la selección apropiada del agente reductor, el método permite que se prepare una gama de 3ß-hidroxi,5ß-H-sapogeninas sustancial o al menos predominantemente en forma estereoisoméricamente pura con un rendimiento global bueno o excelente (por ejemplo, por encima de aproximadamente el 80% de conversión) a partir de un material de partida disponible comercialmente o preparado fácilmente, evitando generalmente la difícil separación de las mezclas de...
Reivindicaciones:
1. Método para preparar de manera estereoespecífica una 3ß-hidroxi-5ß-H-sapogenina esteroidea o un derivado de la misma, que comprende reducir una 3-ceto-5ß-H-sapogenina esteroidea usando un agente reductor que comprende un organoborano seleccionado de un trialquil o triarilborohidruro de metal alcalino, y en el que la 3ß-hidroxi-5ß-H-sapogenina esteroidea o un derivado de la misma es un compuesto de fórmula general:
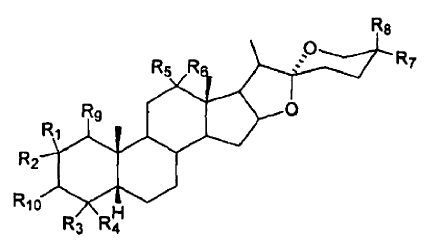
en la que R1, R2, R3, R4, R5, R6, R7, R8 y R9 son, independientemente entre sí, H, alquilo C1-4, OH u OR, en el que R = arilo C6-12 o alquilo C1-4, o R5 y R6 pueden representar juntos un grupo =O (carbonilo) o carbonilo protegido,
R10 representa ß-OH, un grupo de azúcar con enlace ß-O o cualquier grupo éster orgánico ß,
en el que el agente reductor es el reactivo de organoborano en el que los grupos orgánicos contienen más de dos átomos de carbono y la sapogenina obtenida es predominantemente una 3ß-hidroxi,5ß-H-sapogenina.
2. Método según la reivindicación 1, en el que el organoborano se selecciona de tri-sec-butilborohidruro de litio, tri-sec-butilborohidruro de potasio, tri-sec-butilborohidruro de sodio, trisiamilborohidruro de litio, trisiamilborohidruro de potasio, trifenilborohidruro de potasio y trifenilborohidruro de litio.
3. Método según la reivindicación 2, en el que el organoborano es tri-sec-butilborohidruro de litio.
4. Método según una cualquiera de las reivindicaciones anteriores, en el que la razón molar de la sapogenina predominante obtenida con respecto al 3-epímero alternativo, es de al menos aproximadamente 10:1.
5. Método según la reivindicación 4, en el que la razón es de al menos aproximadamente 15:1.
6. Método según una cualquiera de las reivindicaciones anteriores, cuando se realiza en un disolvente orgánico seleccionado de tetrahidrofurano, tolueno, terc-butil metil éter, dietoximetano, 1,4-dioxano, 2-metiltetrahidrofurano y cualquier mezcla de los mismos.
7. Método según la reivindicación 6, en el que el disolvente orgánico consiste esencialmente en tetrahidrofurano.
8. Método según la reivindicación 6, en el que el disolvente orgánico consiste esencialmente en tolueno.
9. Método según la reivindicación 6, en el que el disolvente orgánico consiste esencialmente en 1,4-dioxano.
10. Método según la reivindicación 6, en el que el disolvente orgánico consiste esencialmente en 2-metiltetrahidrofurano.
11. Método según la reivindicación 1, en el que la sapogenina se selecciona de sarsasapogenina, esmilagenina y ésteres de las mismas.
12. Método según una cualquiera de las reivindicaciones anteriores, en el que el material de partida 3-ceto,5ß-H-sapogenina esteroidea se prepara mediante la hidrogenación catalítica heterogénea de una ?4,3-ceto-sapogenina esteroidea correspondiente para convertir la ?4,3-ceto-sapogenina esteroidea al menos predominantemente en dicha 5ß-H,3-cetona.
13. Método según la reivindicación 12, en el que la hidrogenación catalítica heterogénea se realiza usando hidrógeno y un catalizador de paladio en un disolvente orgánico.
14. Método según la reivindicación 13, en el que el catalizador de paladio está presente en un soporte.
15. Método según una cualquiera de las reivindicaciones 12 a 14, en el que la ?4,3-ceto-sapogenina esteroidea es diosgenona.
16. Método según la reivindicación 15, en el que la diosgenona se obtiene mediante la oxidación de diosgenina.
17. Método para la síntesis de esmilagenina según la reivindicación 1, que comprende la hidrogenación catalítica de diosgenona seguida por la reducción de la 3-ceto,5ß-H-sapogenina esteroidea resultante usando un organoborano seleccionado de un trialquil o triarilborohidruro de metal alcalino.
18. Método según una cualquiera de las reivindicaciones anteriores, en el que una sapogenina formada inicialmente se convierte posteriormente en un éster o una sal de la misma.
Patentes similares o relacionadas:
Forma polimórfica de propionato de fluticasona, del 15 de Julio de 2020, de Nicox Ophthalmics, Inc: Nanocristales de propionato de fluticasona que tienen un patrón de difracción de rayos X en polvo que incluye picos a aproximadamente 7,8, 15,7, 20,8, 23,7, 24,5 y 32,5 […]
Composición farmacéutica de liberación sostenida para el tratamiento y prevención de enfermedades oculares, del 18 de Diciembre de 2019, de DAIICHI SANKYO COMPANY, LIMITED: Un derivado terpenoide representado por la siguiente fórmula (I): **(Ver fórmula)**
Método para la separación de los constituyentes isoprénicos de guayule, del 6 de Noviembre de 2019, de versalis S.p.A: Método para la separación de al menos un constituyente isoprénico de la resina de una planta de guayule y/o de tipo guayule que comprende las etapas de: […]
Witanólidos útiles para el tratamiento de enfermedades neurodegenerativas, del 29 de Octubre de 2019, de Imstar Therapeutics Inc: Un compuesto de fórmula (I'):**Fórmula** en donde: R1 es hidrógeno o alquilo; R2 es hidrógeno, alquilo, alquenilo, haloalquilo, -ORb o -OC(O)Rb; […]
Compuestos anfifílicos con propiedades neuroprotectoras, del 2 de Octubre de 2019, de Ustav Organicke Chemie a Biochemie AV CR, v.v.i: Compuesto anfifílico, seleccionado de: 3-sulfato de piridinio(3R,5R,8S,9S,10 S,13S,14S)-10,13-dimetilhexadecahidro-1H-ciclopenta[a]fenantren-3- […]
Esteroides 6-alquil-7-hidroxi-4-en-3-ona como intermediarios para la producción de moduladores de FXR esteroideo, del 18 de Septiembre de 2019, de NZP UK Limited: Un compuesto de fórmula general (I):**Fórmula** en donde: R1 es alquilo C1-4 opcionalmente sustituido con uno o más sustituyentes seleccionados […]
Glucocorticoides altamente potentes, del 21 de Agosto de 2019, de VAN ANDEL RESEARCH INSTITUTE: Un compuesto:**Fórmula** o una sal farmacéuticamente aceptable del mismo.
Esteroides 6.alfa.-alquil-3,7-diona como intermedios para la producción de moduladores FXR de esteroides, del 24 de Julio de 2019, de NZP UK Limited: Un compuesto de fórmula general (I):**Fórmula** en donde: R1 es alquilo C1-4 opcionalmente sustituido con uno o más sustituyentes seleccionados de halo, […]