Composiciones farmacéuticas de aripiprazol.
Una composición farmacéutica dispensable oralmente para la liberación controlada de aripiprazol caracterizadaporque la composición comprende una cantidad terapéuticamente eficaz de aripiprazol y al menos unexcipiente farmacéuticamente aceptable que comprende un material retardante de liberación en la forma de unamatriz o un revestimiento,
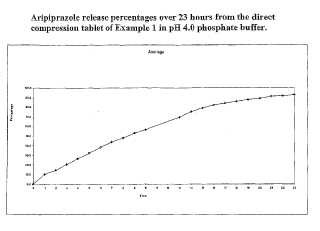
la composición exhibiendo un perfil de liberación in vitro en el que no más del 60%del aripiprazol se disuelve dentro de 3 horas de la colocación en un ensayo de disolución estándar.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2007/003677.
Solicitante: ZYSIS LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: 10 GLEBE STREET BEESTON NOTTINGHAM NG9 1BZ REINO UNIDO.
Inventor/es: WILDING,IAN, PENDLETON,RUSSELL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/496 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piperazinas no condensadas conteniendo otros heterociclos, p. ej. rifampicina, tiotixeno.
- A61K9/22 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › del tipo de liberación prolongada o discontinua.
PDF original: ES-2395119_T3.pdf
Fragmento de la descripción:
Composiciones farmaceuticas de aripiprazol.
0001 La invención se refiere a formulaciones farmacéuticas que contienen aripiprazol. Más particularmente, la invención se refiere a composiciones farmacéuticas dispensables oralmente para la liberación controlada de aripiprazol.
0002 Aripiprazol es 7-[4-[4- (2, 3-diclorofenil) piperazin-1-il] butoxi]-3, 4-dihidro-1H-quinolin-2-ona y tiene la siguiente estructura:
0003 Aripiprazol parece mediar sus efectos antipsicóticos principalmente a través de agonismo parcial en el receptor D2. El agonismo parcial en los receptores D2 ha demostrado que modula la actividad dopaminérgica en áreas donde la actividad de dopamina puede ser alta o baja, tales como las áreas mesolímbica y mesocortical del cerebro esquizofrénico, respectivamente. En adición a la actividad agonista parcial en el receptor D2, aripiprazol es también un agonista parcial en el receptor 5-HT1A, y como los otros antipsicóticos atípicos, el aripiprazol presenta un perfil antagonista en el receptor 5-HT2A. Aripiprazol tiene afinidad moderada por los receptores de histamina y alfa adrenérgicos, y afinidad no apreciable por los receptores muscarínicos colinérgicos. Aripiprazol es actualmente usado para el tratamiento de la esquizofrenia y episodios maníacos/mixtos agudos asociados con Trastorno Bipolar I.
0004 La actividad clínica se considera principalmente debida al fármaco madre, aripiprazol, y en menor grado, a su principal metabolito, dehidro-aripiprazol, que se ha demostrado que tiene afinidades para los receptores D2 similares a las del fármaco madre y representa el 40% de la exposición del fármaco madre en el plasma (ver información de prescripción de ABILY® (aripiprazol) , Otsuka Pharmaceutical Co., Ltd., Tokio, 101-8535, junio de 2006) . La media de las semividas de eliminación es aproximadamente 75 horas y 94 horas para el aripiprazol y dehidro-aripiprazol, respectivamente. Las concentraciones en equilibrio se alcanzan en los 14 días siguientes a la dosis inicial para ambas fracciones activas. La acumulación de aripiprazol es predecible a partir de una sola dosis farmacocinética. En estado de equilibrio, la farmacocinética de aripiprazol es proporcional a la dosis. La eliminación de aripiprazol es principalmente a través del metabolismo hepático que involucra a dos isoenzimas del citocromo P450, CYP2D6 y CYP3A4 (Kubo M et al Influencia de co-administración de itraconazol y genotipo CYP2D6 sobre la farmacocinética del nuevo antipsicótico ARIPIPRAZOL. Drug Metab Pharmacokinet. 2005 Feb; 20 (1) :55-64) .
0005 Aripiprazol se absorbe bien después de la administración del comprimido de liberación inmediata (LI) , con concentraciones plasmáticas pico que ocurren dentro de las 3 a 5 horas después de la administración; la biodisponibilidad oral absoluta de la formulación de comprimidos de LI es 87%. La administración de un comprimido de aripiprazol de 15 mg de LI con una comida rica en grasas no afecta significativamente el Cmax o el AUC del aripiprazol o su metabolito activo, dehidro-aripiprazol, pero retrasa el Tmax durante 3 horas para el aripiprazol y 12 horas para dehidro-aripiprazcle. Aripiprazol también se absorbe bien cuando se administra por vía oral en solución. A dosis equivalentes, las concentraciones plasmáticas de aripiprazol de la solución fueron mayores que la de una formulación de comprimidos de LI.
0006 En un estudio de biodisponibilidad relativa comparando la farmacocinética de aripiprazol 30 mg como una solución oral a comprimidos de aripiprazol 30 mg de LI en sujetos sanos, las proporciones de solución a comprimido de la media geométrica de los valores de Cmax y AUC fueron 122% y 114%, respectivamente. El volumen de distribución en estado de equilibrio de aripiprazol tras administración intravenosa es alto (404 L o 4, 9 L / kg) , lo que indica una extensa distribución extravascular. En concentraciones terapéuticas, el aripiprazol y su metabolito principal se unen en más de 99% a proteínas séricas, principalmente a albúmina. En voluntarios humanos sanos a los que se administró de 0.5 a 30
mg/día de aripiprazol durante 14 días, hubo ocupación dosis-dependiente del receptor D2 que indica penetración cerebral de aripiprazol en humanos (Swainston Harrison T y Perr y CM. Aripiprazol: Una revisión de su uso en esquizofrenia y trastorno esquizoafectivo. Drogas. 2004;64 (15) :1715-36) .
0007 Aripiprazol se metaboliza principalmente por tres vías de biotransformación: deshidrogenación, hidroxilación y Ndesalquilación. Basado en estudios in vitro, las enzimas CYP3A4 y CYP2D6 son responsables de la deshidrogenación y la hidroxilación de aripiprazol y la N-desalquilación es catalizada por la enzima CYP3A4. Aripiprazola es la fracción predominante de fármaco en la circulación sistémica. En estado de equilibrio, dehidro-aripiprazol, el metabolito activo, representa alrededor del 40% del AUC de aripiprazol en el plasma.
0008 Aproximadamente el 8% de caucásicos carecen de la capacidad para metabolizar sustratos CYP2D6 y se clasifican como metabolizadores lentos (PM) , mientras que el resto son metabolizadores rápidos (EM) . PMs tienen cerca de un 80% de aumento en la exposición de aripiprazol y cerca de un 30% de disminución en la exposición al metabolito activo en comparación con los EMs, resultando en aproximadamente 60% mayor exposición a las fracciones totales activas de una dosis dada de aripiprazol en comparación con EMs. La media de las semividas de eliminación es aproximadamente 75 horas y 146 horas para el aripiprazol en EMs y PMs, respectivamente. El aripiprazol no inhibe o induce la vía CYP2D6.
0009 Luego de una dosis oral única de aripiprazol etiquetado [14C], aproximadamente el 25% y el 55% de la radiactividad administrada se recuperó en la orina y las heces, respectivamente. Menos del 1% de aripiprazol inalterado se excretó en la orina y aproximadamente el 18% de la dosis oral se recuperó inalterada en las heces. WO 2005/048979 describe composiciones de liberación extendida o controlada de al menos un ingrediente activo, de los que el aripiprazol es uno de los cientos que se enumeran en dicho documento. Ninguna de las composiciones de ejemplo en el documento WO 2005/048979 contiene aripiprazol.
0010 La dosis de inicio y objetivo recomendada de aripiprazol en la esquizofrenia es de 10 o 15 mg/día administrados una vez al día independientemente de las comidas. Si se requiere un aumento de la dosis, se recomienda que esto no deba hacerse antes de 2 semanas, el tiempo necesario para alcanzar el estado de equilibrio. En la enfermedad bipolar, la dosis inicial es de 30 mg una vez al día. Sin embargo, en algunos ensayos clínicos de fase III, aproximadamente el 15% de los pacientes había disminuido la dosis a 15 mg en base a evaluación de la tolerancia (Medicamentos de la FDA; Abilify (CND # 021436 Comprimido oral) ) . El listado o la discusión de un documento anterior publicado en esta especificación no necesariamente debe ser tomado como un reconocimiento de que ese documento es parte del estado de la técnica o es conocimiento general común.
0011 Hay una serie de desventajas asociadas con el régimen de dosificación para aripiprazol descrito anteriormente para el tratamiento de la esquizofrenia, enfermedad bipolar y condiciones del SNC. La investigación de mercado sugiere que los pacientes prefieren mucho más los medicamentos orales que se pueden tomar lo menos posible y que son bien tolerados. El régimen de dosis de administración oral de una vez al día puede ser considerado demasiado frecuente para muchos pacientes. En adición, un subconjunto significativo de la población diana para aripiprazol es probable que sea de pacientes que son mayores y olvidadizos. Estos pacientes a menudo requieren una administración trabajosa y supervisada costosa.
0012 La presente invención trata de abordar una o más de las deficiencias antes mencionadas mediante la provisión de una composición farmacéutica dispensable oralmente para la liberación controlada de aripiprazol como se define en la reivindicación 1. La composición comprende una cantidad terapéuticamente efectiva de aripiprazol, y al menos un excipiente farmacéuticamente aceptable tal como se define en la reivindicación 1. Estas composiciones (en adelante denominadas "las composiciones de la invención" a menos que se indique lo contrario) pueden ser utilizadas para el tratamiento de la esquizofrenia, enfermedad bipolar y una serie de otras indicaciones médicas, como se describe más adelante en esta especificación.
0013 Las composiciones de la invención se cree que tienen ventajas tales como (pero no limitadas a) una o más de las siguientes ventajas.
0014 Normalmente, las composiciones de la invención controlan... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica dispensable oralmente para la liberación controlada de aripiprazol caracterizada porque la composición comprende una cantidad terapéuticamente eficaz de aripiprazol y al menos un excipiente farmacéuticamente aceptable que comprende un material retardante de liberación en la forma de una matriz o un revestimiento, la composición exhibiendo un perfil de liberación in vitro en el que no más del 60% del aripiprazol se disuelve dentro de 3 horas de la colocación en un ensayo de disolución estándar.
2. La composición de la reivindicación 1 en la que se disuelve 2 a 50% o 10 a 50% o 2 a 40% del aripiprazol dentro de 3 horas de la colocación en el ensayo de disolución estándar.
3. La composición de la reivindicación 1 que exhibe una velocidad de liberación in vitro después de la colocación en un ensayo de disolución estándar en el que: de 2 a 50% del aripiprazol se libera después de 2 horas; de 5 a 80% del aripiprazol se libera después de 4 horas; 25% o más del aripiprazol se libera después de 8 horas, y 40% o más del aripiprazol se libera después de 12 horas, o en donde: de 5 a 40% del aripiprazol se libera después de 2 horas; de 15 a 70% del aripiprazol se libera después de 4 horas, y 50% o más del aripiprazol se libera después de 8 horas, o en donde: de 2 a 35% del aripiprazol se libera después de 2 horas; de 5 a 50% del aripiprazol se libera después de 4 horas;
de 25 a 80% del aripiprazol se libera después de 8 horas, y 40% o más del aripiprazol se libera después de 12 horas.
4. La composición de la reivindicación 1 que exhibe un perfil de absorción plasmático de aripiprazol in vivo tras administración oral de dosis única en el que el tiempo para que el 50% del aripiprazol sea absorbido en el plasma es al menos 2 horas, o de 2 a 24 horas, o de 2 a 12 horas, o de 6 a 24 horas.
5. La composición de la reivindicación 1, que exhibe un perfil de liberación in vivo donde: de 2 a 50% del aripiprazol se libera dentro de las 2 horas después de la administración; de 5 a 80% del aripiprazol se libera dentro de las 4 horas después de la administración; 25% o más del aripiprazol se libera dentro de las 8 horas después de la administración, y 40% o más del aripiprazol se libera dentro de las 12 horas después de la administración, o en donde:
de 5 a 40% del aripiprazol se libera dentro de las 2 horas después de la administración; de 15 a 70% del aripiprazol se libera dentro de las 4 horas después de la administración, y 50% o más del aripiprazol se libera dentro de las 8 horas después de la administración,
o donde: de 2 a 35% del aripiprazol se libera dentro de las 2 horas después de la administración; de 5 a 50% del aripiprazol se libera dentro de las 4 horas después de la administración; de 25 a 80% del aripiprazol se libera dentro de las 8 horas después de la administración: y 40% o más del aripiprazol se libera dentro de las 12 horas después de la administración.
6. La composición de la reivindicación 1 que exhibe un valor Cmáx de aripiprazol tras la administración oral que es de 20 a 80% dea logrado usando una forma de dosificación de liberación inmediata (LI) convencional de aripiprazol cuando se administra por vía oral en una dosis idéntica.
7. La composición de la reivindicación 1 que proporciona una relación de la concentración plasmática pico (Cmax) de aripiprazol a la concentración plasmática de aripiprazol 24 horas después de la administración (C24) tras la administración oral de menos de 3:1, o menos que 1, 5:1.
8. La composición de cualquiera de las reivindicaciones precedentes, en forma de una cápsula, comprimido, líquido, polvo, gránulo, suspensión, matriz, microesfera, semilla, pellet, perla o una combinación de los mismos, preferiblemente en forma de una matriz.
9. Una composición de cualquiera de las reivindicaciones precedentes en la que la matriz es hinchable, preferiblemente hinchable en agua.
10. La composición de cualquiera de las reivindicaciones precedentes, en donde el material retardante de liberación está en forma de una matriz y comprende un polímero hinchable en agua que comprende un polímero de celulosa o derivado del mismo; preferiblemente en el que el polímero de celulosa o derivado del mismo comprende un polímero celulósico alquil-sustituido, preferentemente en donde el polímero celulósico alquilsustituido se selecciona de metilcelulosa, hidroximetil-celulosa, hidroxietilcelulosa, hidroxipropilcelulosa, hidroxipropilmetilcelulosa, carboximetilcelulosa y, preferiblemente donde el polímero celulósico alquil-sustituido es hidroxipropilmetilcelulosa.
11. La composición de cualquiera de las reivindicaciones precedentes en donde el excipiente comprende además una carga, preferentemente en el que la carga comprende una carga insoluble en agua, preferiblemente en el que la carga insoluble en agua se selecciona de dióxido de silicio, dióxido de titanio, talco, alúmina, almidón, caolín, potasio polacrilina, celulosa en polvo, celulosa microcristalina, y combinaciones de los mismos, preferiblemente en el que la carga insoluble en agua comprende celulosa microcristalina.
12. La composición de cualquiera de las reivindicaciones precedentes en donde el excipiente comprende además un lubricante, preferiblemente en el que el lubricante se selecciona de estearato de calcio, behenato de glicerol, estearato de magnesio, aceite mineral, polietilenglicol, estearilfumarato sódico, ácido esteárico, talco, aceite vegetal, estearato de zinc, y combinaciones de los mismos, preferiblemente en el que el lubricante comprende estearilfumarato sódico.
13. La composición de acuerdo con cualquiera de las reivindicaciones de 1 a 8 en la que el material retardante de liberación comprende un polímero formador de película como material de revestimiento, en donde el polímero formador de película se selecciona de metil celulosa, etil celulosa, hidroxipropil celulosa, hidroxipropil metil celulosa, hidroxibutilo metil celulosa, acetato de celulosa, propionato de celulosa, propionato acetato de celulosa, acetato butirato de celulosa, acetato ftalato de celulosa, carboximetil celulosa, triacetato de celulosa, sal de sodio sulfato de celulosa, poli (metacrilato de metilo) , poli (metacrilato de etilo) , poli (metacrilato de butilo) , poli (metacrilato de isobutilo) , poli (metacrilato de hexilo) , poli (metacrilato de fenilo) , poli (acrilato de metilo) , poli (acrilato de isopropilo) , poli (acrilato de isobutilo) , poli (acrilato de octadecilo) , polietileno de alta o baja densidad, polipropileno, poli (etilenglicol) , poli (óxido de etileno) , poli (tereftalato de etileno) , poli (alcohol vinílico) , poli (vinil isobutil éter) , poli (acetato de vinilo) , poli (cloruro de vinilo) , polivinilpirrolidona, y combinaciones de los mismos.
14. La composición de cualquiera de las reivindicaciones precedentes que comprende al menos un agente farmacéuticamente activo, en adicion al aripiprazol, opcionalmente en el que el al menos un agente adicional farmacéuticamente activo se selecciona entre agentes antipsicóticos atípicos (ej., olanzapina, quetiapina, risperidona, amisulprida, clozepina, clorpromazina , o decanoato de haloperidol) , agentes antiparkinsonianos (ej., la L-DOPA, agonistas de dopamina, anticolinérgicos) , sedantes (ej., un sedante de benzodiazepina o sedante no barbitúrico) , ansiolíticos (ej., benzodiazepinas como el lorazepam, clordiazepóxido, oxazepam, dorazepate, diazepam, y el alprazolam) , antidepresivos (ej., los antidepresivos tricídicos como la amitriptilina, imipramina, doxepina, y domipramina) , inhibidores de la monoaminooxidasa A o B (como fenelzina y tranilcipromina) , tetracíclicos antidepresivos (ej., maprotilina) , inhibidores de la recaptación de serotonina (como la fluoxetina, Cipramil, S-Cipramil, paroxetina, clorhidrato de sertralina, serotonina) , e inhibidores de la recaptación de noradrenalina (como la venlafaxina y duloxetina) , o inhibidores de la recaptación de adrenalina (como la reboxetina y viloxazina) , y estabilizadores del ánimo (ej, lamotrigina, litio, valproato, carbamazepina, oxcarbazapine) .
15. Uso de una composición como se define en cualquiera de las reivindicaciones de 1 a 14 en la fabricación de un medicamento para la prevención y/o tratamiento de una afección neurológica y/o psiquiátrica, en donde la prevención y/o tratamiento comprende administración que es menos frecuente que una vez al día (OD) .
16. Una composición como se define en cualquiera de las reivindicaciones de 1 a 14 para su uso en la prevención y/o tratamiento de una afección neurológica y/o psiquiátrica en la que la presentación y/o la prevención comprende administración que es menos frecuente que una vez al día (OD) .
17. El uso de la reivindicación 15 o la composición para uso de la reivindicación 16 en donde el tratamiento se asocia con las propiedades agonistas parciales del aripiprazol sobre las vías de neurotransmisores en el cerebro.
18. El uso de la reivindicación 15 o 17 o la composición para uso de la reivindicación 16 o 17 en donde una afección neurológica y/o psiquiátrica se asocia con los receptores de Dopamina.
19. El uso de la reivindicación 15, 17 ó 18 o la composición para uso de cualquiera de las reivindicaciones 16 a 18 en donde se selecciona la afección neurológica y/o psiquiátrica de trastornos bipolares, trastornos esquizoafectivos, trastorno de la personalidad y el trastorno dudoso de la personalidad, el deterioro cognitivo (ej., leve deterioro cognitivo de los ancianos) , complicaciones psiquiátricas de accidente cerebrovascular (incluido el hemorrágico e isquémico y secuelas) , epilepsia, ataques isquémicos transitorios, lesión cerebral traumática, enfermedad de Huntington, esclerosis lateral amiotrófica, psicosis (como la esquizofrenia) , adicciones, (ej., adicción al alcohol, la nicotina y los opiáceos) , trastornos de la alimentación incluyendo bulimia y anorexia, ADHD (trastorno de hiperactividad con déficit de atención) , trastornos depresivos y de combinaciones de los mismos.
20. El uso de una composición como se define en cualquiera de las reivindicaciones de 1 a 14 en la fabricación de un medicamento para prevenir y/o tratar una afección neurodegenerativa, en donde la prevención y/o tratamiento comprende administración, que es menos frecuente que una vez al día (OD) .
21. Una composición como se define en cualquiera de las reivindicaciones 1 a 14 para uso en la prevención y/o el tratamiento de una afección neurodegenerativa, en donde la prevención o el tratamiento comprende administración que es menos frecuente que una vez al día (OD) .
22. Uso de una composición como se define en cualquiera de las reivindicaciones de 1 a 14 en la fabricación de un medicamento para administración oral para proporcionar la liberación controlada de aripiprazol a un paciente en necesidad del mismo, en el que la administración oral es menos frecuente que una vez al día (OD) .
23. Una composición como se define en cualquiera de las reivindicaciones de 1 a 14 para uso en el suministro de la liberación controlada de aripiprazol a un paciente en necesidad del mismo, en donde la liberación controlada comprende la administración al paciente que es menos frecuente que una vez al día (OD) .
24. Un uso o composición para uso de cualquiera de las reivindicaciones de 15 a 22 en donde la administración es menos frecuente que una vez al día (OD) , o la administración es dos veces por semana o una vez por semana.
Patentes similares o relacionadas:
Dispositivos de administración de fármacos implantables para sitios genitourinarios, del 15 de Julio de 2020, de TARIS Biomedical LLC: Un dispositivo implantable de administración de fármacos que comprende: un depósito de fármaco que tiene una forma alargada […]
Composiciones y métodos no hormonales para la anticoncepción masculina que comprenden (R)-Silodosina, del 1 de Julio de 2020, de Laboratoires Major: Composición para su uso en un método anticonceptivo no hormonal para un sujeto masculino, en la que dicha composición es una formulación de liberación prolongada […]
Métodos para tratar sujetos con síndrome de Prader-Willi o síndrome de Smith-Magenis, del 20 de Mayo de 2020, de ESSENTIALIS, INC: Un agente de apertura del canal KATP para uso en la reducción de uno o más comportamientos agresivos en un sujeto con síndrome de Prader-Willi (PWS), en el que el uso […]
Comunicación inalámbrica para dispositivos médicos sobre el cuerpo, del 13 de Mayo de 2020, de BECTON, DICKINSON AND COMPANY: Un sistema para el suministro de fluidos sobre el cuerpo que comprende: una interfaz de usuario primaria que comprende un reloj de tiempo real de interfaz […]
Formulaciones de liberación controlada de levodopa y usos de las mismas, del 8 de Abril de 2020, de Impax Laboratories, LLC: Formulación sólida oral multiparticulada de liberación controlada que comprende 50 a 600 mg de levodopa y 10 a 80 mg de carbidopa, donde los multiparticulados están en una cápsula […]
Nanopartículas de circulación prolongada para la liberación sostenida de agentes terapéuticos, del 26 de Febrero de 2020, de PFIZER INC.: Una composición de nanopartículas biocompatibles que comprende una pluralidad de nanopartículas de circulación prolongada, comprendiendo cada una: copolímero […]
Composiciones terapéuticas de nanopartículas poliméricas con alta temperatura de transición vítrea o copolímeros de alto peso molecular, del 12 de Febrero de 2020, de PFIZER INC.: Un procedimiento para cribado de suspensiones de nanopartículas para identificar una suspensión que tiene una tasa de liberación de fármaco específica, que comprende: (a) […]
Composición farmacéutica que comprende drospirenona y kit anticonceptivo, del 25 de Diciembre de 2019, de Laboratorios León Farma SA: Kit anticonceptivo que comprende una o más unidades de acondicionamiento, en el que cada unidad de acondicionamiento comprende de 21 a 28 unidades […]