Optimización de dosis de 5-fluorouracilo individual en el tratamiento de FOLFOX.
Método para determinar a partir de una muestra de sangre en un paciente que padece cáncer la dosis D(n+1) de5-fluorouracilo (5-FU) para el siguiente ciclo de tratamiento (n+1),
en el que
• cada ciclo i de tratamiento comprende:
- de 0 a 500 mg/m2 de 5-fluorouracilo (5-FU) administrado en un bolo,
- de 0 a 600 mg/m2 (más o menos 20%) de ácido folínico o una sal del mismo,
- una dosis D(i) (en mg/m2) de 5-FU administrada en una infusión continua de 43 a 49 horas, y
- de 70 a 130 mg/m2 de oxaliplatino; y
• dicha muestra de sangre que ha sido tomada de dicho paciente en un ciclo n de tratamiento previo al menos1 hora después del comienzo de la perfusión de 5-FU y antes del final de dicha perfusión,
• comprendiendo dicho método:
• dosificar in vitro la concentración plasmática de 5-FU ([5-FU]) en la muestra de sangre
• calcular D(n+1) dependiendo de D(n) usando el siguiente esquema de decisión:
- si [5-FU]< 100 μg/l, entonces D(n+1) ≥ D(n) x 1,40,
- si 100 ≤ [5-FU]< 200 μg/l, entonces D(n+1) ≥ D(n) x 1,30,
- si 200 ≤ [5-FU]< 300 μg/l, entonces D(n+1) ≥ D(n) x 1,20,
- si 300 ≤ [5-FU]< 400 μg/l, entonces D(n+1) ≥ D(n) x 1,10,
- si 400 ≤ [5-FU]< 550 μg/l, entonces D(n+1) ≥ D(n) x 1,05,
- si 550 ≤ [5-FU] ≤ 600 μg/l, entonces D(n+1) ≥ D(n),
- si 600< [5-FU]< 700 μg/l, entonces D(n+1) ≥ D(n) x 0,95,
- si 700 ≤ [5-FU]< 800 μg/l, entonces D(n+1) ≥ D(n) x 0,90,
- si 800 ≤ [5-FU]< 900 μg/l, entonces D(n+1) ≥ D(n) x 0,85,
- si [5-FU] ≥ 900, entonces D(n+1) ≥ D(n) x 0,80.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2008/055625.
Solicitante: Institut de Cancérologie de l'Ouest (I.C.O).
Inventor/es: MOREL, ALAIN, GAMELIN,Erick, BOISDRON-CELLE,Michèle.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
- G01N33/94 G01N 33/00 […] › en los que intervienen narcóticos.
PDF original: ES-2414505_T3.pdf
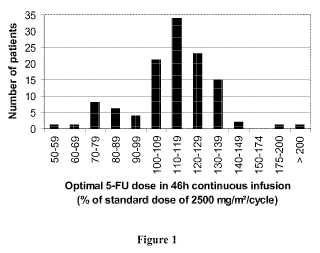
Fragmento de la descripción:
Optimización de dosis de 5-fluorouracilo individual en el tratamiento de FOLFOX.
La presente divulgación se refiere al campo de la medicina personalizada mejorada. Más precisamente, la presente divulgación se refiere a un método para optimizar progresivamente la dosis de 5-FU administrada mediante infusión continua en pacientes tratados mediante un régimen FOLFOX o un régimen similar, basado en la concentración plasmática de 5-FU medida durante la infusión continua previa de 5-FU y en un algoritmo de decisión descrito en la presente memoria. La presente divulgación también se refiere a un método para tratar un paciente con cáncer en el que la dosis de 5-FU administrada en infusión continua en cada FOLFOX o ciclo de tratamiento similar se optimiza usando el algoritmo de decisión según la invención.
Antecedentes de la técnica La mayoría de los fármacos pueden tener efectos perjudiciales. Sin embargo, los fármacos contra el cáncer están entre aquellos que dan como resultado los peores efectos adversos. De hecho, los fármacos contra el cáncer son habitualmente agentes activos citotóxicos con cierta preferencia por células tumorales. Sin embargo, también presentan cierta toxicidad en otras células, dando así como resultado a menudo reacciones adversas serias (20-25% de toxicidad de grado 3-4 y 0, 2% de mortalidad) .
Hay un problema importante, puesto que los efectos adversos serios no afectan solamente a la calidad de vida de los pacientes, sino también pueden dar como resultado la muerte debido a toxicidad, o más a menudo al final o disminución del tratamiento, disminuyendo así su eficiencia.
Las variaciones del metabolismo interindividuales, que influyen en las capacidades anabólicas y catabólicas de los fármacos, participan en el riesgo de toxicidad. Sin embargo, a pesar de algunas mejoras recientes del conocimiento con respecto al metabolismo de fármacos contra el cáncer y de las tecnologías farmacológicas, la individualización terapéutica no es todavía una práctica habitual.
Por el contrario, las dosis se estandarizan habitualmente. Aunque la estandarización de las dosis y de los protocolos puede haber sido útil alguna vez, ahora muestra sus límites con respecto a la eficiencia y toxicidad del tratamiento, dependiendo del sujeto tratado.
Sin embargo, la dosis administrada de fármaco contra el cáncer todavía se calcula habitualmente dependiendo de la superficie corporal, cuya relevancia no se basa en una justificación experimental o teórica, y en el mejor de los casos en unos pocos ensayos biológicos tales como el recuento sanguíneo completo y la comprobación renal. No se tienen en cuenta particularidades farmacocinéticas, metabólicas, genéticas o epigenéticas individuales.
De este modo, existe la necesidad de métodos de tratamiento que usen compuestos contra el cáncer en los que tales particularidades individuales se tomasen en cuenta a fin de disminuir la toxicidad y mejorar la eficiencia del tratamiento.
El 5-fluorouracilo (5-FU) es el fármaco principal contra el cáncer de la familia de fluoropirimidinas, una clase terapéutica de agentes que interfieren con la síntesis del ADN. 5-FU es un fármaco quimioterapéutico importante, y se usa principalmente en el tratamiento de cáncer colorrectal, cáncer gástrico, cáncer esofágico, cáncer ORL, y cáncer de mama, particularmente como un tratamiento adyuvante o en situaciones metastásicas. Cada año, más de 90000 pacientes son tratados mediante 5-FU.
Sin embargo, 5-FU da como resultado 20-25% de toxicidad de grado 3-4 grave, incluyendo toxicidades en el aparato digestivo, tales como diarrea, que pueden ser sanguinolentas o hemorrágicas; complicaciones hematopoyéticas, tales como leuco-neutropenias, que pueden dar como resultado superinfección o septicemia; complicaciones de la piel o de las mucosas, tales como mucositis, eritrodisestesia palmo-plantar; toxidermia; toxicidad cardíaca y síndrome cerebeloso.
Tales efectos adversos se pueden combinar entre sí, dando como resultado un esquema de toxicidad polivisceral, que es muy temprano en 5-8% de pacientes, e incluso da lugar a muerte en 0, 8% de pacientes tratados. Estos efectos adversos también pueden aparecer más tarde, durante el tratamiento.
5. FU se usa habitualmente en situaciones metastásicas. Además, también se usa más o menos a menudo como un tratamiento adyuvante, es decir, en el caso de pacientes tratados para un tumor localizado para el que se teme una recidiva. El riesgo de un efecto adverso tóxico grave no se puede tener en tales condiciones.
Los efectos adversos de 5-FU son debidos principalmente a una gran variabilidad interindividual del metabolismo de 5-FU. El metabolismo de citotoxicidad de 5-FU se basa en su conversión en nucleótidos activos que bloquean la síntesis del ADN. Tales nucleótidos activos se obtienen cuando 5-FU se metaboliza mediante la ruta anabólica. Sin embargo, hay un equilibrio entre la activación enzimática de 5-FU (ruta anabólica) y la eliminación de 5-FU en la ruta catabólica. La enzima inicial y limitante de la eliminación de 5-FU (ruta catabólica) es la dihidropirimidina deshidrogenasa (DPD) . Esta enzima ubicua es un factor principal de biodisponibilidad de 5-FU, puesto que en un sujeto con actividad enzimática de DPD normal, alrededor del 80% de 5-FU administrado se elimina mediante DPD en la ruta catabólica, mientras que sólo 20% de 5-FU administrado está disponible para la ruta anabólica que es necesaria para su acción citotóxica.
Sin embargo, en pacientes con una deficiencia (total o parcial) en la actividad de DPD, el porcentaje de 5-FU administrado que está disponible para la ruta anabólica que es necesaria para su acción citotóxica aumenta enormemente, y estos pacientes tienen así un mayor riesgo de desarrollar toxicidad aguda, temprana y grave debido a 5-FU.
Por otro lado, en pacientes con una mayor actividad de DPD, una dosis estándar basada en la superficie corporal es insuficiente y en consecuencia ineficiente.
La actividad de DPD muestra una gran variabilidad interindividual, con valores de actividad medidos que pueden diferir a partir de una relación de 6 veces entre dos pacientes distintos (Etienne M C, et al: J Clin Oncol 12: 22482253, 1994) . Esta variabilidad enzimática da como resultado una gran variabilidad en el metabolismo de 5-FU y en la cinética plasmática, puesto que el aclaramiento de 5-FU varía en un factor de 6 a 10, dependiendo del sujeto (Gamelin E., et al., J Clin Oncol, 1999, 17, 1105-1110; Gamelin E., et al. J. Clin. Oncol., 1998, 16 (4) , 1470-1478) .
Esta situación tiene enormes implicaciones para la toxicidad del tratamiento, pero también para la eficiencia del tratamiento. De hecho, varios estudios han demostrado que los parámetros farmacocinéticos están correlacionados con la toxicidad, pero también con la eficiencia del tratamiento, con respecto principalmente a la respuesta tumoral en cánceres colorrectal y ORL.
Además, se ha encontrado que el intervalo de concentración plasmática de 5-FU en el que el tratamiento es eficiente y no conduce a efectos adversos graves es más bien estrecho, así que no hay mucha diferencia entre concentraciones plasmáticas de 5-FU eficientes y tóxicas.
De este modo, existe la necesidad de métodos de tratamiento que tuvieran en cuenta tal variabilidad a fin de administrar a cada paciente una dosis de 5-FU que dará como resultado una concentración plasmática de 5-FU en el intervalo estrecho en el que tanto es suficiente para tener actividad terapéutica como es suficientemente baja para evitar toxicidades graves de grado 3-4.
Además de la variabilidad de la actividad de DPD, el metabolismo de 5-FU depende también enormemente de la dosis administrada y mayoritariamente de la duración de la administración, es decir, de la duración de la perfusión. De hecho, DPD es saturable, de manera que una cinética plasmática del paciente no es lineal, y el aclaramiento se multiplica por un factor de 10 cuando se cambia desde una administración de bolo a una perfusión continua durante varias horas o días (Gamelin E., Boisdron-Celle M. Crit Rev Oncol Hematol, 1999, 30, 71-79) .
De este modo, no se puede proporcionar un método de optimización individual general de la dosis de 5-FU. Por el contrario, aunque se puede aplicar cierta tolerancia para pequeñas variaciones, se ha de encontrar un método de optimización individual particular de la dosis de 5-FU para cada protocolo de tratamiento de 5-FU, dependiendo de la dosis y mayoritariamente de la duración de la administración de 5-FU.
Además, el incremento o disminución en la concentración plasmática de 5-FU en un paciente no es proporcional al incremento... [Seguir leyendo]
Reivindicaciones:
1. Método para determinar a partir de una muestra de sangre en un paciente que padece cáncer la dosis D (n+1) de 5-fluorouracilo (5-FU) para el siguiente ciclo de tratamiento (n+1) , en el que
• cada ciclo i de tratamiento comprende:
- de 0 a 500 mg/m2 de 5-fluorouracilo (5-FU) administrado en un bolo,
- de 0 a 600 mg/m2 (más o menos 20%) de ácido folínico o una sal del mismo,
- una dosis D (i) (en mg/m2) de 5-FU administrada en una infusión continua de 43 a 49 horas, y
- de 70 a 130 mg/m2 de oxaliplatino; y
• dicha muestra de sangre que ha sido tomada de dicho paciente en un ciclo n de tratamiento previo al menos 1 hora después del comienzo de la perfusión de 5-FU y antes del final de dicha perfusión,
• comprendiendo dicho método:
• dosificar in vitro la concentración plasmática de 5-FU ([5-FU]) en la muestra de sangre
• calcular D (n+1) dependiendo de D (n) usando el siguiente esquema de decisión:
- si [5-FU] < 100 !g/l, entonces D (n+1) = D (n) x 1, 40,
- si 100 : [5-FU] < 200 !g/l, entonces D (n+1) = D (n) x 1, 30,
- si 200 : [5-FU] < 300 !g/l, entonces D (n+1) = D (n) x 1, 20,
- si 300 : [5-FU] < 400 !g/l, entonces D (n+1) = D (n) x 1, 10,
- si 400 : [5-FU] < 550 !g/l, entonces D (n+1) = D (n) x 1, 05,
- si 550 : [5-FU] : 600 !g/l, entonces D (n+1) = D (n) ,
- si 600 < [5-FU] < 700 !g/l, entonces D (n+1) = D (n) x 0, 95,
- si 700 : [5-FU] < 800 !g/l, entonces D (n+1) = D (n) x 0, 90,
- si 800 : [5-FU] < 900 !g/l, entonces D (n+1) = D (n) x 0, 85,
- si [5-FU] ; 900, entonces D (n+1) = D (n) x 0, 80.
2. Método según la reivindicación 1, en el que la duración de la infusión continua de 5-FU en cada ciclo i es de 46 horas.
3. Método según la reivindicación 1 o 2, en el que la dosis de 5-FU administrada en un bolo en cada ciclo i es de 400 mg/m2.
4. Método según cualquiera de las reivindicaciones 1 a 3, en el que la dosis de ácido folínico o sal del mismo administrada al paciente en cada ciclo i es de 100 mg/m2.
5. Método según cualquiera de las reivindicaciones 1 a 4, en el que la dosis de oxaliplatino administrada al paciente en cada ciclo i es de 85, 100 o 130 mg/m2.
6. Método según cualquiera de las reivindicaciones 1 a 5, en el que el tratamiento comprende además la administración al paciente en cada ciclo i de un anticuerpo monoclonal contra el cáncer.
7. Método según la reivindicación 6, en el que dicho anticuerpo monoclonal contra el cáncer es cetuximab, panitumumab o bevacizumab.
8. Método según cualquiera de las reivindicaciones 1 a 7, en el que la muestra de sangre se ha tomado en el ciclo n de 15 minutos a 22 horas antes del final de la infusión continua de 5-FU.
9. Método según la reivindicación 8, en el que la muestra de sangre ha sido tomada en el ciclo n de 2 a 3 horas antes del final de la infusión continua de 5-FU.
10. Método según cualquiera de las reivindicaciones 1 a 7, en el que la muestra de sangre se ha tomado en el ciclo n entre 1 hora y 5 horas después del comienzo de la infusión continua de 5-FU.
11. Método según cualquiera de las reivindicaciones 1 a 10, en el que la dosis D (1) de 5-FU administrada en una infusión continua en el ciclo 1 es como máximo 2500 mg/m2, y se ha determinado basándose en el diagnóstico de pretratamiento de una posible sensibilidad aumentada de dicho paciente a 5-FU.
12. Método según la reivindicación 11, en el que el diagnóstico de una posible hipersensibilidad de dicho paciente a 5-FU se lleva a cabo a partir de al menos una muestra biológica de dicho paciente combinando al menos dos de los siguientes ensayos in vitro:
a) el análisis de la presencia de una mutación significativa en el gen de DPD,
b) la medida de la concentración plasmática de uracilo, y
c) la medida de la relación de concentraciones plasmáticas de dihidrouracilo/concentración plasmática de uracilo (relación UH2/U) .
13. Método según la reivindicación 12, en el que los tres ensayos in vitro se han llevado a cabo y la dosis inicial D (1) se ha determinado usando el siguiente algoritmo de decisión:
(a) Si
- no se ha detectado ninguna mutación significativa en el gen de DPD y la concentración plasmática de uracilo es menor que 15 !g/l, o
- no se ha detectado ninguna mutación en el gen de DPD y la concentración plasmática de uracilo es al menos 15 !g/l pero la relación UH2/U es de al menos 6,
entonces se administra al paciente en el ciclo 1 una dosis estándar D (1) de 2500 mg/m2.
(b) En todos los otros casos,
- si 6 : relación UH2/U, entonces D (1) es 1750 mg/m2
- si 3 : relación UH2/U < 6, entonces D (1) es 1250 mg/m2
- si 1 : relación UH2/U < 3, entonces D (1) es 750 mg/m2
- si la relación UH2/U < 1, entonces preferentemente el paciente no se trata con 5-FU.
14. Método según cualquiera de las reivindicaciones 1 a 13, en el que dicho paciente padece cáncer colorrectal, cáncer de estómago, cáncer de conductos hepáticos, cáncer de páncreas, cáncer de esófago, o cáncer de mama.
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Métodos para detectar distintivos de enfermedades o afecciones en fluidos corporales, del 15 de Julio de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un método in vitro para diagnosticar la presencia de un agente infeccioso en un individuo que comprende los pasos de: obtener un primer perfil de expresión […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos para clasificar pacientes con un cáncer sólido, del 24 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un método in vitro para el pronóstico del tiempo de supervivencia de un paciente que padece un cáncer sólido, cuyo método comprende los siguientes […]
Procedimiento de detección del cáncer, del 24 de Junio de 2020, de Sienna Cancer Diagnostics Ltd: La presente invención proporciona un procedimiento para resolver una evaluación citológica no concluyente de células epiteliales de vejiga en […]
Método para el diagnóstico/pronóstico de cáncer colorrectal, del 17 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un método de obtención de datos útiles para el diagnóstico, el pronóstico o la monitorización de la evolución de cáncer colorrectal (CCR), […]
Medios y métodos para la predicción de la respuesta a un tratamiento de un paciente con cáncer, del 10 de Junio de 2020, de Grabe, Niels: Un método para predecir si un paciente con cáncer con un tumor sólido responde a un tratamiento con quimioterapia, que comprende las etapas que consisten […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]