Uso de preparaciones FVIII estabilizadas VWF para administración extravascular en la terapia y el tratamiento profiláctico de trastornos de hemorragias.
Uso de una composición que comprende que comprende un factor de von Willebrand (VWF) y un factor VIII (FVIII) no conjugados,
en donde la relación de VWF:Ag por FVIII:C es mayor que 5:1, en donde el FVIII no está modificado químicamente y en donde el factor de von Willebrand se deriva de un plasma humano o es producido por vía recombinante, para la producción de un medicamento destinado al tratamiento de una VWD y/o de una hemofilia A, que ha de ser administrado extravascularmente.
Figura 1: Farmacocinética de 200 U/kg de Monoclate-P® inyectado i.v. o s.c. (n ≥ 2/grupo; media + DT) Figura 2: Actividad de FVIII en plasma de ratones ko con FVIII a continuación de 100 U/kg de Monoclate-P® i.v. o s.c. y de 1.800 U/kg s.c. (media + DT; n ≥ 45/momento
Figura 3: Nivel de la actividad de FVIII en plasma en ratones ko con FVIII a continuación de 1.800 U de
(FVIII:C) /kg de Monoclate-P® o Haemate® P (media + DT; n≥ 4-5/momento) Figura 4: Actividad de FVIII media + DT hasta 2 días a continuación de una inyección s.c. de 900 o
1.800 U de (FVIII:C) /kg de Haemate® P (n ≥ 5/momento) Figura 5: Actividad de FVIII media + DT hasta 2 días a continuación de una inyección
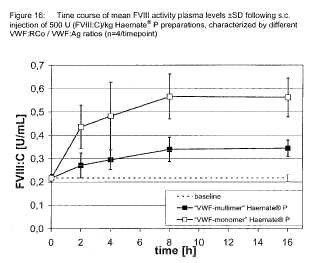
s.c. de 400 U de (FVIII:C) /kg de Haemate® P, caracterizado por una relación de VWF:Ag/FVIII:C variada (n ≥ 5/momento)
Figura 6: Curso en el tiempo de la actividad de FVIII media + DT hasta 2 días a continuación de una inyección s.c. de 200 U de (FVIII:C) /kg de Haemate® P, caracterizado por una relación de VWF:Ag/FVIII:C aumentada (n ≥ 5/momento) Figura 7: Aumento de la AUDC (FVIII) por una relación de VWF:Ag/FVIII:C aumentada
Figura 8: Tiempo de formación de coágulos (in TEM) a continuación de una inyección s.c. de Haemate® P (n ≥ 7-24; media +DT)
Figura 9: Alfa (in TEM) a continuación de una inyección s.c. de Haemate® P (n ≥ 7-24; media + DT)
Figura 10: Comparación de la farmacocinética de FVIII:Ag humano en ratones ko con FVIII a continuación de una inyección i.v. de 100 U de (FVIII:C) /kg de Haemate® P, o Helixate® (media +DT; n ≥3-5/momento)
Figura 11: Comparación de la farmacocinética de FVIII:Ag humano en ratones ko con VWF a continuación de una inyección i.v. de 50 U de (FVIII:C) /kg de Haemate® P y Monoclate P (media +DT; n ≥ 5-6/momento)
Figura 12: Comparación de la actividad de FVIII en un plasma a continuación de una inyección s.c. de 400 U de (FVIII:C) /kg de Haemate® P a ratones ko con FVIII y ko con VWF (media +DT; n ≥ 4-5/momento)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/004770.
Solicitante: CSL BEHRING GMBH.
Nacionalidad solicitante: Alemania.
Dirección: EMIL-VON-BEHRING-STRASSE 76 35041 MARBURG ALEMANIA.
Inventor/es: KRONTHALER,ULRICH.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/36 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de coagulación sanguínea o de fibrinolisis.
- A61K38/37 A61K 38/00 […] › Factores VIII.
- A61P7/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 7/00 Medicamentos para el tratamiento de trastornos de la sangre o del fluido extracelular. › Antihemorrágicos; Procoagulantes; Hemostáticos; Antifibrinolíticos.
PDF original: ES-2392569_T3.pdf
Fragmento de la descripción:
Uso de preparaciones FVIII estabilizadas VWF para administración extravascular en la terapia y el tratamiento profiláctico de trastornos de hemorragias
Campo del invento:
El presente invento se refiere al uso de una preparación de VWF en combinación con un factor VIII de coagulación (FVIII) para una administración extravascular en la terapia y el tratamiento profiláctico de trastornos de hemorragias.
Antecedentes del invento:
Un VWF es una glicoproteína adhesiva multimérica presente en el plasma de mamíferos, que tiene múltiples funciones fisiológicas. Durante una hemóstasis primaria, un VWF actúa como un mediador entre unos receptores específicos sobre la superficie de las plaquetas y unos componentes de la matriz extracelular tales como un colágeno. A través del receptor de GP lIbIlla, un VWF contribuye a una hemóstasis también a través de una promoción de la interacción entre una plaqueta y otra plaqueta. Más aun, un VWF sirve como un vehículo y como una proteína estabilizadora para un FVIII procoagulante. Un VWF es sintetizado en células endoteliales y megacariocitos como una molécula precursora de 2.813 aminoácidos. El polipéptido precursor, pre-pro-VWF, consiste en un péptido de señal de 22 residuos, un pro-péptido de 741 residuos y el polipéptido de 2.050 residuos encontrado en un VWF de un plasma maduro (Fischer y colaboradores, FEBS Lett. 351: 345-348, 1994) . Después de una secreción dentro del plasma, un VWF circula en la forma de diversas especies con diferentes tamaños moleculares. Estas moléculas de VWF consisten en oligómeros y multímeros de la subunidad madura de 2.050 residuos de aminoácidos. Un VWF puede ser hallado usualmente en un plasma en forma de un dímero hasta llegar a multímeros que consisten en 50 -100 dímeros (Ruggeri y colaboradores, Thromb. Haemost. 82: 576-584, 1999) . La semivida in vivo de un VWF humano en la circulación humana es de aproximadamente 12 a 20 horas.
El trastorno de hemorragia más frecuente, heredado con la máxima frecuencia en seres humanos, es una enfermedad de von Willebrand (VWD) , que puede ser tratada mediante una terapia de reemplazo con unos concentrados que contienen un VWF de origen plasmático o recombinante.
Un VWF puede ser preparado a partir de un plasma humano, tal como se describe, por ejemplo, en el documento de patente europea EP 05503991. El documento EP 0784632 describe un método para aislar un VWF recombinante.
Se sabe que un VWF estabiliza a un FVIII in vivo y, por lo tanto, desempeña un cometido crucial para regular los niveles de FVIII en plasma y, como consecuencia de ello, es un factor principal para reprimir unas hemóstasis primarias y secundarias. Se conoce también que a continuación de una administración por vía intravenosa de preparaciones farmacéuticas que contienen un VWF en pacientes de VWD, se puede observar un aumento en un FVIII:C endógeno a 1 hasta 3 unidades por ml en 24 horas, demostrando el efecto estabilizador in vivo de un VWF sobre un FVIII.
Un FVIII es una glicoproteína de plasma sanguíneo con una masa molecular de aproximadamente 260 kDa, producida en el hígado de mamíferos. Él es un componente crítico de la cascada de reacciones de coagulación que conducen a la coagulación de la sangre. Dentro de esta cascada se encuentra una etapa en la que el factor IXa (FIXa) , en conjunción con un FVIII, convierte al factor X (FX) en una forma activada, FXa. Un FVIII actúa como un cofactor en esta etapa, siendo requerido con iones de calcio y un fosfolípido para la actividad del FIXa. Los trastornos hemofílicos más corrientes son causados por una deficiencia de FVIII funcional, denominada hemofilia A.
Un avance importante en el tratamiento de una hemofilia A ha sido el aislamiento de clones de ADNc (ADN cromosomal) que codifican la secuencia de 2.351 aminoácidos completa de un FVIII (patente de los Estados Unidos nº 4.757.006) y la provisión de la secuencia de ADN del gen de un FVIII humano y de métodos recombinantes para su producción.
Un análisis de la secuencia de aminoácidos primaria deducida de un FVIII humano, determinada a partir del ADNc clonado, indica que éste es un heterodímero procesado a partir de un polipéptido precursor más grande. El heterodímero consiste en una cadena ligera terminal de C de aproximadamente 80 kDa en una asociación dependiente de iones metálicos con un fragmento de cadena pesada terminal de N de aproximadamente 210 kDa. (Véase una recopilación hecha por Kaufman, Transfusion Med. Revs. 6:235 (1992) ) . Se realiza una activación fisiológica del heterodimero mediante una disociación proteolítica de las cadenas de la proteína mediante trombina. La trombina disocia a la cadena pesada para dar una proteína de 90 kDa, y luego para dar fragmentos de 54 kDa y 44 kDa. La trombina disocia también a la cadena ligera de 80 kDa para dar una proteína de 72 kDa. Son la última proteína y los dos fragmentos de cadena pesada (de 54 kDa y 44 kDa anteriores) , mantenidos juntos mediante iones de calcio, la/los que constituyen un FVIII activo. Una desactivación se realiza cuando las proteínas de 72 kDa y 54 kDa son disociadas aún más por trombina, una proteína C activada o un FXa. En un plasma, este complejo de FVIII es estabilizado por asociación con un exceso 50 veces mayor de una proteína de VWF (“VWF”) , que manifiesta inhibir la destrucción proteolítica de un FVIII tal como más arriba se ha descrito.
La secuencia de aminoácidos de un FVIII es organizada en tres dominios estructurales, un domino A triplicado de 330 aminoácidos, un único dominio B de 980 aminoácidos, y un dominio C duplicado de 150 aminoácidos. El dominio B no tiene ninguna homología con otras proteínas y proporciona 18 de los 25 sitios de glicosilación enlazados con asparagina (N) potenciales de esta proteína. El dominio B no tiene aparentemente ninguna función en la coagulación y puede ser suprimido, teniendo la molécula del FVIII con el dominio B suprimido todavía una actividad procoaguladora.
El efecto estabilizador de un VWF sobre un FVIII ha sido usado también para ayudar a la expresión recombinante del FVIII en células CHO (Kaufman y colaboradores 1989, Mol Cell Biol) .
Hasta hoy en día, el tratamiento clásico de una hemofilia A y de una VWD implica a infusiones intravenosas de preparaciones de concentrados de FVIII y VWF, derivadas de los plasmas de donantes humanos o, en el caso de un FVIII, las de preparaciones farmacéuticas basadas en un FVIII recombinante. Mientras que estas terapias de reemplazo son generalmente eficaces, p.ej. en pacientes de hemofilia A grave, que están siendo sometidos a un tratamiento profiláctico. Un factor VIII ha de ser administrado por vía intravenosa (i.v.) aproximadamente 3 veces por semana debido a la corta semivida en plasma del factor VIII, de aproximadamente 12 horas. Ya si se alcanzan unos niveles por encima de 1 % de la actividad de FVIII en individuos no hemofílicos sanos, p.ej. mediante un aumento en los niveles de FVIII de 0, 01 U/ml, una hemofilia A grave es convertida en una hemofilia A moderada. En una terapia profiláctica se diseñan unos regímenes de dosificación tales que los niveles mínimos de actividad de FVIII no caen por debajo de unos niveles de 2-3 % de la actividad de FVIII en individuos no hemofílicos sanos. Cada administración por vía i.v. es complicada, está asociada con dolor e implica el riesgo de una infección especialmente puesto que ella se realiza en la mayor parte de los casos en un tratamiento doméstico por los pacientes propiamente dichos o por los padres de niños que se han diagnosticado como enfermos de hemofilia A. Además, las frecuentes inyecciones i.v. dan como resultado inevitablemente la formación de cicatrices, interfiriendo con futuras infusiones. Puesto que un tratamiento profiláctico en una hemofilia grave se empieza en una época temprana en la vida, con niños que con frecuencia tienen una edad menor que 2 años, es incluso más difícil inyectar un FVIII 3 veces por semana dentro de las venas de dichos pacientes pequeños. Durante un período de tiempo limitado, la implantación de sistemas de lumbreras, pueden ofrecer una alternativa. A pesar del hecho de que pueden producirse infecciones repetidas y las lumbreras pueden causar inconvenientes durante un ejercicio físico, ellas no obstante son consideradas típicamente como favorables en comparación con unas inyecciones intravenosas.
Por lo tanto hay una necesidad médica grande de evitar la necesidad de infundir un VWF o FVIII por vía intravenosa.
Puesto... [Seguir leyendo]
Reivindicaciones:
1. Uso de una composición que comprende que comprende un factor de von Willebrand (VWF) y un factor VIII (FVIII) no conjugados, en donde la relación de VWF:Ag por FVIII:C es mayor que 5:1, en donde el FVIII no está modificado químicamente y en donde el factor de von Willebrand se deriva de un plasma humano o es producido por vía recombinante, para la producción de un medicamento destinado al tratamiento de una VWD y/o de una hemofilia A, que ha de ser administrado extravascularmente.
Figura 1: Farmacocinética de 200 U/kg de Monoclate-P® inyectado i.v. o s.c. (n = 2/grupo; media + DT)
Figura 2: Actividad de FVIII en plasma de ratones ko con FVIII a continuación de 100 U/kg de Monoclate-P® i.v. o s.c. y de 1.800 U/kg s.c. (media + DT; n = 45/momento
Figura 3: Nivel de la actividad de FVIII en plasma en ratones ko con FVIII a continuación de 1.800 U de
(FVIII:C) /kg de Monoclate-P® o Haemate® P (media + DT; n= 4-5/momento) Figura 4: Actividad de FVIII media + DT hasta 2 días a continuación de una inyección s.c. de 900 o
1.800 U de (FVIII:C) /kg de Haemate® P (n = 5/momento)
Figura 5: Actividad de FVIII media + DT hasta 2 días a continuación de una inyección
s.c. de 400 U de (FVIII:C) /kg de Haemate® P, caracterizado por una relación de VWF:Ag/FVIII:C variada (n = 5/momento)
Figura 6: Curso en el tiempo de la actividad de FVIII media + DT hasta 2 días a continuación de una inyección s.c. de 200 U de (FVIII:C) /kg de Haemate® P, caracterizado por una relación de VWF:Ag/FVIII:C aumentada (n = 5/momento)
Figura 7: Aumento de la AUDC (FVIII) por una relación de VWF:Ag/FVIII:C aumentada
Figura 8: Tiempo de formación de coágulos (in TEM) a continuación de una inyección s.c. de Haemate® P (n = 7-24; media +DT)
Figura 9: Alfa (in TEM) a continuación de una inyección s.c. de Haemate® P (n = 7-24; media + DT)
Figura 10: Comparación de la farmacocinética de FVIII:Ag humano en ratones ko con FVIII a continuación de una inyección i.v. de 100 U de (FVIII:C) /kg de Haemate® P, o Helixate® (media +DT; n =3-5/momento)
Figura 11: Comparación de la farmacocinética de FVIII:Ag humano en ratones ko con VWF a continuación de una inyección i.v. de 50 U de (FVIII:C) /kg de Haemate® P y Monoclate P (media +DT; n = 5-6/momento)
Figura 12: Comparación de la actividad de FVIII en un plasma a continuación de una inyección s.c. de 400 U de (FVIII:C) /kg de Haemate® P a ratones ko con FVIII y ko con VWF (media +DT; n = 4-5/momento)
2.300 U de VWF:Ag) /kg de Haemate® P a conejos (media + DT; n = 4/momento)
Figura 14: Curso en el tiempo del nivel de VWF:Ag, VWF:Rco y FVIII:C en plasma medio + DT hasta 3 días a continuación de una inyección s.c. de 523 U de (VWF:Ag) /kg (n = 5/momento)
Figura 15: Cometido del VWF para la generación de anticuerpos anti-FVIII y de anticuerpos inhibidores de FVIII (ensayo de Bethesda) a continuación de una administración por vía i.v. o s.c. de FVIII
tiempo [h]
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Antídotos para inhibidores del factor Xa y procedimientos de uso de los mismos, del 24 de Junio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una composición farmacéutica que comprende un transportador y un polipéptido para uso en terapia donde el polipéptido comprende una secuencia de aminoácidos que tiene […]
Ciclodextrinas como procoagulantes, del 22 de Abril de 2020, de Alveron Pharma B.V: Una ciclodextrina sustituida de la fórmula (I): **(Ver fórmula)** en donde n es un número entero de 3 a 7 y R se selecciona del grupo […]
Anticuerpos que son capaces de unirse específicamente al inhibidor de la vía del factor tisular, del 8 de Abril de 2020, de NOVO NORDISK A/S: Un anticuerpo que se une específicamente dentro de los aminoácidos 186-276 del TFPI (SEQ ID NO: 1), en donde la cadena pesada comprende: • una secuencia […]
Cristales del compuesto 2-acilaminotiazol, del 25 de Marzo de 2020, de ASTELLAS PHARMA INC.: 1. Un cristal de la sal de ácido maleico del ácido 1-(3-cloro-5-{[4-(4-clorotiofen-2-il)-5-(4-ciclohexil piperazin-1-il)tiazol- 2-il]carbamoil} […]
Uso terapéutico sinérgico de concentrados de complejo de protrombina con concentrados de FVIII, del 18 de Marzo de 2020, de CSL BEHRING GMBH: Composición que comprende factores de coagulación FII, FIX, FX y FVII aislados y una composición que comprende FVIII aislado y, opcionalmente, VWF aislado para […]
Preparación líquida anhidra de melatonina, del 26 de Febrero de 2020, de Worphmed Srl: Una solución parenteral a granel sustancialmente libre de agua que consiste en una preparación líquida anhidra de melatonina que contiene al menos: a) […]
Métodos para aumentar la producción de células madre hematopoyéticas y plaquetas, del 22 de Enero de 2020, de Janssen Pharmaceuticals, Inc: Una composición farmacéutica para su uso en un método de (i) proporcionar células madre hematopoyéticas a un sujeto; (ii) reducir el tiempo de injerto […]