Sistema de asistencia para órganos.
Un sistema de asistencia para órganos (10) que comprende, en un sistema de circuito cerrado con fluido recirculante:
una prótesis en forma de anillo (12) que rodea haciendo contacto, como mínimo, una porción de la parte del cuerpo, incluyendo una pluralidad de vesículas (12A-12D) adaptadas para la dilatación y contracción selectivas, en respuesta a una variación de la presión del fluido dentro de ellas;
una bomba de fluidos (16) ;
como mínimo una formación (18) que comprende una pluralidad de células de presión (PC1 , PC2 , ..., PCM) ;
conductos (20, 22, 24, 26) que conectan dichas vesículas (12A-12D) , bomba (16) y una pluralidad de células de presión (PC1 , PC2 , ..., PCM) ;
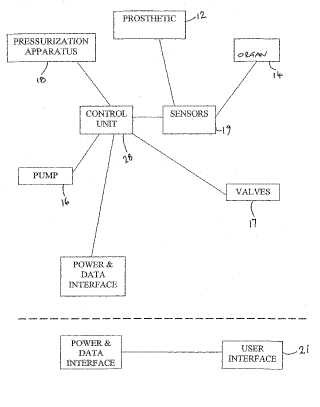
una unidad de control (28) de un sistema de control para controlar el funcionamiento de, como mínimo, la mencionada bomba de fluidos (16) ;
una pluralidad de sensores de presión (34) dentro del mencionado sistema hidráulico cerrado;
una fuente de energía (38) ; y una pluralidad de válvulas de cierre (Vo1, Vo2, ....VoM) [[;]], en donde cada una de dichas células de presión (PC1 , PC2 , ..., PCM) comprende una jaula (186) de un material biocompatible esencialmente rígido, dividida por una pared elástica flexible (188) en una cámara interior (182) y una cámara exterior (184) , dicha cámara exterior es una cámara sellada rodeada por dicha jaula (186) y dicha pared elástica flexible (188) , y está llena de un gas de baja densidad, y dicha cámara interior (182) está definida por dicha pared elástica flexible (188) , tiene una entrada (VIN) y una salida (VOUT) que se pueden cerrar mediante válvulas de accionamiento rápido y llenas de líquido, la presión máxima de cada célula es definida por la presión en dicha cámara exterior sellada y por la geometría de cada célula, y en donde al menos una de dichas formaciones (18) de una pluralidad de células de presión (PC1 , PC2 , ..., PCM) se posiciona flujo arriba de dicha prótesis (12) , cada célula de presión (PC1, PC2, ..., PCM) tiene una válvula de cierre controlado (Vi1, Vi2, ....VuM) en dicha entrada a la misma, y una segunda válvula de cierre controlado (Vo1, Vo2, ....VoM) en dicha salida de la misma, dichas válvulas de cierre controlado son controladas por dicha unidad de control (28) de dicho sistema de control, de modo que dicha pluralidad de células de presión (PC1, PC2, ..., PCM) puede proporcionar un rango de presurizaciones a dichas vesículas (12A-12D) de dicha prótesis (12) para aplicar un efecto de presurización variable controlada a la parte del cuerpo en cuestión.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IL2006/000838.
Solicitante: BEN SHALOM, ZVI.
Nacionalidad solicitante: Israel.
Dirección: BAT HADAR, NO. 206 D.N. HOF ASHKELON 79103 ISRAEL.
Inventor/es: BEN-SHALOM, ZVI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61N1/362 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61N ELECTROTERAPIA; MAGNETOTERAPIA; RADIOTERAPIA; TERAPIA POR ULTRASONIDOS (medida de corrientes bioeléctricas A61B; instrumentos quirúrgicos, dispositivos o métodos para transferir formas no mecánicas de energía hacia o desde el cuerpo A61B 18/00; aparatos de anestesia en general A61M; lámparas incandescentes H01K; radiadores de infrarrojos utilizados como calefactores H05B). › A61N 1/00 Electroterapia; Circuitos correspondientes (A61N 2/00 tiene prioridad; preparaciones conductoras de la electricidad que se utilizan en terapia o en examen in vivo A61K 50/00). › Estimuladores cardiacos (A61N 1/372 tiene prioridad; desfibriladores cardiacos A61N 1/39).
PDF original: ES-2377076_T3.pdf
Fragmento de la descripción:
Sistema de asistencia para órganos.
CAMPO DE LA INVENCIÓN
La presente invención se relaciona, en general, con la aplicación de presión a un órgano o miembro del cuerpo a fin de asistir al órgano o miembro para que desempeñe su función inherente.
DEFINICIÓN
En la presente especificación y reivindicaciones, los términos “órgano” y “parte del cuerpo” se utilizan indistintamente y, en general, se refieren a cualquier porción del cuerpo de un mamífero que se pueda ver beneficiada de un sistema de asistencia al flujo sanguíneo, que incluye pero no se limita al corazón y muslos del ser humano.
ANTECEDENTES DE LA INVENCIÓN
En años recientes ha habido muchos desarrollos en el campo de la asistencia cardiaca, con una gran abundancia de dispositivos y sistemas para ayudar en el bombeo de un corazón disfuncional. Un enfoque común es utilizar un marcapasos para proporcionar un pulso eléctrico que haga que el corazón se dilate. Otro enfoque es realizar un trasplante de corazón, sustituyendo el corazón por el de un donante. Otro enfoque más es utilizar un corazón artificial. Los corazones artificiales son particularmente útiles como soluciones puente a corto plazo hasta que se disponga de corazones de donantes apropiados.
Otro tercer enfoque es proporcionar un dispositivo de asistencia cardiaca, en esencia, una prótesis envuelta alrededor del corazón o de parte del mismo, por ejemplo, del ventrículo izquierdo. La contracción de la prótesis proporciona una fuerza de contracción en el corazón, ayudándolo a bombear.
Se han desarrollado una variedad de dispositivos cardiacos mecánicos, incluyendo bombas que sirven como dispositivos de asistencia ventricular y corazones artificiales completos. Cada dispositivo funciona de manera diferente y es apropiado para una función específica diferente.
En 1969, el Dr. Denton A. Cooley realizó el primer implante en el mundo de un corazón totalmente artificial. El dispositivo, desarrollado por el Dr. Domingo Liotta, fue implementado en un paciente de 47 años con insuficiencia cardiaca severa, y mantuvo al paciente durante casi tres días, hasta que se encontró un corazón donado que hizo posible el trasplante. El corazón totalmente artificial de Liotta era una bomba impulsada por aire (neumática) , de doble ventrículo. Válvulas Wada-Cutter sin bisagras controlaban el flujo de sangre a través de las áreas de entrada y salida de la bomba. Las dos cámaras de bombeo (los “ventrículos”) , los tractos de entrada en forma de manguitos (los “atrios”) y los tractos de salida se forraron con una tela especial que promovía la formación de una superficie celular lisa. Los tractos flexibles de entrada y salida se hicieron en dacrón, y las cámaras de bombeo en dacrón y Silastic. Las bombas se conectaron a la unidad de alimentación externa con tubos de Silastic cubiertos en dacrón. La consola, también un gran logro ingenieril en su época, era aproximadamente del tamaño de una lavadora doméstica grande. Dos unidades de alimentación neumáticas generaban las acciones de bombeo y vacío necesarias para mover la sangre a través del corazón artificial. El complejo panel de control incluía numerosos interruptores y botones que se utilizaban para ajustar la frecuencia de bombeo y la presión de bombeo.
En julio de 1981, nuevamente el Dr. Cooley implantó un corazón totalmente artificial. Desarrollado por el Dr. Tetsuzo Akutsu en el Instituto del Corazón de Texas, el corazón artificial total Akutsu III se implantó en un hombre de 36 años y lo mantuvo vivo durante 55 horas, hasta que se encontró un corazón donado para el trasplante. El corazón artificial total Akutsu III contenía dos bombas de doble cámara accionadas por aire. Las cámaras de bombeo se hicieron en un material liso llamado Avcothane, que se podía moldear en una pieza. Los puertos de entrada y salida contenían válvulas de disco Bjork-Shiley. Los ventrículos protésicos se unieron a los restos de los atrios del corazón natural y a los vasos sanguíneos mayores mediante conductos flexibles de entrada y salida con conectores rápidos desprendibles. Las bombas se conectaron con tubos recubiertos de dacrón a una consola de control externa. La consola de control tenía tres sistemas básicos: un sistema de impulsión neumático (impulsado por aire) , un sistema eléctrico de monitorización y control, y un sistema de energía eléctrica. El sistema de accionamiento neumático proporcionaba presión y también vacío a cada ventrículo. En condiciones de uso normal, la consola se conectaba a fuentes de presión y vacío de pared. Durante el transporte del paciente, o en caso de fallo de energía eléctrica en el lugar, el sistema automáticamente conmutaba a tanques de aire comprimido de a bordo. Las funciones primarias del sistema eléctrico de monitorización y control eran la monitorización de la frecuencia cardiaca y de la duración sistólica. El sistema de monitorización y control proporcionaba una lectura digital de la presión y el vacío suministrados a la línea de conducción, además del estado de las fuentes de alimentación eléctrica estándar y de emergencia. El sistema de alimentación eléctrica tenía dos fuentes de energía independientes: corriente AC/DC estándar y una batería de repuesto para casos de fallo de alimentación eléctrica.
El corazón artificial total Jarvik-7, diseñado por el Dr. Robert Jarvik, probablemente sea el más conocido entre los dispositivos de corazón artificial. Está diseñado para funcionar como el corazón natural. Se implantó por primera vez en 1982, en un paciente llamado Barney Clark, quien sobrevivió durante 112 días. A fines de la década de 1980, los cirujanos habían utilizado el Jarvik-7 como puente para trasplantes en más de 70 pacientes. Posteriormente, el Jarvik-7 fue llamado corazón artificial total Symbion. En la actualidad se le conoce como el corazón artificial total Cardio West y aún está en uso como puente para trasplantes.
El Jarvik-7 tiene dos bombas, a similitud de los ventrículos del corazón. Cada “ventrículo” de poliuretano en forma de esfera presenta un mecanismo en forma de disco que empuja la sangre desde la válvula de entrada a la válvula de salida. Los ventrículos se accionan neumáticamente (aire) . El aire se impulsa a través de las cámaras de aire ventriculares a frecuencias de 40 a 120 latidos por minuto. El corazón artificial está unido a los atrios naturales del corazón mediante manguitos realizados en fieltro dacrón. Las líneas de conducción hacia fuera de las cámaras de aire ventriculares están realizadas en tubería de poliuretano reforzado. Donde salen de la piel, las líneas están cubiertas de Silastic recubierto de fieltro, lo que asegura estabilidad y estimula el crecimiento tisular, incluso con el movimiento del paciente. El sistema externo de energía accionado por aire acciona la bomba a través de líneas de conducción que entran al corazón a través de lado izquierdo del paciente. La gran consola sobre ruedas es tan grande y pesada como un refrigerador doméstico. Normalmente se conecta a fuentes de aire comprimido, vacío y electricidad. El sistema está respaldado por una batería recargable para casos de fallos de energía eléctrica, e incluye tanques de aire comprimido a bordo (tipo buceo, modificados) para el uso durante el transporte del paciente. Los controles en la consola permiten que el médico controle la frecuencia de bombeo, la presión de bombeo y otras funciones esenciales.
El corazón de reemplazo implantable AbioCor™ representa la culminación de 30 años de investigación, desarrollo y ensayos realizados por ABIOMED, Inc. y sus colaboradores, con el soporte del Instituto Nacional del Corazón, Pulmón y Sangre. Fue el primer corazón artificial total completamente autocontenido, y está diseñado para sostener el sistema circulatorio del cuerpo y para prolongar las vidas de pacientes que, de lo contrario, morirían de insuficiencia cardiaca. Al contrario de otros sistemas descritos arriba, está totalmente implantado dentro del cuerpo, y los pacientes no están atados a una gran consola de bombeo de aire, ni tienen cables ni tubos que atraviesen la piel. El AbioCor está ideado para ser utilizado en pacientes con insuficiencia cardiaca en etapa terminal, cuyos corazones presentan insuficiencias irreversibles en los ventrículos izquierdo y derecho y para quienes la cirugía o terapia médica son inadecuadas.
El AbioCor consiste en una unidad torácica, una batería interna recargable,... [Seguir leyendo]
Reivindicaciones:
1. Un sistema de asistencia para órganos (10) que comprende, en un sistema de circuito cerrado con fluido recirculante:
una prótesis en forma de anillo (12) que rodea haciendo contacto, como mínimo, una porción de la parte del cuerpo, incluyendo una pluralidad de vesículas (12A-12D) adaptadas para la dilatación y contracción selectivas, en respuesta a una variación de la presión del fluido dentro de ellas;
una bomba de fluidos (16) ;
como mínimo una formación (18) que comprende una pluralidad de células de presión (PC1 , PC2 , ..., PCM) ;
conductos (20, 22, 24, 26) que conectan dichas vesículas (12A-12D) , bomba (16) y una pluralidad de células de presión (PC1 , PC2 , ..., PCM) ;
una unidad de control (28) de un sistema de control para controlar el funcionamiento de, como mínimo, la mencionada bomba de fluidos (16) ;
una pluralidad de sensores de presión (34) dentro del mencionado sistema hidráulico cerrado;
una fuente de energía (38) ; y una pluralidad de válvulas de cierre (Vo1, Vo2, ....VoM) [[;]], en donde cada una de dichas células de presión (PC1 , PC2 , ..., PCM) comprende una jaula (186) de un material biocompatible esencialmente rígido, dividida por una pared elástica flexible (188) en una cámara interior (182) y una cámara exterior (184) , dicha cámara exterior es una cámara sellada rodeada por dicha jaula (186) y dicha pared elástica flexible (188) , y está llena de un gas de baja densidad, y dicha cámara interior (182) está definida por dicha pared elástica flexible (188) , tiene una entrada (VIN) y una salida (VOUT) que se pueden cerrar mediante válvulas de accionamiento rápido y llenas de líquido, la presión máxima de cada célula es definida por la presión en dicha cámara exterior sellada y por la geometría de cada célula, y en donde al menos una de dichas formaciones (18) de una pluralidad de células de presión (PC1 , PC2 , ..., PCM) se posiciona flujo arriba de dicha prótesis (12) , cada célula de presión (PC1, PC2, ..., PCM) tiene una válvula de cierre controlado (Vi1, Vi2, ....VuM) en dicha entrada a la misma, y una segunda válvula de cierre controlado (Vo1, Vo2, ....VoM) en dicha salida de la misma, dichas válvulas de cierre controlado son controladas por dicha unidad de control (28) de dicho sistema de control, de modo que dicha pluralidad de células de presión (PC1, PC2, ..., PCM) puede proporcionar un rango de presurizaciones a dichas vesículas (12A-12D) de dicha prótesis (12) para aplicar un efecto de presurización variable controlada a la parte del cuerpo en cuestión.
2. El sistema según la reivindicación 1, en donde la mencionada pluralidad de células de presión (PC1, PC2, ..., PCN) comprende una pluralidad de N células de presión, y es capaz de proporcionar hasta 2N intensidades de pulsación a las vesículas de la mencionada prótesis.
3. El sistema según la reivindicación 2, en donde la mencionada pluralidad de células de presión (PC1, PC2, ..., PCN) comprende una formación de N células de presión, que puede funcionar en, al menos, uno de los siguientes modos:
a. en paralelo,
b. en serie, y
c. una combinación de paralelo y serie.
4. El sistema según la reivindicación 1, en donde como mínimo la mencionada formación (18) que comprende una pluralidad de células de presión (PC1 , PC2 , ..., PCM) está formada por, al menos, dos formaciones (118) , y en donde una segunda formación está posicionada flujo abajo respecto de la mencionada prótesis en forma de anillo.
5. El sistema según la reivindicación 1, en donde la mencionada pared elástica flexible (118) es un tubo de un material elástico flexible dentro de la mencionada jaula (186) .
6. El sistema según la reivindicación 1, en donde se obtienen las presurizaciones deseadas de cada una de las células de presión (PC1, PC2, ..., PCM) con alta precisión por selección apropiada de volumen de la mencionada jaula sellada (186) y control de la presión correspondiente.
7. El sistema según la reivindicación 1, en donde las mencionadas cámaras exteriores (184) de cada una de al menos dos de la mencionada pluralidad de células de presión (PC1, PC2, ..., PCM) tiene un tamaño diferente y/o presión interna diferente.
8. El sistema según la reivindicación 1, en donde las cámaras exteriores (184) de cada una de la mencionada pluralidad de células de presión (PC1, PC2, ..., PCM) se conectan a un depósito (23) , de modo que sea variable la presión mínima dentro de la cámara exterior (184) correspondiente a una cámara interior (182) completamente aplanada.
9. El sistema según la reivindicación 1, en donde la mencionada prótesis (12) comprende una pluralidad de componentes que incluyen conductos (20, 22, 24, 26) y vesículas (12A-12D) , seleccionables de un juego para proporcionar una prótesis específica adaptable a una parte específica del cuerpo de un paciente específico.
10. El sistema según la reivindicación 1, en donde la mencionada prótesis (12) tiene una construcción modular e incluye conductos individuales (20, 22, 24, 26) , vesículas (12A-12D) y placas de soporte rígidas (148, 150, 152) , para disponer alrededor de la parte del cuerpo en una o más capas, permitiendo así adaptar la mencionada prótesis (12) a la medida de un órgano específico de un paciente específico.
11. El sistema según la reivindicación 1, en donde la mencionada prótesis (12) se hace a medida para adaptarse a un órgano específico de un paciente específico, seleccionando y disponiendo subcomponentes adecuados para suministrar características apropiadas de presión localmente allí donde se necesite.
12. El sistema según la reivindicación 1, en donde la parte del cuerpo es un corazón y la mencionada prótesis
(12) es una prótesis para vincularse al corazón, que rodea, como mínimo, una parte de dicho corazón.
13. El sistema según la reivindicación 12, que además comprende un sensor ECG (35) acoplado a la mencionada unidad de control (28) para controlar las mencionadas válvulas de cierre (Vo1, Vo2, ....VoM, Vi1, Vi2, ....ViM) del mencionado sistema en respuesta al mencionado bombeo del corazón.
14. El sistema según la reivindicación 1, configurado como un dispositivo de asistencia cardiaca (10) para asistir en el bombeo a un corazón dañado, en donde la mencionada pluralidad de células de presión (PC1, PC2, ..., PCM) proporciona una presión diastólica para evitar que el corazón relajado se dilate.
15. El sistema según la reivindicación 1, configurado como un dispositivo de asistencia cardiaca (10) para asistir en el bombeo a un corazón dañado, en donde la mencionada pluralidad de células de presión (PC1, PC2, ..., PCM) proporciona una presión sistólica para asistir a la contracción del mencionado corazón y, de este modo, asistir al mencionado bombeo del mismo.
16. El sistema según la reivindicación 1, en donde la parte del cuerpo es un órgano interno y el mencionado sistema de control es accionado por un sistema de transmisión de energía transcutánea (TET) (36A, 36B) .
17. El sistema según la reivindicación 1, en donde la mencionada unidad de control (28) es programable antes de la activación.
18. El sistema según la reivindicación 1, en donde la mencionada unidad de control (28) es reprogramable durante la operación.
19. El sistema según la reivindicación 1, en donde la mencionada unidad de control (28) responde a necesidades cambiantes.
20. El sistema según la reivindicación 1, en donde el mencionado fluido es una solución salina.
PRÓTESIS
ÓRGANO
Patentes similares o relacionadas:
Sistemas de dispositivos médicos con múltiples modos de comunicación, del 24 de Junio de 2020, de CARDIAC PACEMAKERS, INC.: Un método de comunicación de información entre una pluralidad de dispositivos médicos en un sistema de dispositivos médicos, en […]
Formaciones gráficas definidas por el usuario usadas como una ayuda de visualización para la programación de estimulador, del 20 de Noviembre de 2019, de BOSTON SCIENTIFIC NEUROMODULATION CORPORATION: Un sistema para programar un dispositivo de neuroestimulación acoplado a uno o más electrodos , que comprende: una interfaz (72, […]
Detección de fibrilación auricular, del 7 de Agosto de 2019, de CARDIAC PACEMAKERS, INC.: Un aparato que comprende: un circuito de detección configurado para generar una señal fisiológica detectada representativa de la actividad cardíaca de […]
Dispositivo médico para el tratamiento de arritmias cardíacas, del 19 de Junio de 2019, de Shanghai MicroPort Medical (Group) Co., Ltd: Un dispositivo médico para el tratamiento de arritmias cardíacas, que comprende un microprocesador y un módulo digital/analógico en conexión con el microprocesador, comprendiendo […]
Sistema y método para ajustar automáticamente los parámetros de control de la terapia de resincronización cardíaca, del 5 de Junio de 2019, de BRIGHAM AND WOMEN'S HOSPITAL, INC.: Un método para controlar un dispositivo de tratamiento del ritmo cardíaco (CRM), comprendiendo las etapas del método: a) obtener señales que representan […]
Sistemas para el suministro seguro de una terapia de estimulación eléctrica, del 20 de Mayo de 2019, de CARDIAC PACEMAKERS, INC.: Un marcapasos cardíaco sin cables (LCP) que comprende: una carcasa ; una pluralidad de electrodos para detectar señales […]
Sistema de transferencia de energía transcutánea con bobinas secundarias múltiples, del 15 de Mayo de 2019, de ABIOMED, INC: Sistema de transferencia de energía transcutánea, que comprende: una serie de bobinas secundarias , que comprenden una primera bobina secundaria […]
Desfibrilador externo, del 27 de Marzo de 2019, de Element Science, Inc: Un desfibrilador externo portátil, que comprende: uno o más electrodos sensores, configurados para interactuar con la piel de un/a paciente para detectar una señal cardiaca; […]