Método de estabilizar proteínas.
Un método para preparar una solución a granel estable de una proteína monomérica,
donde la proteína es interferón, comprendiendo dicho método las etapas de:
a) proporcionar un volumen de proteína monomérica en una solución reguladora, y
b) agregar un excipiente a dicho volumen, donde dicho excipiente se selecciona del grupo que consiste en:
i) un agente bacteriostático,
ii) un tensioactivo,
iii) un agente de isotonicidad,
iv) un aminoácido,
v) un antioxidante,
vi) un agente de isotonicidad y un antioxidante,
vii) un agente de isotonicidad, un antioxidante y un aminoácido,
viii) un aminoácido y un antioxidante,
ix) un aminoácido, un antioxidante y un tensioactivo,
x) un agente bacteriostático y un antioxidante, y
xi) un agente bacteriostático, un antioxidante y un tensioactivo y que comprende además una etapa de incubación de dicha proteína a granel a una temperatura comprendida en el intervalo de 27ºC a 31ºC durante 3 a 40 horas.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/052413.
Solicitante: ARES TRADING S.A..
Nacionalidad solicitante: Suiza.
Dirección: ZONE INDUSTRIELLE DE L'OURIETTAZ 1170 AUBONNE SUIZA.
Inventor/es: JABER,Amer.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/21 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Interferones.
- A61K47/00 A61K […] › Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo.
- A61K9/19 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › liofilizados.
- C07K14/555 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Interferones (IFN).
PDF original: ES-2381674_T3.pdf
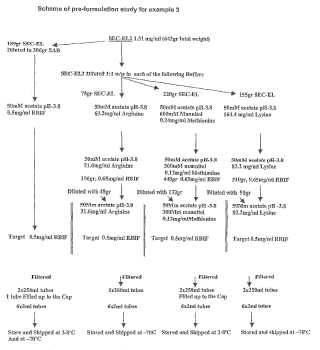
Fragmento de la descripción:
Método de estabilizar proteínas
CAMPO DE LA INVENCIÓN
La invención se refiere de forma general a un procedimiento para preparar una solución estable a granel de una proteína monomérica mediante el proporcionamiento de un volumen de proteína monomérica en una solución amortiguadora y mediante la adición de excipiente (s) específico (s) a la solución a granel.
ANTECEDENTES DE LA INVENCIÓN
Los interferones son citocinas, es decir, proteínas solubles que transmiten mensajes entre las células y tienen un papel esencial en el sistema inmune promoviendo la destrucción de los microorganismos que causan infecciones y la reparación de cualquier daño resultante. Los interferones son secretados de forma natural por las células y se identificaron por primera vez en 1957. Su nombre deriva del hecho de que "interfieren" en la réplica y producción viral.
Los interferones muestran tanto actividad antiviral como antiproliferativa. En función de sus propiedades bioquímicas e inmunológicas, los interferones humanos producidos de forma natural se agrupan en tres clases fundamentales: interferón alfa (leucocito) , interferón beta (fibroblasto) e interferón gama (inmune) . El interferón alfa se encuentra actualmente aprobado en los Estados Unidos y otros países para el tratamiento de la tricoleucemia, verrugas venéreas, sarcoma de Kaposi (un tipo de cáncer que comúnmente afecta a pacientes que padecen el Síndrome de Inmunodeficiencia Adquirida (SIDA) ) y la hepatitis crónica que no es A, ni B.
Asimismo, los interferones (IFN) son glicoproteínas producidas por el cuerpo en respuesta a la infección viral. Estos inhiben la multiplicación de virus en las células protegidas. Los IFN, los cuales consisten en una proteína de bajo peso molecular, son extraordinariamente inespecíficos en su acción, es decir, el IFN inducido por un virus es eficaz contra un amplio rango de otros virus. Sin embargo, son específicos para cada especie, es decir, el IFN producido por una especie únicamente estimulará la actividad antiviral en las células de la misma especie o de especies estrechamente relacionadas. Los IFN fueron el primer grupo de citocinas en ser explotado por sus potenciales actividades antitumorales y antivirales.
Los tres IFN fundamentales se denominan IFN alfa, IFN beta e IFN gama. Tales tipos principales de IFN se clasificaron inicialmente de acuerdo con sus células de origen (leucocito, fibroblasto o célula T) . No obstante, ha quedado claro que una célula puede producir varios tipos. Por lo tanto, los IFN de leucocitos actualmente se llaman IFN alfa, los IFN de fibroblastos son IFN beta y los IFN de células T son IFN gama. Existe asimismo un cuarto tipo de IFN, el IFN linfoblastoide, producido en la línea celular "Namalwa" (derivada del linfoma de Burkitt) , que parece producir una mezcla de IFN de leucocitos y fibroblastos.
La unidad de interferón o la unidad internacional para el interferón (U o IU, para la unidad internacional) se presentó como la medición de la actividad de IFN definida como la cantidad necesaria para proteger un 50% de las células del daño viral. El ensayo que puede utilizarse para medir la bioactividad es el ensayo de la inhibición del efecto citopático como se describe en (Rubinstein, et al. 1981; Familletti, P. C., et al., 1981) . En este ensayo de actividad antiviral para el interferón aproximadamente 1 unidad/ml de interferón es la cantidad necesaria para producir un efecto citopático del 50%. Las unidades se determinan con respecto al estándar internacional de referencia para el Hu-IFNbeta proporcionado por el organismo National Institute of Health (Pestka, S. 1986) .
Todas las clases de IFN contienen varios tipos diferentes. El IFN beta y el IFN gama son cada uno el producto de un único gen.
Las proteínas clasificadas como IFN alfa constituyen el grupo más diverso que contiene aproximadamente 15 tipos. Existe un agrupamiento de genes de IFN alfa en el cromosoma 9, que contiene al menos 23 miembros, de los cuales 15 son activos y transcriptos. Los IFN alfa maduros no son glicosilados.
Los IFN alfa e IFN beta tienen todos la misma longitud (165 o 166 aminoácidos) con actividades biológicas similares. Los IFN gamma tienen 146 aminoácidos en longitud y se parecen menos a las clases alfa y beta. Únicamente los IFN gama pueden activar los macrófagos o inducir la maduración de las linfocitos T citotóxicos. Estos nuevos tipos de agentes terapéuticos a veces se denominan modificadores de la respuesta biológica (BRM) , debido a que tienen un efecto sobre la respuesta del organismo al tumor, lo que afecta el reconocimiento mediante inmunomodulación.
El interferón de fibroblasto humano (IFN beta) presenta actividad antiviral y puede además estimular las linfocitos citotóxicos naturales contra las células neoplásicas. Es un polipéptido de aproximadamente 20.000 Da inducido por virus y ARN bicatenario. A partir de la secuencia de nucleótidos del gen para el interferón de fibroblasto, clonado mediante tecnología de ADN recombinante (Der y nk et al. 1980) , se dedujo la secuencia de aminoácidos completa de la proteína. Tiene una longitud de 166 aminoácidos.
Shepard et al. (1981) describió una mutación en la base 842 (Cys
Tyr en la posición 141) que suprimía su actividad antiviral y una variante de clon con una supresión de nucleótidos 1119-1121.
Mark et al. (1984) insertó una mutación artificial mediante el reemplazo de la base 469 (T) con (A) lo que provocó que los aminoácidos se desviaran de Cys
Ser en la posición 17. Se informó que el IFN beta resultante era tan activo como el IFN beta ‘nativo' y estable durante el almacenamiento a largo plazo (-70 ºC) .
Rebif® (interferón beta recombinante humano de Serono) , el último desarrollo en la terapia de interferón para la esclerosis múltiple (EM) , es interferón (IFN) beta 1a, producido a partir de líneas celulares de mamíferos. Se recomienda el Nombre Internacional No patentado (INN) "Interferón beta 1a".
Como con todos los productos farmacéuticos a base de proteínas, un enorme obstáculo que debe superarse en el uso de IFN beta como agente terapéutico es la pérdida de utilidad farmacéutica que puede resultar de su inestabilidad en las formulaciones farmacéuticas.
Las inestabilidades físicas que amenazan la actividad de los polipéptidos y la eficacia en las formulaciones farmacéuticas incluyen la desnaturalización y la formación de agregados solubles e insolubles, mientras que las inestabilidades químicas incluyen la hidrólisis, la formación de imidas, la oxidación, racemización y desaminación. Se sabe que algunos de estos cambios provocan la pérdida o reducción de la actividad farmacéutica de la proteína de interés. En otros casos, los efectos precisos de estos cambios son desconocidos, pero los productos degradativos resultantes aún se consideran farmacéuticamente inaceptables debido a la posibilidad de efectos secundarios indeseables.
La estabilización de los polipéptidos en las composiciones farmacéuticas continúa siendo un área en la cual el ensayo y error tiene un papel fundamental (reseñado por Wang (1999) Int. J. Pharm. 185:129-188; Wang y Hanson (1988) J. Parenteral Sci. Tech. 42:S3-S26) . Los excipientes que se agregan a las formulaciones farmacéuticas de polipéptidos para aumentar su estabilidad incluyen azúcares, tensioactivos, aminoácidos, polietilenglicoles y polímeros, pero los efectos estabilizadores de estos aditivos químicos varían en función de la proteína.
Las formulaciones de proteínas actuales emplean el uso de excipientes para las preparaciones finales de proteínas. No obstante, estas formulaciones permanecen parcialmente inestables. Además, las proteínas que son biológicamente activas como monómeros, es decir, proteínas monoméricas, tienen una tendencia a polimerizarse y aglomerarse cuando se estresan (por ejemplo, estrés ante la temperatura) .
Por consiguiente, existe la necesidad de un procedimiento que mejore la solubilidad de las proteínas y que mejore la estabilidad de las proteínas monoméricas particularmente respecto a la agregación y oligomerización para de ese modo mejorar su utilidad farmacéutica.
SUMARIO DE LA INVENCIÓN
En un primer aspecto, la invención proporciona un método para preparar una solución a granel estable de una pro
teína monomérica, donde... [Seguir leyendo]
Reivindicaciones:
1) Un método para preparar una solución a granel estable de una proteína monomérica, donde la proteína es interferón, comprendiendo dicho método las etapas de:
a) proporcionar un volumen de proteína monomérica en una solución reguladora, y b) agregar un excipiente a dicho volumen, donde dicho excipiente se selecciona del grupo que consiste en:
i) un agente bacteriostático, ii) un tensioactivo, iii) un agente de isotonicidad, iv) un aminoácido, v) un antioxidante, vi) un agente de isotonicidad y un antioxidante, vii) un agente de isotonicidad, un antioxidante y un aminoácido, viii) un aminoácido y un antioxidante, ix) un aminoácido, un antioxidante y un tensioactivo, x) un agente bacteriostático y un antioxidante, y xi) un agente bacteriostático, un antioxidante y un tensioactivo y que comprende además una etapa de incubación de dicha proteína a granel a una temperatura comprendida en el intervalo de 27ºC a 31ºC durante 3 a 40 horas.
2) El método de la reivindicación 1, en el que el interferón es IFN beta.
3) El método de la reivindicación 1, en el que el interferón IFN beta es interferón IFN beta recombinante humano.
4) El método de la reivindicación 1, en el que el agente bacteriostático es alcohol bencílico.
5) El método de la reivindicación 1, en el que el tensioactivo es Tween 20.
6) El método de la reivindicación 1, en el que el agente de isotonicidad es manitol.
7) El método de la reivindicación 1, en el que el aminoácido es lisina o arginina.
8) El método de la reivindicación 1, en el que el antioxidante es metionina.
9) El método de la reivindicación 1, en el que el agente de isotonicidad es manitol y el antioxidante es metionina.
10) El método de la reivindicación 1, en el que el agente de isotonicidad es manitol, el antioxidante es metionina y el aminoácido es lisina.
11) El método de la reivindicación 1, en el que el aminoácido es lisina y el antioxidante es metionina.
12) El método de la reivindicación 1, en el que el aminoácido es lisina, el antioxidante es metionina y el tensioactivo es Tween 20.
13) El método de la reivindicación 1, en el que el agente bacteriostático es alcohol bencílico y el antioxidante es metionina.
14) El método de la reivindicación 1, en el que el agente bacteriostático es alcohol bencílico, el antioxidante es metionina y el tensioactivo es Tween 20.
15) El método de la reivindicación 1, en el que dicha incubación se lleva a cabo antes o después de la etapa de pre-formulación de la reivindicación 1.
16) El método de la reivindicación 1, en el que dicha incubación se lleva a cabo durante 10, 16, 18, 5 o 24 horas.
17) El método de cualquiera de las reivindicaciones anteriores, en el que dicho IFN se mantiene a un intervalo de pH de 3, 0 a 6, 0.
18) El método de cualquiera de las reivindicaciones anteriores, en el que dicho IFN se encuentra presente a una concentración de 10 μg/ml a 2000 μg/ml.
19) El método de cualquiera de las reivindicaciones anteriores, en el que dicha solución reguladora se encuentra a una concentración de 5mM a 500mM.
20) El método de cualquiera de las reivindicaciones anteriores, en el que dicho agente de isotonicidad se encuentra presente a una concentración de 0, 5 mg/ml a 500 mg/ml.
21) El método de cualquiera de las reivindicaciones anteriores, en el que dicho agente de isotonicidad se encuentra presente a una concentración de 55mg/ml o 150mM o 300mM o 600mM.
22) El método de cualquiera de las reivindicaciones anteriores, en el que dicho Tween 20 se encuentra presente a una concentración de 0, 01 mg/ml a 10 mg/ml.
23) El método de cualquiera de las reivindicaciones anteriores, en el que dicho antioxidante se encuentra presente a una concentración de 0, 01 mg/ml a 5, 0 mg/ml.
24) El método de cualquiera de las reivindicaciones anteriores, en el que dicho aminoácido se encuentra presente a una concentración de 20mg/ml a 200 mg/ml.
25) El método de cualquiera de las reivindicaciones anteriores, en el que dicha lisina se encuentra presente a una concentración de 27 mg/ml o 55 mg/ml o 82 mg/ml o 164 mg/ml.
26) El método de cualquiera de las reivindicaciones anteriores, en el que dicha arginina se encuentra presente a una concentración de 32 mg/ml o 63 mg/ml.
27) El método de cualquiera de las reivindicaciones anteriores, en el que dicho agente bacterioestático se encuentra presente a una concentración de 0, 01 mg/ml a 200 mg/ml.
28) Un método para aumentar y/o mantener la estabilidad de una proteína monomérica, donde la proteína es interferón, que comprende el método de pre-formulación del volumen de dicha proteína de cualquiera de las reivindicaciones 1 a 27.
Patentes similares o relacionadas:
Moléculas de fusión anticuerpos-mutante de interferón modificadas, del 6 de Mayo de 2020, de ImmunGene, Inc: Una molécula de fusión genéticamente modificada que comprende un anticuerpo antígeno asociado a tumor (AAT) (Ab) unido a una molécula mutante de interferón alfa (IFN-α), […]
Politerapia para el tratamiento de infecciones por VHB, del 25 de Marzo de 2020, de Novira Therapeutics Inc: rn inhibidor del ensamblaje de la cápside y peginterferón alfa-2a, siendo el inhibidor del ensamblaje de la cápside un compuesto de fórmula IVc: **(Ver fórmula)** o […]
Métodos y composiciones para suministrar agentes activos con propiedades farmacológicas potenciadas, del 11 de Marzo de 2020, de DUKE UNIVERSITY: Una formulación farmacéutica que comprende una cantidad efectiva de un agente terapéutico conjugado con un péptido similar a la elastina (ELP), […]
Productos conjugados de proteína-polímero, del 12 de Febrero de 2020, de PharmaEssentia Corporation: Un producto conjugado para su uso en el tratamiento de la mielofibrosis idiopática, policitemia vera o trombocitemia esencial, que tiene la fórmula **(Ver fórmula)** […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Procedimientos de tratamiento o prevención de enfermedades neurológicas, del 6 de Noviembre de 2019, de Mesoblast, Inc: Una población de células enriquecida con células multipotentes STRO-1+, TNAP+ para su uso en el tratamiento o prevención de una enfermedad neurológica inflamatoria, […]
Heterodímero proteínico y uso del mismo, del 18 de Septiembre de 2019, de Dingfu Biotarget Co., Ltd: Complejo proteínico, que comprende una cadena pesada y una cadena ligera de un anticuerpo específico para un antígeno tumoral; y una […]
Fusocinas que implican citocinas con afinidades de unión al receptor fuertemente reducidas, del 11 de Septiembre de 2019, de VIB VZW: Una composición que comprende una proteína de fusión que comprende al menos dos citocinas, donde las citocinas son XCL1 e IFNα2, y donde IFNα2 comprende […]