PROTEINA MORFOGENETICA DE HUESO-2 (BMP-2) CON UN DOMINIO DE UNION ESPECIFICO A COLAGENO TIPO I, PROCEDIMIENTO DE OBTENCION Y APLICACIONES.
Proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I,
procedimiento de obtención y aplicaciones.La presente invención comprende la producción y aplicación de una proteína de fusión que consiste en una rhBMP-2 modificada para unirse específicamente a colágeno con un dominio de unión a colágeno derivado del factor de von Willebrand. La proteína de fusión resultante (rhBMP-2 - CBD) presenta mayor afinidad por el colágeno, siendo esa unión muy estable en el tiempo, y reteniendo la actividad osteoinductiva, siendo capaz se inducir la formación de hueso nuevo incluso a concentraciones por debajo de las conocidas para la rhBMP-2 nativa. Además, en combinación con un transportador colagénico libre de ningún otro factor de crecimiento, como una esponja absorbible de colágeno, bajas concentraciones de rhBMP-2 - CBD son capaces de inducir la formación de hueso nuevo cuando es implantada in vivo
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200900050.
Solicitante: UNIVERSIDAD DE MALAGA
FUNDACION PROGRESO Y SALUD
CIBER-BBN.
Nacionalidad solicitante: España.
Provincia: MALAGA.
Inventor/es: BECERRA RATIA,JOSE, CIFUENTES RUEDA,MANUEL, ARRABAL GARCIA,PILAR MARIA, VISSER,RICK.
Fecha de Solicitud: 31 de Diciembre de 2008.
Fecha de Publicación: .
Fecha de Concesión: 31 de Mayo de 2011.
Clasificación Internacional de Patentes:
- C07K14/51 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Factor morfogénico óseo; Osteogenina; Factor osteogénico; Factor óseoinductor.
Clasificación PCT:
- A61L27/22 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Polipéptidos o sus derivados.
- A61L27/24 A61L 27/00 […] › Colágeno.
- A61L27/32 A61L 27/00 […] › Materiales que contienen fósforo, p. ej. apatito.
- C07K14/51 C07K 14/00 […] › Factor morfogénico óseo; Osteogenina; Factor osteogénico; Factor óseoinductor.
PDF original: ES-2342707_B1.pdf
Fragmento de la descripción:
Proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I, procedimiento de obtención y aplicaciones.
Sector de la técnica
La presente invención se enmarca dentro de áreas de conocimiento tales como la biología, la biotecnología, la ciencia de materiales, la farmacología, la medicina, la ingeniería o la nanotecnología entre otras. Sus aplicaciones van destinadas fundamentalmente a los sectores de la salud y la biomedicina, pudiéndose emplear en la mejora de tratamientos y terapias en medicina regenerativa de tejidos óseos.
Estado de la técnica
Las proteínas morfogenéticas óseas (BMPs) son una familia de factores de crecimientos implicados en gran variedad de funciones durante el desarrollo y en la regeneración tisular [1]. Además del papel tan importante que ejercen en procesos no relacionados con el desarrollo óseo, las BMPs ejercen funciones únicas durante el desarrollo y regeneración del sistema esquelético [2], presentando algunas de ellas la capacidad exclusiva de inducir la formación de hueso ectópico cuando son implantadas en vertebrados adultos [3,4].
La reparación de defectos óseos y fracturas es uno de los mayores problemas clínicos y económicos en la sociedad actual, realizándose anualmente más de 3 millones de injertos óseos. A pesar de las buenas propiedades de los autoinjertos [5], la alta morbilidad asociada a esta; aproximación y la cantidad limitada de material que se puede obtener de cada donante, han propiciado el desarrollo de nuevos productos para la reparación del tejido óseo dañado o perdido [6-10].
Las BMPs recombinantes deben ser utilizadas en combinación con un material transportador para favorecer su retención en el lugar del implante [11,12], lo que además permite que la liberación de la proteína al medio extracelular sea más lenta. Dos de los transportadores más utilizados en la actualidad son la matriz ósea desmineralizada (DBM) y el colágeno. La DBM presenta buenas propiedades para la retención y liberación de las BMPs [13]. De hecho, la DBM, por sí sola, tiene la capacidad de inducir la formación de hueso ectópico debido a la gran cantidad y variedad de factores de crecimiento que retiene tras la desmineralización [14, 15, 16], los efectos biológicos observados no pueden ser atribuidos únicamente a la proteína de fusión; además, otros estudio sugieren que la DBM contiene proteínas que pueden bloquear parcialmente la actividad de las BMPs [17]. Por otro lado, los efectos locales de los implantes de DBM son impredecibles, pudiendo incluso ser rechazados tras un periodo de tiempo, como ocurre frecuentemente con los aloinjertos cuando se usan en las cirugías óseas.
Por el contrario, el colágeno es considerado en la actualidad como uno de los mejores materiales osteoconductores, dada su versatilidad, alta biocompatibilidad y baja inmunogenicidad. El primer producto aprobado por la FDA compuesto por una BMP recombinante humana (rhBMP) para el tratamiento de fusiones espinales y fracturas tibiales abiertas, consiste en una combinación de esponja absorbible de colágeno (ACS), como matriz transportadora, y rhBMP-2 (INFUSE®, Medtronic, Minneapolis, MN, USA) o OP-1. Dado que la rhBMP-2 presenta baja afinidad natural por el colágeno, esta aproximación requiere el uso de altas dosis (miligramos) de BMPs [18, 19], lo cual no sólo puede tener efectos adversos colaterales, sino que eleva muchísimo el coste de estos tratamientos [20, 21].
Gracias a la tecnología de ADN recombinante, se han modificado muchas proteínas de interés terapéutico, con el fin de favorecer su unión a diversos biomateriales [22-24] y reducir la pérdida de moléculas efectivas, ya sea por difusión o por degradación enzimática, manteniéndolas en el lugar de aplicación a la concentración farmacológica adecuada. Una de estas modificaciones consiste en la producción de una proteína de fusión constituida por el factor de crecimiento de interés y un dominio de unión a colágeno procedente del factor de von Willebrand (vWF). Se ha demostrado que esta aproximación aumenta de manera efectiva la capacidad de unión de algunas proteínas a colágeno [25-29].
A pesar de que la producción de una rhBMP-2 modificada para favorecer su unión a colágeno ya ha sido abordada por otros autores [34, 35], todas esas proteínas han sido producidas con dominios adicionales para su purificación, y sus propiedades osteoinductoras sólo han sido demostradas en combinación con DBM. En particular, y en relación a secuencias adicionales que faciliten la purificación de proteínas, dichos dominios pueden inducir el desplegamiento de las proteínas a los que son añadidos, la pérdida de actividad de la proteína, y imposibilitar el uso de requerimientos para su aplicación terapéutica [37]. En particular, un dominio de histidinas (His-tag) puede alterar las características de unión de las proteínas recombinantes que lo incorporan [38, 39].
Descripción detallada de la invención
La BMP-2 es uno de los factores de crecimientos osteoinductores más potentes y además, ejerce múltiples funciones en otros muchos tejidos distintos al hueso. Por otro lado, el colágeno es la proteína más abundante de la matriz extracelular animal y es el único material osteoconductor que ha sido autorizado para su uso clínico, en combinación con BMP-2, para la reparación ósea. Dada su baja afinidad por el colágeno, la BMP-2 debe ser utilizada a concentraciones muy por encima de los niveles fisiológicos, lo cual puede tener efectos adversos colaterales, como la reabsorción por parte de osteoclastos [20] o dar lugar a una osificación poco homogénea, lo cual tiene como consecuencia la pérdida de fuerza mecánica [21]. Una aproximación efectiva para aumentar y limitar la concentración local de proteína al lugar del implante, es aumentar la capacidad específica de unión de la BMP-2 al colágeno. En este sentido, algunos factores de crecimiento han sido ya modificados con dominios adicionales a unión al colágeno derivados del factor de von Willebrand [26, 28, 29, 33, 34], de colagenasa [22, 35], o de fibronectina [23, 36].
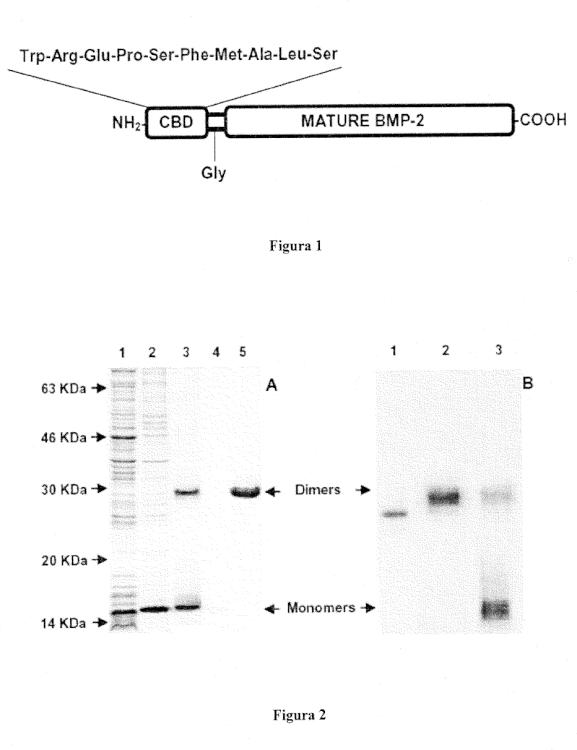
La presente invención comprende la producción y aplicación de una proteína de fusión que consiste en una rhBMP-2 modificada para unirse específicamente a colágeno, con el fin de mejorar la reparación y formación de hueso. La proteína rhBMP-2 modificada comprendida en la presente invención ha sido modificada únicamente con un dominio de unión a colágeno, derivado del factor de von Willebrand. Para evitar errores en la formación de puentes disulfuro durante el proceso de replegamiento in vitro, la Cys-7 que se encuentra en la secuencia original del decapéptido ha sido reemplazada por una metionina [26]. No se han añadido secuencias de purificación con el fin de evitar cualquier posible alteración en el factor de crecimiento como los ya comentado en el estado de la técnica [37, 38, 39].
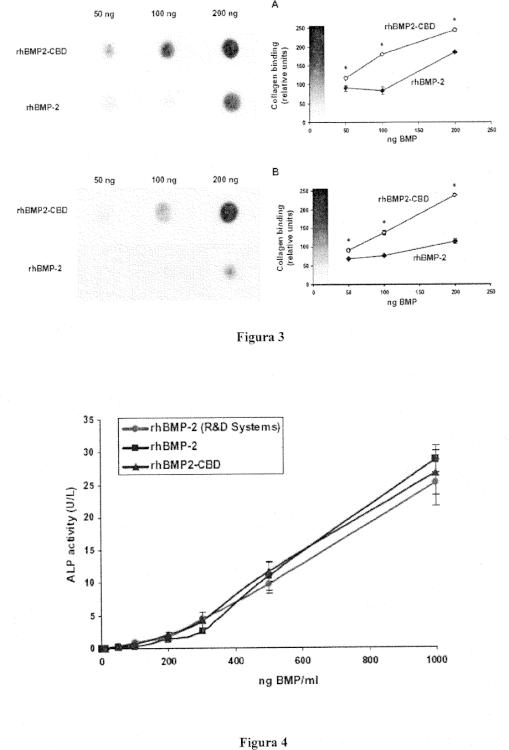
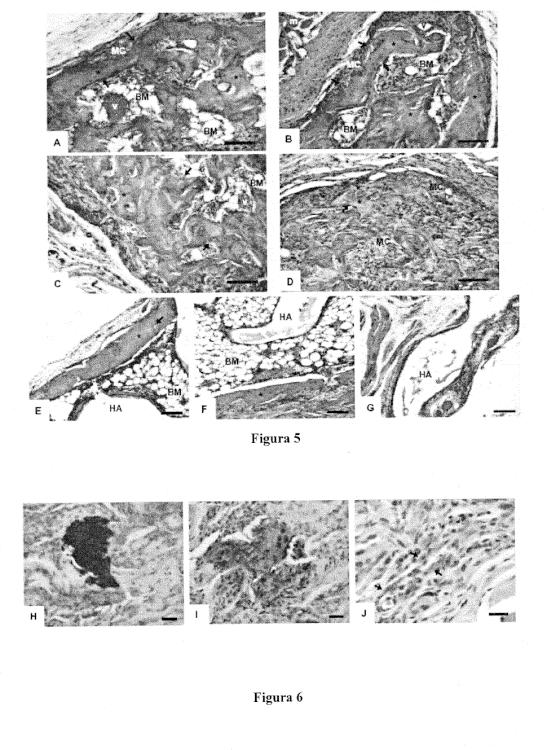
Los resultados obtenidos evidencian que la proteína de fusión rhBMP-2-CBD presenta mayor afinidad por el colágeno, y demuestran que esa unión es muy estable durante un largo periodo de tiempo y retiene la actividad osteoinductiva, siendo capaz se inducir la formación de hueso nuevo incluso a concentraciones por debajo de las conocidas para la rhBMP-2 nativa. Además, en combinación con un transportador colagénico libre de ningún otro factor de crecimiento, como una esponja absorbible de colágeno, material aprobado por la FDA para su uso clínico en la inducción de hueso ectópico, bajas concentraciones de rhBMP-2-CBD son capaces de inducir la formación de hueso nuevo cuando es implantada in vivo.
Por todo ello, la presente invención supone una alternativa mejor y más segura al uso de rhBMP-2 nativa en su aplicación en medicina regenerativa de tejido óseo. De este modo, la proteína de fusión objeto de la misma (rhBMP-2-CBD) sería una buena candidata para su uso clínico, dado que podría utilizarse a menor concentración ya que permanecería retenida en el lugar de aplicación de manera más eficiente, y no sólo induce la formación de más hueso sino que este hueso es más maduro, según la cantidad y tamaño de las trabéculas, cavidades medulares y vasos sanguíneos observados; además, permite la producción de hueso nuevo utilizando concentraciones de proteína por debajo de la menor concentración osteoinductiva (460 ng) establecida por Wang y col. [9]. Por último, la formación de hueso nuevo, con osteocitos embebidos en una matriz mineralizada compacta, muestra que la rhBMP-2-CBD mantiene la capacidad osteoinductora... [Seguir leyendo]
Reivindicaciones:
1. Proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I caracterizada porque dicha proteína ha sido modificada únicamente con un dominio de unión a colágeno, derivado del factor de von Willebrand, que consiste en un decapéptido en el que la Cys-7 que se encuentra en la secuencia original del mismo ha sido reemplazada por una metionina, y no comprende ninguna secuencia adicional que facilite su purificación.
2. Proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según la reivindicación anterior caracterizada porque presenta mayor afinidad por el colágeno que la proteína rhBMP-2 nativa, porque su unión a colágeno es estable en el tiempo, y porque retiene la actividad osteoinductiva.
3. Proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según la reivindicación anterior caracterizada porque es capaz de inducir la formación de hueso nuevo a concentraciones por debajo de las conocidas para la proteína rhBMP-2 nativa, y porque no sólo induce la formación de más hueso que la rhBMP-2 nativa sino que este hueso es más maduro.
4. Método de obtención de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I conforme a cualquiera de las reivindicaciones anteriores caracterizado porque comprende las siguientes etapas:
a. Extracción de ARN total a partir de células que secreten BMPs;
b. Amplificación mediante RT-PCT usando los oligonucleótidos específicos 5'-TTTCTAGATGGACGCTCTTT CAATGGACG-3' y 5'-TTGGTACCCTAGCGACACCCACAACCCTCC-3' (sentido y antisentido, respectivamente);
c. Clonación del ADNc obtenido en un vector de expresión, transformación de E. coli, y selección de clones;
d. Amplificación de la secuencia que codifica para el dominio maduro de la BMP-2, a la cual se añade la secuencia del CBD en el extremo amino, a partir de los clones seleccionados usando los oligonucleótidos específicos 5'-TTCATATGTGGCGCGAACCGAGCTTCATGGCTCTGAGCGGTGCAAGCCAAACACAAACAGC-3' y 5'-AGAATTCCTGTACTAGCGACACCCAC-3' (sentido y antisentido, respectivamente);
e. Clonación del producto resultante en un vector de expresión, y expresión de la proteína rhBMP-2-CBD en E. coli;
f. Aislamiento y solubilización de los cuerpos de inclusión, y replegamiento de las proteínas rhBMP-2-CBD;
g. Purificación de rhBMP-2-CBD mediante cromatografía de afinidad por heparina.
5. Método de obtención de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según la reivindicación anterior caracterizado porque rhBMP-2-CBD es clonada en un vector de expresión inducible por IPTG.
6. Método de obtención de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según cualquiera de las reivindicaciones 4 ó 5 caracterizado porque las E. coli transformadas con rhBMP-2-CBD clonada en un vector de expresión son E. coli Rosetta (DE3).
7. Método de obtención de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según cualquiera de las reivindicaciones 4 a 6 caracterizado porque el aislamiento de los cuerpos de inclusión comprende varios lavados en presencia de Tritón X-100, y porque la solubilización de las proteínas contenidas en los cuerpos de inclusión comprende el uso de guanidinio hidrocloruro (Gnd-HCl).
8. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I conforme a cualquiera de las reivindicaciones 1 a 3 caracterizado porque dicha proteína se combina con un transportador colagénico libre de ningún otro factor de crecimiento apto para uso clínico.
9. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según la reivindicación anterior caracterizado porque el transportador colagénico es una esponja absorbible de colágeno.
10. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según cualquiera de las reivindicaciones 8 ó 9 para la preparación de un producto farmacéutico de aplicación en medicina regenerativa de tejido óseo.
11. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I conforme a cualquiera de las reivindicaciones 1 a 3 caracterizado porque dicha proteína se combina con un material osteoconductor distinto al colágeno.
12. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según la reivindicación anterior caracterizado porque el material osteoconductor distinto al colágeno es hidroxiapatita.
13. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I conforme a cualquiera de las reivindicaciones 11 ó 12 para la preparación de un producto farmacéutico de aplicación en medicina regenerativa de tejido óseo.
14. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I obtenida conforme a cualquiera de las reivindicaciones 4 a 7 caracterizado porque dicha proteína se combina con un transportador colagénico libre de ningún otro factor de crecimiento apto para uso clínico.
15. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según la reivindicación anterior caracterizado porque el transportador colagénico es una esponja absorbible de colágeno.
16. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según cualquiera de las reivindicaciones 14 ó 15 para la preparación de un producto farmacéutico de aplicación en medicina regenerativa de tejido óseo.
17. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I obtenida conforme a cualquiera de las reivindicaciones 4 a 7 caracterizado porque dicha proteína se combina con un material osteoconductor distinto al colágeno.
18. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según la reivindicación anterior caracterizado porque el material osteoconductor distinto al colágeno es hidroxiapatita.
19. Uso de una proteína morfogenética de hueso-2 (BMP-2) con un dominio de unión específico a colágeno tipo I según cualquiera de las reivindicaciones 17 ó 18 para la preparación de un producto farmacéutico de aplicación en medicina regenerativa de tejido óseo.
Patentes similares o relacionadas:
 Preparación de una estructura de tipo dental usando células madre, del 28 de Agosto de 2019, de Guangzhou Institutes of Biomedicine and Health, Chinese Academy of Sciences: Uso de una célula madre en la preparación de una estructura de tipo dental, en que la estructura de tipo dental se produce en un animal mamífero por medio […]
Preparación de una estructura de tipo dental usando células madre, del 28 de Agosto de 2019, de Guangzhou Institutes of Biomedicine and Health, Chinese Academy of Sciences: Uso de una célula madre en la preparación de una estructura de tipo dental, en que la estructura de tipo dental se produce en un animal mamífero por medio […]
Mutante de GDF-5 para inducir la formación de cartílago, del 10 de Abril de 2019, de Biopharm Gesellschaft zur biotechnologischen Entwicklung von Pharmaka GmbH: Proteína variante de GDF-5 humano maduro como se representa por los aminoácidos 382 - 501 de SEQ ID NO: 2 y que comprende una sustitución de aminoácido seleccionada del grupo […]
Anticuerpo de unión a esclerostina, del 8 de Noviembre de 2018, de UCB PHARMA, S.A.: Un anticuerpo de unión a esclerostina que comprende las siguientes secuencias de CDR: CDR-H1: DYIMH (SEQ ID NO: 269); CDR-H2: YINPYNDDTEYNEKFKG (SEQ […]
Proteína morfogenética ósea 3 y dispositivos osteogénicos y productos farmacéuticos que contienen la misma, del 23 de Agosto de 2017, de BBS - Bioactive Bone Substitutes Oy: Una proteína morfogenética ósea 3 aislada (BMP-3), caracterizada por que contiene la secuencia de consenso:**Fórmula**
Composiciones y métodos para incrementar la mineralización de la substancia ósea, del 14 de Junio de 2017, de UCB PHARMA, S.A.: Un anticuerpo o fragmento del mismo que se unen a una proteína codificada por el SEQ ID NO: 1.
Isoforma del péptido Nell-1, del 1 de Marzo de 2017, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Una isoforma del péptido Nell-1 (ISN-1), que es la proteína Nell-1 corta (SNell-1) y es de secuencia SEQ ID NO: 1.
Agentes de unión a esclerostina, del 22 de Febrero de 2017, de AMGEN INC.: Un método para producir un polipéptido que es una parte inmunogénica de esclerostina humana, que comprende las etapas de: a) tratar esclerostina […]
Agentes de unión a esclerostina, del 18 de Enero de 2017, de AMGEN INC.: Un polipéptido que consiste en al menos una, al menos dos, al menos tres o las cuatro secuencias de aminoácidos SEQ ID NO: 5, SEQ ID NO: 2, SEQ ID NO: 3 y SEQ ID NO: 4, en […]