COMPOSICIÓN DE INSULINA INYECTABLE DE ACCIÓN LARGA Y MÉTODOS PARA LA FABRICACIÓN Y EL USO DE LA MISMA.
Una composición que comprende micropartículas de dextrano cristalizadas e insulina para disminuir la glucosa en sangre en un mamífero mediante la inyección de una cantidad terapéuticamente eficaz de la composición al mamífero,
en la que la insulina no está encapsulada en las micropartículas y las micropartículas se forman antes de la combinación de la insulina y las micropartículas en la composición
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E04251251.
Solicitante: THE TECHNOLOGY DEVELOPMENT COMPANY LTD.
Nacionalidad solicitante: Bermuda.
Dirección: REID HOUSE, 31 CHURCH STREET HAMILTON HM FX BERMUDAS.
Inventor/es: SABETSKY,VLADIMIR.
Fecha de Publicación: .
Fecha Solicitud PCT: 4 de Marzo de 2004.
Clasificación PCT:
- A61K38/28 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Insulinas.
- A61K47/36 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Polisacáridos; Sus derivados, p. ej. gomas o resinas, almidón, alginato, dextrina, ácido hialurónico, quitosano, inulina, agar o pectina.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357719_T3.pdf

Fragmento de la descripción:
Composición de insulina inyectable de acción larga y métodos para la fabricación y el uso de la misma.
La presente invención se refiere generalmente a composiciones de insulina y específicamente a una composición de insulina inyectable que contiene insulina y micropartículas de dextrano cristalizadas.
Antecedentes de la invención
Los dextranos son polisacáridos de alto peso molecular sintetizados por algunos microorganismos o por métodos bioquímicos. El dextrano con peso molecular medio de aproximadamente 75 kDa tiene una presión osmótica coloidal similar al plasma sanguíneo, de modo que sus soluciones acuosas se usan clínicamente como extensores de plasma. Los dextranos reticulados en forma de perlas son la base del "Sephadex"® que se usa en la GPC de proteínas y de "Cytodex"® desarrollado por Pharmacia para satisfacer las necesidades especiales de un cultivo celular de microvehículo. Por ejemplo, las Patente de Estados Unidos Nº 6.395.302 y 6.303.148 (Hennink et al.) describen la unión de diversos biomateriales a partículas de dextrano reticuladas. Sin embargo, generalmente no pueden usarse perlas basadas en dextrano reticulado para la fabricación de implantes debido a su potencial toxicidad debido a la aplicación de agentes de reticulación (Blain J.F., Maghni K., Pelletier S. y Sirois P. Inflamm. Res 48 (1999): 386-392).
La Patente de Estados Unidos Nº 4.731.249 (Schroder) describe un método para producir una matriz de depósito para sustancias biológicamente activas. De acuerdo con esta patente, la matriz de depósito consiste supuestamente en micropartículas de carbohidratos, estabilizadas mediante cristalización, lo que implica el uso de enlaces no covalentes. El siguiente proceso para producir las supuestas micropartículas de carbohidratos cristalizadas se describe por Schroder. Se forma una solución de un carbohidrato polimérico y una sustancia biológicamente activa en uno o más disolventes hidrófilos. Después la mezcla del carbohidrato y la sustancia biológicamente activa se emulsiona en un medio líquido hidrófobo para formar pequeñas gotas esféricas. La emulsión se introduce después en un medio de cristalización que comprende acetona, etanol o metanol para formar esferas que tengan una matriz de carbohidratos poliméricos cristalinos reticulados de forma no covalente, incorporando dicha matriz 0,001-50% en peso de la sustancia biológicamente activa. Por lo tanto, la sustancia biológicamente activa se proporciona a la solución antes de la cristalización de las esferas. Schroder no describe la microestructura de las micropartículas realizadas por el método multietapa. El método multietapa de Schroder es complejo y usa disolventes orgánicos que son potencialmente tóxicos para células y requieren su eliminación.
Breve sumario de la invención
La invención proporciona la composición de la reivindicación 1, composiciones farmacéuticas dosificadas de la reivindicación 6, el método de la reivindicación 13 y el uso de la reivindicación 18.
Breve descripción de los dibujos
La Figura 1 es una fotografía de micropartículas de dextrano cristalizadas formadas espontáneamente en una solución acuosa al 55,0% (P/P) de dextrano con un peso molecular de 70,0 kDa.
La Figura 2A es una fotografía de una sección transversal de micropartículas de dextrano cristalizadas mostradas en la Figura 1.
La Figura 2B es una fotografía de una sección transversal de una micropartícula mostrada en la Figura 2A. Puede verse la estructura microporosa de la micropartícula.
La Figura 3 es una fotografía de agregados de micropartículas de dextrano cristalizadas.
La Figura 4 es una fotografía de una liberación lenta de las macromoléculas marcadas con fluorescencia desde el implante que incluye micropartículas de dextrano cristalizadas en tejido muscular de ratón el 14º día después de la inyección intermuscular.
La Figura 5 es una fotografía de una emulsión de una solución acuosa de PEG (en solución acuosa de dextrano (PM 500 kDa) que contiene micropartículas de dextrano cristalizadas mostradas en la Figura 1.
La Figura 6 es una fotografía de una emulsión de solución acuosa de dextrano (PM 500 kDa) que contiene micropartículas de dextrano cristalizadas mostradas en la Figura 1 en solución acuosa de PEG.
La Figura 7 es una fotografía de una inyección intramuscular de emulsión de solución de acuosa de PEG en solución acuosa de dextrano (PM 500 kDa) que contiene micropartículas de dextrano cristalizadas mostradas en la Figura 1.
La Figura 8 es una fotografía de una inyección subcutánea de emulsión de solución acuosa de PEG en una solución acuosa de dextrano (peso molecular 500 kDa) que contiene micropartículas de dextrano cristalizadas mostradas en la Figura 1.
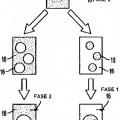
Las Figuras 9A y 9C ilustran de forma esquemática el comportamiento de reparto de diferentes tipos de partículas y fases en un sistema acuoso de dos fases.
La Figura 9B es una fotografía de una sección transversal de una estructura de un implante basándose en el sistema de dos fases.
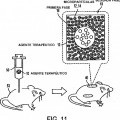
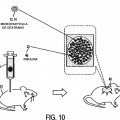
Las Figuras 10 y 11 ilustran esquemáticamente métodos de suministro de agente terapéutico de acuerdo con realizaciones de la presente invención.
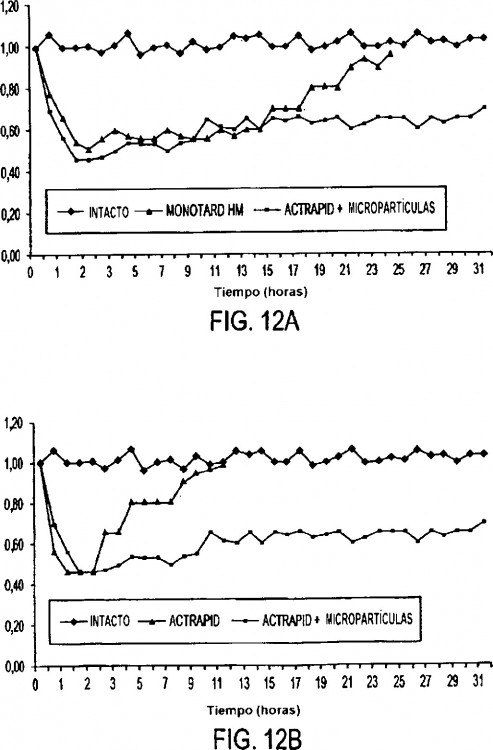
Las Figuras 12A y 12B son gráficas de normalización relativa de concentraciones de glucosa en sangre para diversas composiciones que contienen insulina frente a tiempo.
Descripción detallada de las realizaciones preferidas
El presente inventor ha descubierto que una composición de micropartículas de dextrano cristalizadas e insulina inyectada en mamíferos prolongó de manera inesperada la duración de la eficacia de la insulina en comparación con inyecciones de la misma dosis de la misma insulina por sí sola. La composición puede ser una composición de una fase o una composición multifase que forma un implante estructurado en un mamífero.
La primera sección a continuación describe las micropartículas de dextrano cristalizadas, la segunda sección describe la formación del implante estructurado desde una composición multifase y las siguientes secciones describen ejemplos específicos de inyección de la composición en mamíferos y métodos para realizar la composición inyectable.
A. Micropartículas de Dextrano Cristalizadas
El presente inventor ha descubierto experimentalmente que se formaron de forma espontánea micropartículas de dextrano cristalizadas con un diámetro medio que variaba de 0,5 a 3,5 micrómetros en soluciones acuosas concentradas de dextranos (40-65% P/P) con pesos moleculares que variaban de 1,0 a 200,0 kDa, a una temperatura que variaba de 20 a 90ºC. Si se desea formar las micropartículas a temperatura ambiente, entonces pueden usarse soluciones de dextrano de 2 a 18 kDa. Por supuesto, las micropartículas también pueden formarse con soluciones de 2 a 18 kDa a temperaturas por encima de la temperatura ambiente, si se desea. Las micropartículas pueden formarse espontáneamente a partir de soluciones de dextrano de mayor peso molecular, tales como soluciones de 20 a 75 kDa, a mayores temperaturas por encima de la temperatura ambiente, tales como de aproximadamente 40 a aproximadamente 70ºC. Las micropartículas pueden tener cualquier forma adecuada tal como una forma regular o irregular, pero preferiblemente tienen forma esférica, y preferiblemente tienen un diámetro de 10 micrómetros o menos, tal como de 0,5 a 5 micrómetros.
La microscopia electrónica de transmisión reveló la estructura microporosa de las micropartículas de dextrano cristalizadas (véanse Figuras 2A, 2B). Preferiblemente, la porosidad de las micropartículas es de al menos un 10 por ciento en volumen, tal como de aproximadamente 10 a aproximadamente 50 por ciento, más preferiblemente de aproximadamente 20 a aproximadamente 40 por ciento. Por lo tanto, la estructura comprende micropartículas microporosas con áreas de macroporosidad localizadas entre las partículas.
El secado por pulverización de suspensiones acuosas de las micropartículas de dextrano cristalizadas ha mostrado la posibilidad de producir agregados sustancialmente esféricos de micropartículas de dextrano cristalizadas con un diámetro que varía de 10,0 a 150,0 micrómetros (véase Figura 3).
Un ejemplo no limitante de un método de formación de las micropartículas dextrano es el siguiente. 50,0 g de dextrano T40 (peso molecular de 40 kDa) de Amersham... [Seguir leyendo]
Reivindicaciones:
1. Una composición que comprende micropartículas de dextrano cristalizadas e insulina para disminuir la glucosa en sangre en un mamífero mediante la inyección de una cantidad terapéuticamente eficaz de la composición al mamífero, en la que la insulina no está encapsulada en las micropartículas y las micropartículas se forman antes de la combinación de la insulina y las micropartículas en la composición.
2. La composición de la reivindicación 1, en la que la composición comprende una composición coloidal fluida y las micropartículas comprenden micropartículas de dextrano cristalizadas que tienen un diámetro medio de 0,5 a 5 micrómetros.
3. La composición de la reivindicación 2, en la que:
la composición comprende una composición de dos fases que comprende una fase de dextrano y una fase de PEG;
la insulina se reparte selectivamente en la fase de PEG y las micropartículas se reparten selectivamente en la fase de dextrano; y
la composición forma un implante estructurado que comprende un núcleo de fase de PEG y una cubierta de fase de dextrano después de su inyección en un cuerpo de mamífero.
4. La composición de la reivindicación 3, en la que el grosor de la cubierta es controlable basándose en el cuerpo del mamífero que recibe la composición para controlar la liberación de insulina desde el implante.
5. La composición de la reivindicación 1, siendo la composición para su administración a un ser humano que padece diabetes para disminuir la concentración de glucosa en sangre en el ser humano.
6. Una composición farmacéutica dosificada, que comprende micropartículas de dextrano cristalizadas y una cantidad terapéuticamente eficaz de insulina, dosificándose la composición para inyección a un ser humano y no estando encapsulada la insulina en las micropartículas y formándose la micropartículas antes de la combinación de la insulina y las micropartículas de la composición.
7. La composición farmacéutica dosificada de la reivindicación 6, en la que:
la composición comprende una composición coloidal fluida; y
las micropartículas comprenden micropartículas de dextrano cristalizadas que tienen un diámetro medio de 0,5 a 5 micrómetros.
8. La composición farmacéutica dosificada en la reivindicación 7, en la que:
la composición comprende una composición de dos fases que comprende una fase de dextrano y una fase de PEG; y
la insulina se reparte selectivamente en la fase de PEG y las micropartículas se reparten selectivamente en la fase de dextrano; y
la composición forma un implante estructurado que comprende un núcleo de fase de PEG y una cubierta de fase de dextrano después de su inyección en un cuerpo humano.
9. La composición farmacéutica dosificada de la reivindicación 6, en la que las micropartículas de dextrano cristalizadas son porosas y la insulina se localiza al menos parcialmente en los poros de las micropartículas porosas, de modo que la insulina se libera a lo largo del tiempo de los poros.
10. La composición farmacéutica dosificada de la reivindicación 9, en la que la insulina se libera de los poros en un periodo de varias horas a varios días.
11. La composición de la reivindicación 1, en la que las micropartículas de dextrano cristalizadas son porosas y la insulina se localiza al menos parcialmente en los poros de las micropartículas porosas, de modo que la insulina se libera a lo largo del tiempo de los poros.
12. La composición de la reivindicación 11, en la que la insulina se libera de los poros en un periodo de varias horas a varios días.
13. Un método para realizar una composición farmacéutica dosificada, que comprende:
proporcionar micropartículas de dextrano cristalizadas;
combinar una cantidad terapéuticamente eficaz de insulina y las micropartículas de dextrano cristalizadas en una solución después de que las micropartículas se hayan cristalizado para formar una composición de insulina y micropartículas de dextrano cristalizadas en la que la insulina no esté encapsula en las micropartículas; y
dosificar la composición para su inyección a un mamífero.
14. El método de la reivindicación 13, en el que:
la composición comprende una composición coloidal fluida; y
las micropartículas comprenden micropartículas de dextrano cristalizadas que tienen un diámetro de medio de 0,5 a 5 micrómetros.
15. El método de la reivindicación 14, en el que:
la composición comprende una composición de dos fases que comprende una fase de dextrano y una fase de PEG;
la insulina se reparte selectivamente en la fase de PEG y las micropartículas se reparten selectivamente en la fase de dextrano; y
la composición forma un implante estructurado que comprende un núcleo de fase de PEG y una cubierta de fase de dextrano después de su inyección al cuerpo del mamífero.
16. El método de la reivindicación 13, en el que las micropartículas de dextrano cristalizadas son porosas y la insulina se localiza al menos parcialmente en los poros de las micropartículas porosas, de modo que la insulina se libera a lo largo del tiempo de los poros.
17. El método de la reivindicación 16, en el que la insulina se libera de los poros en un periodo de varias horas a varios días.
18. Uso de una composición que comprende micropartículas de dextrano cristalizadas e insulina en la fabricación de un medicamento para disminuir la glucosa en sangre en un mamífero, en el que la insulina no está encapsulada en las micropartículas y las micropartículas se forman antes de la combinación de la insulina y las micropartículas en la composición.
19. El uso de la reivindicación 18, en el que la composición va a administrarse por inyección al mamífero.
20. El uso de la reivindicación 18 o reivindicación 19, en el que la composición comprende una composición coloidal fluida y las micropartículas comprenden micropartículas de dextrano cristalizadas que tienen un diámetro medio de 0,5 a 5 micrómetros.
21. El uso de la reivindicación 20, en el que:
la composición comprende una composición de dos fases que comprende una fase de dextrano y una fase de PEG;
la insulina se reparte selectivamente en la fase de PEG y las micropartículas se reparten selectivamente en la fase de dextrano; y
la composición forma un implante estructurado que comprende un núcleo de fase de PEG y una cubierta de fase de dextrano después de su inyección en un cuerpo de mamífero.
Patentes similares o relacionadas:
 CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
CD52 soluble para su uso en el tratamiento o la prevención de la esclerosis múltiple o de la artritis reumatoide, del 29 de Julio de 2020, de THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH: Uno cualquiera o más de:
i) glucoproteína CD52 soluble, ii) una proteína de fusión que comprende la glucoproteína CD52 soluble como una primera proteína, y una segunda proteína;
[…]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Terapia para la diabetes, del 13 de Mayo de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un inhibidor de DPP-4, que es linagliptina, para uso terapéutico por administración subcutánea.
Formulaciones farmacéuticas estabilizadas de análogos de insulina y/o derivados de insulina, del 29 de Abril de 2020, de SANOFI: Una formulación farmacéutica que comprende (a) al menos un análogo y/o derivado de insulina, en donde dicho análogo de insulina se selecciona del grupo que […]
Dispositivo, composición y método para el diagnóstico basado en tejidos, del 29 de Abril de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un dispositivo para licuar al menos parcialmente un tejido de un sujeto vivo, que comprende: un depósito que se configura para acoplar operativamente […]
Dispositivo tragable para la administración de fármacos, del 22 de Abril de 2020, de Rani Therapeutics, LLC: Un dispositivo ingerible para la administración de un agente terapéutico hacia el interior de una pared luminal del tubo gastrointestinal de un paciente, […]
Preparación farmacéutica que contiene insulina en forma cristalina así como también solubilizada, del 18 de Marzo de 2020, de NOVO NORDISK A/S: Una formulación farmacéutica que comprende insulina humana AspB28, protamina, Zn++, un tampón, un agente de isotonicidad, un compuesto fenólico que es una mezcla de fenol y […]