SUMINISTRO DE ELEMENTOS DE CAPTURA DE NEUTRONES PARA LA TERAPIA DE CAPTURA DE NEUTRONES.
Una nanopartícula insoluble en agua que comprende al menos un elemento de captura de neutrones en una forma inorgánica para ser usada en terapia,
cirugía o diagnosis, en que dicho elemento de captura de neutrones al menos único se selecciona entre el grupo que consiste en boro, preferentemente 10 B, comprendiendo dicha nanopartícula una capa externa biocompatible seleccionada entre polivinilpirrolidona (PVP)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2002/005927.
Solicitante: PSIMEI PHARMACEUTICALS PLC.
Nacionalidad solicitante: Reino Unido.
Dirección: 13-21 HIGH STREET GUILDFORD, SURREY GU1 3DG REINO UNIDO.
Inventor/es: PATEL,BIPIN,C. M.,PSIMEI PHARMACEUTICALS PLC.
Fecha de Publicación: .
Fecha Solicitud PCT: 24 de Diciembre de 2002.
Fecha Concesión Europea: 18 de Agosto de 2010.
Clasificación Internacional de Patentes:
- A61K41/00Z
- A61K41/00Z4
Clasificación PCT:
- A61K41/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales obtenidas por tratamiento de sustancias mediante energía ondulatoria o por radiación corpuscular.
Clasificación antigua:
- A61K41/00 A61K […] › Preparaciones medicinales obtenidas por tratamiento de sustancias mediante energía ondulatoria o por radiación corpuscular.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
La invención se refiere a la terapia de captura de neutrones y, en particular, a nuevas formas de suministrar elementos de captura de neutrones a un sitio diana deseado.
El principio teórico de la terapia de captura de neutrones (NCT) para el tratamiento del cáncer fue descrito en primer lugar en 1936 por el científico americano Locker. En esencia, cuando un isótopo estable como el boro-10 es irradiado por neutrones lentos no ionizantes, tiene lugar una reacción de fisión que conduce a la emisión de una radiación altamente ionizante con un intervalo entre 7 µm y 9 µm. Por tanto, cuando el 10B es irradiado de esta forma en el interior, por ejemplo, de una célula tumoral, el intervalo de la radiación ionizante resultante es suficiente para destruir esa célula pero no el tejido circundante. En 1951 fue tratado el primer paciente. Desde entonces, el principio ha sido satisfactoriamente demostrado en el campo clínico.
El nivel de éxito ha variado y ha sido dependiente de una combinación de la calidad de los neutrones y las propiedades farmacéuticas del portador de elementos de captura de neutrones.
La NCT es una terapia bimodal que requiere una superposición espacial y temporal de neutrones y el fármaco. Para conseguir un efecto biológico, es necesario una interacción entre neutrones lentos y, por ejemplo, un agente portador de boro. La reacción de NCT del 10B con los neutrones (BNCT) puede ser resumida mediante la siguiente ecuación.
10B + 1nth
**(Ver fórmula)**
7Li + partícula**(Ver fórmula)**
(4He) + 2,4 MeVLa energía de 2,4 MeV es tomada como energía cinética por los iones Li+ y He2+ . Las dos partículas son suficientemente energéticas para generar trazas de ionización intensas con un intervalo máximo de 9 µm. De esta forma, el deterioro queda confinado al diámetro de una célula tumoral, es decir, aproximadamente 10 µm. Por tanto, solamente las células que contienen boro son deterioradas, mientras que las células sanas que no contienen boro permanecen intactas. El isótopo boro-10 es estable y no radiactivo y su núcleo tiene una sección transversal de absorción de neutrones muy grande para neutrones lentos, 2700 veces mayor que el del hidrógeno. Esto se plasma en una capacidad de absorber neutrones comparativamente de varios millares de veces mejor que los elementos que constituyen los tejidos vivos (por ejemplo, hidrógeno, oxígeno o carbono).
La NCT puede ser usada para tratar cánceres que son normalmente tratados con radioterapia como linfomas y cánceres de piel, así como cánceres del cerebro, mamas, pulmón cráneo y cuello, huesos, próstata, páncreas y cuello uterino. Además, cuando está prevista la supresión quirúrgica de un tumor, la NCT puede ser usada también para ayudar a contraer el tamaño del tumor y reducir la pérdida asociada de tejido normal.
La NCT ha sido abordada por las ventajas potenciales de la radioterapia “in situ” selectiva y como un sustituto potencial para la radioterapia convencional de rayos
X. Más de 500 pacientes han recibido un tratamiento de BNCT experimental para tumores cerebrales y de la piel en todo el mundo hasta la fecha.
La NCT es ventajosa con respecto a la radioterapia convencional en un cierto número de aspectos. Así, en la radioterapia convencional, el efecto biológico se extiende sobre la totalidad de la zona irradiada, mientras que la NCT es específica para las células que contienen moléculas portadoras de elementos de captura de neutrones. Se requiere una dosis de radiación relativamente elevada con la radioterapia para generar las trazas de aislamiento destructoras para el efecto biológico. Esto es un factor limitante en la eficacia del tratamiento. La radioterapia está adicionalmente limitada por la naturaleza inherente del haz de radiación de baja LET (transferencia de energía lineal) que comprende electrones (partículas º) o fotones (rayos X y rayos º). Con la BNCT se generan partículas alfa º y 7Li de energía elevada y de corto intervalo. Estas partículas son partículas de LET elevada que son intensamente ionizantes y exhiben una propensión destructora mayor y más potente. Por tanto, la dosis de BNCT requerida para generar un efecto biológico de radioterapia equivalente es mucho más pequeña que la dosis de radioterapia relativa.
La radioterapia es ampliamente usada en la gestión y el tratamiento de cánceres en los que exhibe una taza de curación del 30% que se espera que aumente el 33% en 10 años, con un 70% de atenuación. Sin embargo, la radioterapia da lugar a un deterioro por radiación para el tejido normal y normalmente requiere un esquema de tratamiento de 6 semanas.
Al contrario que la radioterapia, la NCT ofrece una selectividad de tejidos dianas a través de la especifidad del fármaco. La radiación mortal solamente es generada cuando es localizado el elemento de captura de neutrones, es decir, en el tejido tumoral. Así, por ejemplo, en la BNCT, la radiación es generada en células tumorales que contienen boro y el deterioro está localizado en esas células. Esto es una ventaja clave de la NCT sobre la radioterapia para destruir potencialmente tumores que normalmente no están delimitados de forma clara, sino que son difusos.
La NCT no depende de los niveles de oxígeno en el tumor y esto es una ventaja, ya que muchos tumores son hipóxicos. Además de ello, la NCT puede ser usada también cuando está anatómicamente comprometido el tratamiento del cáncer. Los tumores asentados en profundidad pueden ser tratados como por ejemplo, a partir de 4 cm -8 cm de profundidad y más allá. Adicionalmente, la NCT es menos exigente para el paciente que la radioterapia convencional ya que puede ser proporcionada varias veces durante un período de 2-4 días. Por el contrario, la radioterapia convencional necesita ser proporcionada hasta 30 veces durante un período de seis semanas.
Una ventaja adicional de la NCT es que en este sistema binario cada componente puede ser manipulado independientemente del otro. El intervalo entre la administración, por ejemplo, del agente de 10B y la irradiación de neutrones puede ser ajustado hasta un tiempo óptimo cuando hay las mayores concentraciones diferenciales de 10B entre tejidos normales y el tejido tumoral. Análogamente, el haz de neutrones puede ser colimado de forma que el campo de irradiación se limite al sitio del tumor y puedan ser excluidos de los volúmenes de tratamiento los tejidos normales con una concentración residual de 10B.
En resumen, las ventajas de la NCT son las siguientes:
• La NCT es una terapia bimodal en la que el intervalo de tiempo entre la administración de fármaco y el tiempo de “activación del fármaco” pueden ser optimizados para alcanzar una destrucción máxima del tumor
• Dirección a diana selectiva de células tumorales y disponibilidad de tejidos normales
• Radiación generada y localizada solamente en las células con cantidad suficiente del agente portador de elementos de captura de neutrones
• Eficacia para extensión difusa y capacidad potencial para dirigir a diana células tumorales únicas distantes o metástasis
• La NCT es aplicable a tumores radio-resistentes y sitios anatómicamente comprometidos
• La NCT no depende del contenido de oxígeno de los tumores
• La NCT puede acceder por encima de 4 cm – 8 cm de profundidad del tumor, no hay eficazmente limitaciones para la profundidad de un tumor
• Tiempo de tratamiento de 2-4 días en comparación con 6 semanas
típicas para la radioterapia.
Para cosechar las ventajas potenciales de la NCT como una radioterapia celular “in situ” es preferible que:
(i) los neutrones sean de un intervalo de energía en el que solamente los átomos del elemento de captura de neutrones sean capaces de experimentar una reacción de fisión;
(ii) los átomos, por ejemplo de boro, del agente de NCT están selectivamente localizados en el tejido diana;
(iii) para la BNCT, hay una concentración óptima de fármaco de boro en el tejido diana. Por ejemplo, 15 µm – 35 µm/g de tejido tumoral (igual a 109 átomos de boro) son ampliamente citados por ser la cantidad de 10B necesaria para la BNCT, usando un haz de neutrones a partir de un reactor nuclear con una capacidad de 109 neutrones por segundo por cm2;
(iv) el fármaco del elemento de captura de neutrones debe tener una toxicidad inusualmente baja en comparación con los agentes farmacéuticos convencionales, ya que necesita ser administrada...
Reivindicaciones:
1. Una nanopartícula insoluble en agua que comprende al menos un elemento de captura de neutrones en una forma inorgánica para ser usada en terapia, cirugía o diagnosis, en que dicho elemento de captura de neutrones al menos único se selecciona entre el grupo que consiste en boro, preferentemente 10B, comprendiendo dicha nanopartícula una capa externa biocompatible seleccionada entre polivinilpirrolidona (PVP).
2. Una nanopartícula según la reivindicación 1, que tiene un tamaño de partículas de aproximadamente 10-10 a aproximadamente 10-6 m, preferentemente que tiene un tamaño de partículas de aproximadamente 10-10 m a aproximadamente 10-7 m, más preferentemente que tiene un tamaño de partículas de aproximadamente 10-9 a aproximadamente 10-8 m.
3. Una nanopartícula según la reivindicación 1 o la reivindicación 2, en que dicho elemento de captura de neutrones está en su forma cristalina natural, en una forma particular, en la forma de un vidrio o un material cerámico de vidrio, en la forma de una matriz inorgánica polimerizada o en la forma de un xerogel derivado de sol-gel.
4. Una nanopartícula según cualquiera de las reivindicaciones 1 a 3, en la que dicho elemento de captura de neutrones está en la forma de un material cerámico orgánicamente modificado y en la que el elemento comprende al menos un enlace a una cadena hidrocarbonada.
5. Una nanopartícula según la reivindicación 1, en la que dicho boro está en la forma de:
(i) 10BxMn;
(ii) 10BxHn; o
(iii) R-10Bn-On
en que M es un metal o se selecciona entre nitrógeno, carbono, oxígeno, cloro, bromo
o flúor, x y n son números enteros de uno o más y R es una cadena hidrocarbonada u
otra cadena orgánica.
6. Una nanopartícula según la reivindicación 1, en la que dicho elemento de captura de neutrones está en la forma de (X-O-X)n en la que n es un número entero de uno o más y X es el elemento de captura de neutrones.
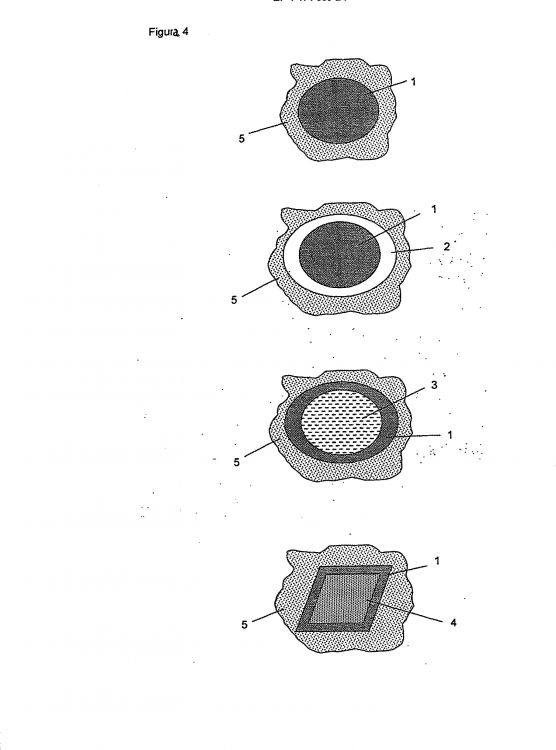
7. Una nanopartícula según cualquiera de las reivindicaciones anteriores, en la que el elemento de captura de neutrones está presente en forma de una capa o película alrededor de un núcleo de nanopartícula inorgánica.
8. Una nanopartícula según la reivindicación 7, en la que dicho núcleo se selecciona entre mica, zeolitas, esferas de TiO2, esferas o partículas de ZrO2 o partículas o esferas de polímeros orgánicos.
9. Una nanopartícula según cualquiera de las reivindicaciones anteriores, en la que dichas partículas comprenden adicionalmente una sustancia farmacológicamente activa.
10. Una nanopartícula según la reivindicación 9, en la que dicha sustancia farmacológicamente activa es introducida en dichas nanopartículas por absorción, adsorción o incorporación.
11. Una nanopartícula según la reivindicación 9 o la reivindicación 10, en la que dicha sustancia farmacológicamente activa es un agente quimioterapéutico.
12. Una nanopartícula según cualquiera de las reivindicaciones anteriores, que comprende adicionalmente un metal adicional seleccionado entre el grupo que consiste en vanadio (V), manganeso (Mn), hierro (Fe) rutenio (Ru), tecnecio (Tc), cromo (Cr), platino (Pt), cobalto (Co), níquel (Ni), cobre (Cu), zinc (Zn), germanio (Ge), indio (In), estaño (Sn), itrio (Y), oro (Au), bario (Ba), wolframio (W), y gadolinio (Gd).
13. Una nanopartícula según la reivindicación 12, en la que dicho metal adicional está presente a una concentración de aproximadamente de 0,0001% p/p a aproximadamente 0,1% p/p.
14. Una composición farmacéutica, que comprende una nanopartícula insoluble en agua, que comprende al menos un elemento de captura de neutrones en una forma inorgánica según una cualquiera de las reivindicaciones 1 a 13.
15. El uso de nanopartículas insolubles en agua que comprenden al menos un elemento de captura de neutrones en una forma inorgánica, como se define en una cualquiera de las reivindicaciones 1 a 21, en la elaboración de un medicamento para ser usado en terapia de captura de neutrones.
16. Un uso según la reivindicación 15, en el que dicha terapia de captura de neutrones es para el tratamiento o la extirpación de un cáncer u otros tejidos enfermados, por ejemplo, linfomas, cáncer de piel, cáncer de mamas, cáncer de pulmón, cáncer de cabeza y cuello, cáncer de huesos, cáncer de próstata, cáncer de páncreas, cáncer de cuello uterino, cánceres cerebrales, por ejemplo glioblastomas, metástasis primarias y secundarias y cánceres de próstata benignos y metastáticos, por ejemplo, hiperplasia de próstata benigna.
17. Un uso según la reivindicación 16, en el que dicho tumor es sólido y discreto.
18. Un uso según una cualquiera de las reivindicaciones 15 a 17, en el que dicha terapia de captura de neutrones es administrada durante un período de uno a catorce días.
19. Un procedimiento para la preparación de nanopartículas insolubles en agua, que comprenden al menos un elemento de captura de neutrones en una forma inorgánica como se reivindica en una cualquiera de las reivindicaciones 1 a 21, comprendiendo dicho procedimiento:
(i) proporcionar al menos una primera masa de dicho elemento de captura de neutrones en una forma inorgánica;
(ii) proporcionar al menos una segunda masa del mismo tipo de material;
(iii) mezclar dichas primera y segunda masas en ausencia de otro material abrasivo;
(iv) provocar una abrasión por rozamiento entre dichas primera y segunda
masas y
(v) recoger dichas nanopartículas.
20. Un procedimiento según la reivindicación 19, en el que dicho material no 5 abrasivo adicional al menos único es incluido en dicha etapa (iii) de mezcladura.
21. Un procedimiento según la reivindicación 20, en el que dicho material no abrasivo adicional se selecciona entre el grupo que consiste en vanadio (V), manganeso (Mn), hierro (Fe) rutenio (Ru), tecnecio (Tc), cromo (Cr), platino (Pt), cobalto (Co), níquel (Ni), cobre (Cu), zinc (Zn), germanio (Ge), indio (In), estaño (Sn), itrio (Y), oro (Au), bario (Ba), wolframio (W) y gadolinio (Gd).
22. Un procedimiento según una cualquiera de las reivindicaciones 19 a 21, en
el que las nanopartículas resultantes están caracterizadas por cualquiera de las 15 características de las reivindicaciones 1 a 18.
Patentes similares o relacionadas:
Composición farmacéutica basada en nanoestructura de grafeno para prevenir o tratar enfermedades neurodegenerativas, del 22 de Julio de 2020, de Seoul National University R & DB Foundation: Una composición farmacéutica para su uso en la prevención o el tratamiento de enfermedades neurodegenerativas, que comprende puntos cuánticos de grafeno como […]
Sistema para el tratamiento o la prevención por termoterapia de infecciones resistentes a antimicrobianos o por biopelículas, del 6 de Mayo de 2020, de FUNDACIÓ HOSPITAL UNIVERSITARI VALL D'HEBRON - INSTITUT DE RECERCA: Un sistema para el tratamiento por termoterapia o la prevención de infecciones resistentes a antimicrobianos o por biopelículas, comprendiendo el sistema: - […]
Soluciones hipoosmóticas para la detección de ganglios linfáticos, del 29 de Abril de 2020, de Endomagnetics Ltd: Una suspensión hipoosmótica para uso en el diagnóstico de cáncer, siendo la suspensión hipoosmótica una solución acuosa que tiene una osmolalidad de 80 […]
Formulaciones para su uso en el tratamiento de afecciones de la piel, del 1 de Abril de 2020, de Soligenix, Inc: Formulación líquida para su uso en el tratamiento tópico de una afección de la piel seleccionada del grupo que consiste en linfoma de células T cutáneo (LCTC) y psoriasis, que […]
Canalrodopsinas para el control óptico de células, del 1 de Abril de 2020, de MASSACHUSETTS INSTITUTE OF TECHNOLOGY: Polipéptido de canal iónico activado por luz aislado que comprende una secuencia de aminoácidos de un polipéptido de canal de Stigeoclonium […]
Método y dispositivo para producir micro/nano-burbujas a base de lípidos optimizadas, del 11 de Marzo de 2020, de Trust Bio-sonics Inc: Un método para producir micro/nano burbujas a base de lípidos, que comprende etapas de: preparar una mezcla lipídica que comprende […]
Método para el tratamiento del acné, del 12 de Febrero de 2020, de DUSA PHARMACEUTICALS, INC.: Un agente fotodinámico para usar en un método para tratar el acné en una persona que necesita dicho tratamiento, el método comprende: […]
VACUNACIÓN CON MICROVESÍCULAS DERIVADAS DE CÉLULAS TUMORALES PARA TRATAMIENTO DE CÁNCER, del 6 de Febrero de 2020, de PINEDA OLVERA, Benjamín: La presente invención se refiere a microvesículas provenientes de células tumorales naturales y producidas in vitro bajo un estímulo estresor, tal como la radiación, las […]