SISTEMA Y METODO PARA OXIGENAR SANGRE.
Un dispositivo para supersaturar con gas un fluido incluyendo:
un suministro de fluido (400);
una cámara (410) que tiene una primera entrada, una segunda entrada, una tercera entrada y una salida (402);
un suministro de gas (412) acoplado para distribuir gas a la primera entrada de la cámara;
un conjunto de pistón (418) acoplado para recibir fluido del suministro de fluido (400) y para distribuir el fluido a la segunda entrada y la tercera entrada de la cámara (410);
una boquilla (411) acoplada a la tercera entrada de la cámara (410), suministrando la boquilla (411) el fluido desde el conjunto de pistón (418) a la cámara (410);
una primera válvula acoplada a la salida (402) de la cámara (410), estando acoplada la primera válvula a un conjunto accionador (432) para controlar la distribución de fluido supersaturado con gas desde la cámara (410); y
una segunda válvula acoplada a la segunda entrada, estando acoplada la segunda válvula a un conjunto accionador (432) para controlar la dilución durante la creación de fluido supersaturado con gas dentro de la cámara (410)
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06022544.
Solicitante: THEROX, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2400 MICHELSON DRIVE,IRVINE, CA 92612-1310.
Inventor/es: MYRICK, STEPHEN, E., BUHR, MARK, S.
Fecha de Publicación: .
Fecha Solicitud PCT: 27 de Septiembre de 2000.
Fecha Concesión Europea: 2 de Diciembre de 2009.
Clasificación PCT:
- A61M1/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › A61M 1/00 Dispositivos de succión o de bombeo de uso médico; Dispositivos para extraer, tratar o transportar los líquidos del cuerpo; Sistemas de drenaje (catéteres A61M 25/00; conectores o acoplamientos para tubos, válvulas o conjuntos de derivación, especialmente concebidos para uso médico A61M 39/00; dispositivos para tomar muestras sanguíneas A61B 5/15; instrumentos para retirar la saliva para dentistas A61C 17/06; filtros para implantar en los vasos sanguíneos A61F 2/01). › con membranas.
- A61M25/00 A61M […] › Catéteres; Sondas huecas (para medida o examen A61B).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
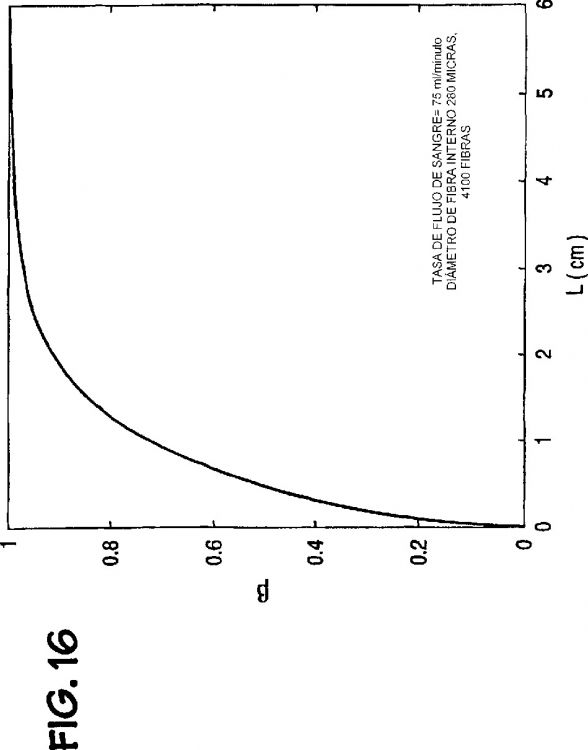
Fragmento de la descripción:
Sistema y método para oxigenar sangre.
Campo de la invención
La presente invención se refiere en general a un sistema y método para oxigenar sangre, y más en particular, a un sistema para administrar la sangre oxigenada, por ejemplo, sangre hiperoxémica o hiperbárica, a un paciente.
Antecedentes de la invención
El oxigeno es un nutriente crucial para las células humanas. El daño de las células puede deberse a carencia de oxigeno durante periodos de tiempo incluso breves, lo que puede dar lugar a disfunción o fallo de órganos. Por ejemplo, las victimas de ataque cardiaco y apoplejia experimentan obstrucciones o desviaciones del flujo sanguíneo que evitan que el oxigeno se distribuya a las células de tejidos vitales. Sin oxígeno, el corazón y el cerebro se deterioran progresivamente. En casos severos se produce muerte por fallo completo del órgano. Los casos menos severos implican típicamente hospitalización costosa, tratamientos especializados y rehabilitación prolongada.
Los niveles de oxígeno en sangre pueden ser descritos en términos de la concentración de oxígeno que se lograría en una solución saturada a una presión parcial dada de oxígeno (pO2). Típicamente, para sangre arterial, los niveles normales de oxígeno en sangre (es decir, normoxia o normoxemia) son del rango de 12-14,7 kPa (90-110 mm Hg). La sangre hipoxémica (es decir, hipoxemia) es sangre arterial con un pO2 inferior a 124 kPa (90 mm Hg). La sangre hiperóxica (es decir, hiperoxemia o hiperoxia) es sangre arterial con un pO2 superior a 534 KpA (400 mm Hg) (véase Cason y colaboradores (1992) Effects of High Arterial Oxygen Tension on Function, Blood Flow Distribution, and Metabolism in Ischemic Myocardium, Circulation, 85(2):828-38, pero inferior a 1014 KpA (760 mm Hg) (véase Shandling y colaboradores (1997) Hyperbaric Oxygen and Thrombolysis in Myocardial Infarction: The HOT MI
Pilot Study, American Heart Journal 134 (3):544-50). La sangre hiperbárica es sangre arterial con un pO2 superior a 1014 KpA (760 mm Hg). La sangre venosa tiene típicamente un pO2 inferior a 124 PA (90 mm Hg). En el adulto medio, por ejemplo, los niveles normales de oxígeno en sangre venosa son del rango general de 5 kPa (40 mm Hg) a 9 kPa (70 mm Hg).
Los niveles de oxígeno en sangre también podrían ser descritos en términos de niveles de saturación de hemoglobina. Para sangre arterial normal, la saturación de hemoglobina es aproximadamente 97% y varía solamente ligeramente a medida que aumentan los niveles de pO2. Para sangre venosa normal, la saturación de hemoglobina es aproximadamente 75%.
En pacientes que padecen infarto de miocardio agudo, si el miocardio es privado de los niveles adecuados de sangre oxigenada durante un período de tiempo prolongado, se puede producir daño irreversible del corazón. Cuando el infarto se manifiesta en un ataque al corazón, las arterias coronarias no logran proporcionar un flujo adecuado de sangre al músculo cardiaco.
El tratamiento de infarto de miocardio agudo o isquemia de miocardio a menudo incluye realizar angioplastia o implante de stents en los vasos para comprimir, cortar o tratar de otro modo la(s) oclusión(es) dentro de las paredes de vasos. Por ejemplo, una angioplastia exitosa usa un globo para aumentar el tamaño de la abertura del vaso para permitir un flujo incrementado de sangre.
Incluso con el tratamiento exitoso de vasos ocluidos, todavía puede existir un riesgo de lesión de tejido. Durante la angioplastia coronaria transluminal percutánea (PTCA), el tiempo de inflado del globo es limitado por la tolerancia del paciente a la isquemia producida por el bloqueo temporal de flujo de sangre a través de un vaso durante el inflado del globo. También se puede producir lesión por reperfusión, por ejemplo, debido a reflujo coronario lento o ausencia de reflujo posterior a la angioplastia.
Para algunos pacientes los procedimientos de angioplastia no son una opción atractiva para el tratamiento de vasos bloqueados. Tales pacientes se encuentran típicamente en un mayor riesgo de isquemia por razones tales como pobre función ventricular izquierda, tipo y posición de la lesión, o la cantidad del miocardio en riesgo. Las opciones de tratamiento para tales pacientes incluyen así procedimientos más invasivos como cirugía de bypass coronario.
Para reducir el riesgo de lesión de tejido asociado típicamente con tratamientos de infarto de miocardio agudo e isquemia de miocardio, es deseable por lo general distribuir sangre oxigenada o fluidos enriquecidos con oxígeno a tejidos en riesgo. La lesión del tejido se minimiza o evita por la difusión del oxígeno disuelto de la sangre o fluidos al tejido y/o perfusión de sangre que quita metabolitos y que proporciona otros nutrientes químicos.
En algunos casos, el tratamiento deseado de infarto de miocardio agudo e isquemia de miocardio incluye perfusión de sangre oxigenada o fluidos enriquecidos con oxígeno. Durante PTCA, por ejemplo, el tiempo tolerado de inflado del globo se puede incrementar por la introducción concurrente de sangre oxigenada a la arteria coronaria del paciente. Los niveles incrementados de oxígeno en sangre también pueden someter el tejido cardiaco ventricular izquierdo normalmente perfundido a hipercontractilidad para aumentar más el flujo de sangre a través de los vasos coronarios tratados.
La infusión de sangre oxigenada o fluidos enriquecidos con oxígeno también se puede continuar después de la terminación del tratamiento PTCA u otros procedimientos (por ejemplo cirugía) donde se ha producido aturdimiento
del tejido cardiaco con riesgo asociado de función. En algunos casos la infusión continuada puede acelerar la inversión de isquemia y facilitar la recuperación de la función del miocardio.
Los métodos convencionales para la administración de sangre oxigenada o fluidos enriquecidos con oxígeno a tejidos en riesgo implica el uso de oxigenadores de sangre. Tales procedimientos implican generalmente extraer sangre de un paciente, hacerla circular a través de un oxigenador para aumentar la concentración de oxígeno en sangre, y administrar posteriormente la sangre de nuevo al paciente. Un ejemplo de un oxigenador de sangre comercialmente disponible es el oxigenador de sangre Maxima fabricado por Medtronic, Inc., Minneapolis, Minnesota.
Sin embargo, hay inconvenientes al uso de un oxigenador convencional en un circuito extracorporal para oxigenar sangre. Tales sistemas son típicamente costosos, complejos y difíciles de operar. A menudo un perfusionista titulado tiene que preparar y supervisar el sistema.
Los sistemas oxigenadores convencionales también tienen típicamente un gran volumen de cebado, es decir, el volumen total de sangre contenido dentro del oxigenador, los tubos y otros componentes del sistema, y dispositivos asociados. No es insólito en el caso de un paciente adulto típico que el sistema de oxigenación mantenga más de uno a dos litros de sangre. Tales volúmenes grandes de cebado son indeseables por muchas razones. Por ejemplo, en algunos casos puede ser necesaria una transfusión de sangre para compensar la sangre temporalmente perdida en el sistema de oxigenación a causa de su gran volumen de cebado. A menudo se debe usar calentadores para mantener la temperatura de la sangre a un nivel aceptable cuando avanza a través del circuito extracorporal. Además, los sistemas oxigenadores convencionales son relativamente difíciles de encender y apagar. Por ejemplo, si el oxigenador se apaga, se podrían coagular grandes charcos estancados de sangre en el oxigenador.
Además, con circuitos extracorporales incluyendo oxigenadores convencionales de sangre hay un riesgo relativamente alto de reacción de inflamación de las células y coagulación de sangre debido a las tasas relativamente lentas de flujo de sangre y la gran área superficial de contacto de la sangre. Un área superficial de contacto de la sangre de aproximadamente 1-2 m2 y velocidades de aproximadamente 3 cm/s no son insólitas en los sistemas oxigenadores convencionales. Así, generalmente se requiere terapia anticoagulación relativamente agresiva, tal como heparinización, como un adjunto a usar el oxigenador.
Tal vez una de las mayores desventajas del uso de sistemas convencionales de oxigenación de la sangre es que la presión parcial máxima de oxígeno (pO2) que se puede impartir a la sangre con oxigenadores comercialmente disponibles es aproximadamente 67 kPa (500 mm Hg). Así, con los oxigenadores...
Reivindicaciones:
1. Un dispositivo para supersaturar con gas un fluido incluyendo:
un suministro de fluido (400);
una cámara (410) que tiene una primera entrada, una segunda entrada, una tercera entrada y una salida (402);
un suministro de gas (412) acoplado para distribuir gas a la primera entrada de la cámara;
un conjunto de pistón (418) acoplado para recibir fluido del suministro de fluido (400) y para distribuir el fluido a la segunda entrada y la tercera entrada de la cámara (410);
una boquilla (411) acoplada a la tercera entrada de la cámara (410), suministrando la boquilla (411) el fluido desde el conjunto de pistón (418) a la cámara (410);
una primera válvula acoplada a la salida (402) de la cámara (410), estando acoplada la primera válvula a un conjunto accionador (432) para controlar la distribución de fluido supersaturado con gas desde la cámara (410); y
una segunda válvula acoplada a la segunda entrada, estando acoplada la segunda válvula a un conjunto accionador (432) para controlar la dilución durante la creación de fluido supersaturado con gas dentro de la cámara (410).
2. El dispositivo expuesto en la reivindicación 1, incluyendo además una tercera válvula acoplada a un lumen de fluido a través del que fluye fluido desde el conjunto de pistón (418), rodeando la cámara (410), cuando la tercera válvula está abierta y la primera válvula y la segunda válvula están cerradas.
3. El dispositivo expuesto en alguna de las reivindicaciones precedentes, donde el suministro de gas (412) mantiene la presión de fluido dentro de la cámara (410) a un nivel predeterminado.
4. El dispositivo expuesto en la reivindicación 3, donde el nivel predeterminado es al menos 3,4 mpa (500 psi).
5. El dispositivo expuesto en alguna de las reivindicaciones precedentes, donde el fluido procedente del suministro de fluido (400) incluye fluido fisiológico.
6. El dispositivo expuesto en la reivindicación 5, donde el fluido fisiológico incluye salina.
7. El dispositivo expuesto en alguna de las reivindicaciones precedentes, donde el conjunto de pistón (418) incluye una jeringa (416).
8. El dispositivo expuesto en alguna de las reivindicaciones precedentes, donde el gas incluye oxígeno.
9. El dispositivo expuesto en la reivindicación 7, donde la jeringa (416) incluye un pistón, e incluyendo además un motor (42) acoplado al pistón de la jeringa (416) para presurizar fluido del suministro de fluido (400) antes de la distribución del fluido a la cámara (410).
10. El dispositivo expuesto en alguna de las reivindicaciones precedentes, donde la segunda válvula se cierra para facilitar la atomización del fluido a través de la boquilla (411).
11. El dispositivo expuesto en alguna de las reivindicaciones precedentes, donde la segunda válvula se abre para facilitar la dilución de fluido.
12. El dispositivo expuesto en alguna de las reivindicaciones precedentes, donde el conjunto accionador (432) regula la primera válvula para controlar la extracción del fluido supersaturado con gas procedente de la cámara (410).
13. El dispositivo expuesto en alguna de las reivindicaciones precedentes, incluyendo un conjunto de control (436) acoplado al conjunto accionador (432).
14. El dispositivo expuesto en la reivindicación 13, incluyendo una pantalla acoplada al conjunto de control (436).
15. El dispositivo expuesto en alguna de las reivindicaciones precedentes, donde el conjunto de pistón (418) administra el fluido a la tercera entrada de la cámara (410) de forma continua.
16. El dispositivo expuesto en alguna de las reivindicaciones precedentes 1 a 14, donde el conjunto de pistón (418) administra intermitentemente el fluido a la tercera entrada de la cámara (410).
17. El dispositivo expuesto en alguna de las reivindicaciones precedentes, incluyendo una primera válvula de retención acoplada entre el conjunto de pistón (418) y la cámara (410) para evitar la pérdida de fluido de la cámara (410) durante la distribución de fluido del suministro de fluido (400) al conjunto de pistón (418).
18. El dispositivo expuesto en la reivindicación 17, incluyendo una segunda válvula de retención acoplada entre el conjunto de pistón (418) y el suministro de fluido (400) para evitar el flujo de fluido al suministro de fluido (400) durante la distribución de fluido a la cámara (410) por el conjunto de pistón (418).
19. El dispositivo expuesto en la reivindicación 18, incluyendo una tercera válvula de retención acoplada a la boquilla (411) para evitar el flujo de fluido y gas desde la cámara (410) a través de la boquilla (411).
20. El dispositivo expuesto en alguna de las reivindicaciones precedentes 2 a 19, donde el conjunto accionador (432) incluye un primer solenoide acoplado a la primera válvula, un segundo solenoide acoplado a la segunda válvula, y un tercer solenoide acoplado a la tercera válvula, estando adaptado cada solenoide respectivo para mover su válvula respectiva entre una posición abierta y una posición cerrada.
21. El dispositivo expuesto en alguna de las reivindicaciones precedentes, donde la cámara (410) incluye un alojamiento desechable acoplado a un tapón.
22. El dispositivo expuesto en alguna de las reivindicaciones precedentes, incluyendo un conjunto de alojamiento protector dispuesto alrededor de la cámara (410).
23. Un método para supersaturar con gas un fluido incluyendo los pasos de:
proporcionar un suministro de fluido (400) y un suministro de gas (412);
proporcionar una cámara (410) que tiene una primera entrada, una segunda entrada, una tercera entrada y una salida (402);
proporcionar un conjunto de pistón (418) acoplado para recibir fluido del suministro de fluido (400) y para distribuir el fluido a la segunda entrada y a la tercera entrada de la cámara (410);
proporcionar una boquilla (411) acoplada a la tercera entrada de la cámara (410) para distribuir el fluido del conjunto de pistón (418) a la cámara (410);
proporcionar una primera válvula acoplada a la salida (402) de la cámara (410), estando acoplada la primera válvula a un conjunto accionador (432) para controlar la distribución de fluido supersaturado con gas de la cámara (410);
proporcionar una segunda válvula acoplada a la segunda entrada, estando acoplada la segunda válvula a un conjunto accionador (432) para controlar la dilución durante la creación de fluido supersaturado con gas dentro de la cámara (410); y proporcionar una tercera válvula acoplada a un lumen de fluido a través del que fluye fluido desde el conjunto de pistón (418), rodeando la cámara (410), cuando la tercera válvula está abierta y la primera válvula y la segunda válvula están cerradas;
recibir fluido de dicho suministro de fluido (400) por dicho conjunto de pistón (418);
distribuir el fluido a la segunda entrada y a la tercera entrada de la cámara (410) por dicho conjunto de pistón (418);
distribuir el fluido desde dicho conjunto de pistón (418) a la cámara (410) por dicha boquilla (411);
controlar la distribución de fluido supersaturado con gas desde la cámara (410) por dicha primera válvula;
controlar la dilución durante la creación de fluido supersaturado con gas dentro de la cámara (410) por dicha segunda válvula; y
rodear la cámara (410) abriendo dicha tercera válvula y cerrando dicha primera válvula y dicha segunda válvula.
24. El método expuesto en la reivindicación 23, incluyendo el paso de:
distribuir gas desde el suministro de gas a la primera entrada de la cámara (410) para mantener la presión dentro de la cámara (410) a un nivel predeterminado.
25. El método expuesto en la reivindicación 24, donde el nivel predeterminado es al menos 3,4 mpa (500 psi).
26. El método expuesto en alguna de las reivindicaciones precedentes 23 a 25, donde el fluido procedente del suministro de fluido (400) incluye fluido fisiológico.
27. El método expuesto en alguna de las reivindicaciones precedentes 23 a 26, donde el fluido fisiológico incluye una solución isotónico para sangre.
28. El método expuesto en alguna de las reivindicaciones precedentes 23 a 27, donde el conjunto de pistón (418) incluye una jeringa (416).
29. El método expuesto en alguna de las reivindicaciones precedentes 23 a 28, donde el gas incluye oxígeno.
30. El método expuesto en la reivindicación 28, donde la jeringa (416) incluye un pistón, y donde el método incluye el paso de:
proporcionar un motor (42) acoplado al pistón de la jeringa (416) para presurizar fluido desde el suministro de fluido antes de la distribución del fluido a la cámara (410).
31. El método expuesto en alguna de las reivindicaciones precedentes 23 a 30, incluyendo el paso de:
cerrar la segunda válvula para facilitar la atomización del fluido a través de la boquilla (411).
32. El método expuesto en alguna de las reivindicaciones precedentes 23 a 31, incluyendo el paso de:
abrir la segunda válvula para facilitar la dilución de fluido.
33. El método expuesto en alguna de las reivindicaciones precedentes 23 a 32, incluyendo el paso de:
ajustar la primera válvula para controlar la extracción del fluido supersaturado con gas de la cámara (410).
34. El método expuesto en alguna de las reivindicaciones precedentes 23 a 33, incluyendo el paso de:
controlar el conjunto accionador (432) para regular la primera válvula para extracción del fluido supersaturado con gas de la cámara (410).
35. El método expuesto en cualquiera de las reivindicaciones anteriores 23 a 34, incluyendo el paso de:
distribuir el fluido a la tercera entrada de la cámara (410).
36. El método expuesto en la reivindicación 35, donde el fluido es distribuido de forma continua.
37. El método expuesto en la reivindicación 35, donde el fluido es distribuido intermitentemente.
38. El método expuesto en alguna de las reivindicaciones precedentes 23 a 37, incluyendo el paso de:
proporcionar una primera válvula de retención acoplada entre el conjunto de pistón (418) y la cámara (410) para evitar la pérdida de fluido de la cámara (410) durante la distribución de fluido desde el suministro de fluido (400) al conjunto de pistón (418).
39. El método expuesto en la reivindicación 38, incluyendo el paso de:
proporcionar una segunda válvula de retención acoplada entre el conjunto de pistón (418) y el suministro de fluido (400) para evitar el flujo de fluido al suministro de fluido (400) durante la distribución de fluido a la cámara (410) por el conjunto de pistón (418).
40. El método expuesto en la reivindicación 39, incluyendo el paso de:
proporcionar una tercera válvula de retención acoplada a la boquilla (411) para evitar el flujo de fluido y gas desde la cámara (410) a través de la boquilla (411).
41. El método expuesto en alguna de las reivindicaciones precedentes 23 a 40, donde el conjunto accionador (432) incluye un primer solenoide acoplado a la primera válvula, un segundo solenoide acoplado a la segunda válvula, y un tercer solenoide acoplado a la tercera válvula, estando adaptado cada solenoide respectivo para mover su válvula respectiva entre una posición abierta y una posición cerrada.
42. El método expuesto en alguna de las reivindicaciones precedentes 23 a 41, donde la cámara (410) incluye un alojamiento desechable acoplado a un tapón.
43. El método expuesto en alguna de las reivindicaciones precedentes 23 a 42, incluyendo el paso de:
proporcionar un conjunto de alojamiento protector dispuesto alrededor de la cámara (410).
Patentes similares o relacionadas:
Dispositivo de administración de un solo uso que tiene un elemento de cebado, del 29 de Julio de 2020, de BECTON, DICKINSON AND COMPANY: Un dispositivo de administración de un solo uso que comprende: un recipiente de líquido deformable manualmente que define una cámara interior , […]
Administración intravascular de composiciones de nanopartículas y usos de las mismas, del 29 de Julio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas que comprenden rapamicina y albúmina para su uso en un procedimiento para inhibir la remodelación […]
 Válvula de catéter, del 29 de Julio de 2020, de Profiform AG: Válvula de catéter, en particular, una válvula de catéter de cierre automático para su uso en urología, geriatría, entre otros, que comprende entre otras piezas, […]
Válvula de catéter, del 29 de Julio de 2020, de Profiform AG: Válvula de catéter, en particular, una válvula de catéter de cierre automático para su uso en urología, geriatría, entre otros, que comprende entre otras piezas, […]
Kit de tratamiento, dispositivo de medición y uso asociados, del 22 de Julio de 2020, de Perouse Medical: Kit de tratamiento que comprende: - una guía que consta de un extremo distal y un extremo proximal , - un dispositivo de determinación […]
Catéter integrado con caminos de fluido independientes, del 15 de Julio de 2020, de BECTON, DICKINSON AND COMPANY: Un sistema de catéter que comprende: un adaptador de catéter que comprende un conectador de catéter que define una cámara que se extiende […]
DISPOSITIVO PARA PROTEGER DE LA HUMEDAD UNA HERIDA, del 9 de Julio de 2020, de GARCIA GONZALEZ, Maria Pilar: Dispositivo (D) para proteger de la humedad una herida del cuerpo de un paciente que comprende una parte de base para ser conectada al cuerpo del paciente, […]
Catéter de múltiples luces con características de flujo potenciadas, del 1 de Julio de 2020, de C.R. BARD, INC.: Método para formar un tubo de catéter, comprendiendo el método: proporcionar una estructura de refuerzo que incluye partes de refuerzo […]
Conjunto de catéter intermitente, del 24 de Junio de 2020, de HOLLISTER INCORPORATED: Un conjunto de catéter intermitente , que comprende: un elemento introductor alargado que tiene un extremo de inserción proximal […]