Composiciones de sales de quitosano/glucosamina termogelificantes, duales y altamente biocompatibles.
Una composición termogelificante biocompatible que comprende:
a) una solución de quitosano;
y
b) una solución tampón que consiste en una solución de carbonato de amino-azúcar, una solución de fosfato de amino-azúcar o una solución de amino-azúcar fosforilado;
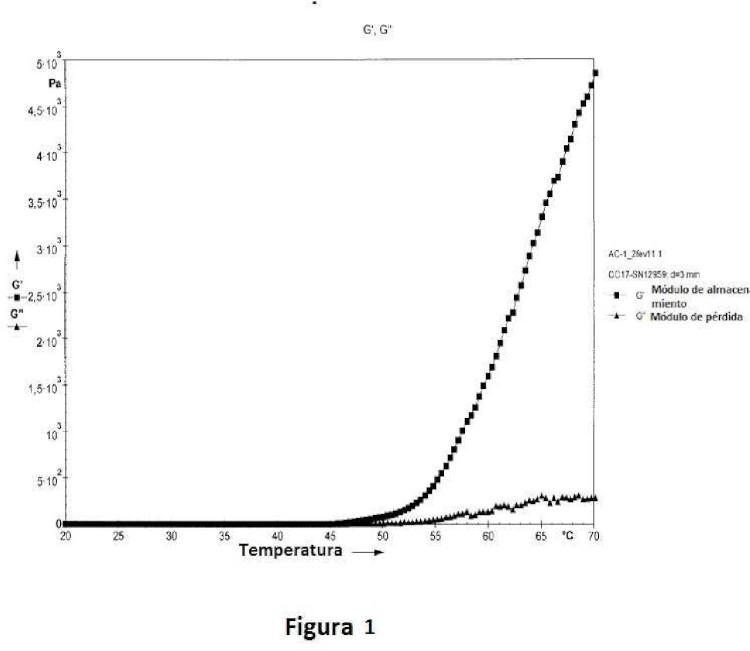
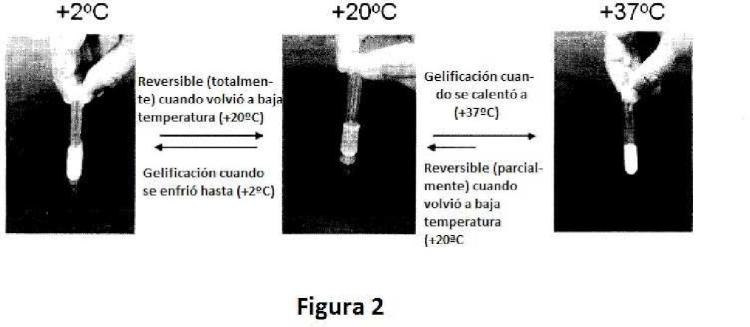
en donde la composición es biocompatible, isotónica y se convierte en gel con el tiempo o disminuyendo o aumentando la temperatura.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2011/000971.
Solicitante: Oligo Medic Inc.
Nacionalidad solicitante: Canadá.
Dirección: 2903 rue Fendall Montréal, Québec H3T 1N2 CANADA.
Inventor/es: CHENITE, ABDELLATIF, SELMANI, AMINE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K47/36 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Polisacáridos; Sus derivados, p. ej. gomas o resinas, almidón, alginato, dextrina, ácido hialurónico, quitosano, inulina, agar o pectina.
- A61K9/10 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Dispersiones; Emulsiones.
- A61L27/20 A61 […] › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Polisacáridos.
- A61L27/44 A61L 27/00 […] › que tienen una matriz macromolecular.
- A61L27/52 A61L 27/00 […] › Hidrogeles o hidrocoloides.
- C08J3/075 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08J PRODUCCION; PROCESOS GENERALES PARA FORMAR MEZCLAS; TRATAMIENTO POSTERIOR NO CUBIERTO POR LAS SUBCLASES C08B, C08C, C08F, C08G o C08H (trabajo, p. ej. conformado, de plásticos B29). › C08J 3/00 Procesos para el tratamiento de sustancias macromoleculares o la formación de mezclas. › Geles macromoleculares.
- C08L5/08 C08 […] › C08L COMPOSICIONES DE COMPUESTOS MACROMOLECULARES (composiciones basadas en monómeros polimerizables C08F, C08G; pinturas, tintas, barnices, colorantes, pulimentos, adhesivos D01F; filamentos o fibras artificiales D06). › C08L 5/00 Composiciones de polisacáridos o de sus derivados no previstos por los grupos C08L 1/00 ó C08L 3/00. › Quitina; Sulfato de condroitín; Acido hialurónico; Sus derivados.
PDF original: ES-2552659_T3.pdf
Patentes similares o relacionadas:
Agente de reticulación de diamina, cuerpo reticulado de polisacárido ácido y material médico, del 15 de Julio de 2020, de SEIKAGAKU CORPORATION: Polisacárido ácido reticulado obtenido formando reticulaciones mediante un enlace amida entre grupos amino primarios en un agente de reticulación de diamina y grupos […]
Hidrogeles polimerizables fluorados para vendajes de heridas y procedimientos para hacerlos, del 18 de Marzo de 2020, de THE UNIVERSITY OF AKRON: Un hidrogel que comprende: polímeros reticulados, los polímeros tienen cadenas principales de polisacáridos, donde las cadenas principales […]
Composición que comprende un agente gelificante más glucano, del 4 de Marzo de 2020, de BIOTEC PHARMACON ASA: Una composición de glucano para la cicatrización de heridas caracterizada por estar en forma de gel a 25 ºC y a un pH entre 4 y 8 y que comprende […]
Procedimiento para la preparación de nanopartículas de polisacáridos, del 5 de Febrero de 2020, de Nanovelos S.A: Procedimiento para la preparación de nanopartículas de polisacáridos y derivados de los mismos, mediante su oxidación parcial específica para producir grupos […]
Procedimiento para preparar hidrogeles, del 6 de Noviembre de 2019, de Teoxane: Procedimiento para preparar un gel reticulado de al menos un polisacárido o una de sus sales, que comprende al menos las etapas que consisten en: a) proporcionar una solución […]
Método para fabricar material pulverizado y pulverizador vibratorio, del 23 de Octubre de 2019, de KAO CORPORATION: Método para fabricar un material pulverizado, en el que el método usa un molino vibratorio dotado de: un recipiente [1] que tiene en el mismo un espacio en columna estando […]
COMPOSICIÓN SINÉRGICA PARA CONSERVAR FRESCOS PESCADOS Y MARISCOS, del 17 de Octubre de 2019, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La presente invención es una composición que puede formar una película comestible o un recubrimiento líquido comestible que puede ser aplicado a la superficie de pescado […]
Derivados silílicos de polisacáridos, del 16 de Octubre de 2019, de Sildeha Swiss SA: Un derivado silílico de polisacárido de fórmula (II) que es un polisacárido derivado (POH y/o PNH), con al menos un átomo de silicio (Si) caracterizado porque dicho derivado […]