PROCEDIMIENTOS PARA LA MODIFICACIÓN GENÉTICA DE LAS CÉLULAS PROGENITORAS HEMATOPOYÉTICAS Y UTILIZACIONES DE LAS CÉLULAS MODIFICADAS.
Composición para su utilización en el tratamiento de la infección por VIH en un sujeto humano,
que comprende un portador farmacéuticamente aceptable y por lo menos 1,63 x 10 6 células hematopoyéticas CD34 + por kg de peso corporal de un sujeto humano al que debe administrarse la composición, siendo por lo menos 0,52 X 10 6 de dichas células hematopoyéticas CD34 + por kg de peso corporal de dicho sujeto transducidas con un constructo viral que expresa un agente anti-VIH y en la que las células CD34 + transducidas pueden ser injertadas, dando lugar a células de progenie durante por lo menos 12 meses, en el sujeto
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/021907.
Solicitante: JOHNSON & JOHNSON RESEARCH PTY LIMITED.
Nacionalidad solicitante: Australia.
Dirección: AUSTRALIAN TECHNOLOGY PARK LEVEL 4 1 CENTRAL AVENUE EVELEIGH, NSW 1430 AUSTRALIA.
Inventor/es: SYMONDS,Geoffery,P, AMADO,Rafael, SUN,Lun-Quan, MACPHERSON,Janet, FANNING,Greg, GERLACH,Wayne.
Fecha de Publicación: .
Fecha Solicitud PCT: 10 de Julio de 2002.
Clasificación Internacional de Patentes:
- C12N15/113A1
Clasificación PCT:
- A61K31/7105 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Acidos ribonucleicos naturales, es decir conteniendo unicamente ribosas unidas a la adenina, la guanina, la citosina, o el uracilo y teniendo enlaces 3'-5' fosfodiester.
- A61K35/12 A61K […] › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- C12N15/113 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Acidos nucleicos no codificantes que modulan la expresión de genes, p.ej. oligonucleótidos antisentido.
Clasificación antigua:
- A01N43/04 A […] › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 43/00 Biocidas, productos que atraen o repelen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen compuestos heterocíclicos (que contienen anhídridos cíclicos, imidas cíclicas A01N 37/00; que contienen compuestos de fórmula , que no tienen más que un heterociclo en los que m≥1 y n≥0 y es una pirrolidina, una piperidina, una morfolina, una tiomorfolina, una piperazina o una polimetilenoimina, no sustituida o sustituida por un alcoilo, que tiene al menos cuatro grupos CH 2 A01N 33/00 - A01N 41/12; que contienen ácidos ciclopropanocarbhoxílicos o sus derivados, p. ej. ésteres con heterociclos, A01N 53/00). › con un heteroátomo.
- A61K31/07 A61K 31/00 […] › Compuestos del retinol, p. ej. la vitamina A (ácidos retinoicos A61K 31/203).
- C07H21/04 C […] › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C12Q1/68 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358187_T3.pdf
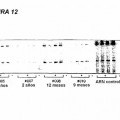
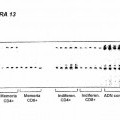


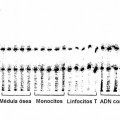
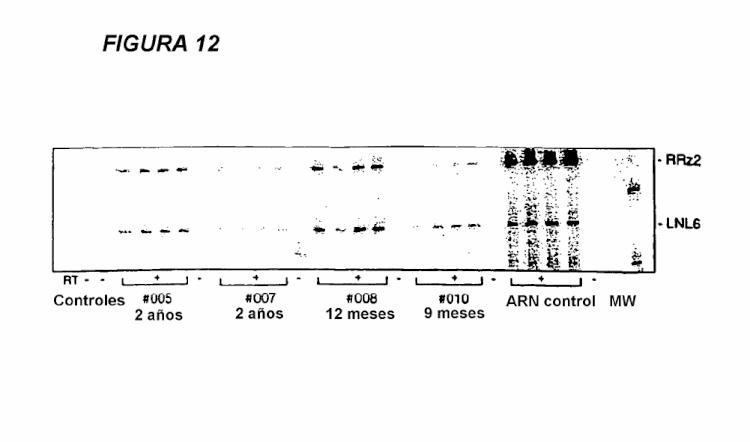
Fragmento de la descripción:
En la presente solicitud se hace referencia a varias publicaciones entre paréntesis. Las citas completas de estas publicaciones pueden encontrarse ordenadas alfabéticamente a la conclusión de la memoria inmediatamente anterior a las reivindicaciones. La referencia a estas publicaciones en la presente solicitud se proporciona con el fin de describir con mayor detalle el estado de la técnica al que pertenece la presente invención.
CAMPO DE LA INVENCION
La presente invención se refiere a la terapia génica, particularmente como la aplicada a las células hematopoyéticas progenitoras (HP), a las células transducidas y a los procedimientos para su obtención, y a los procedimientos de utilización.
ANTECEDENTES DE LA INVENCION
La terapia génica se refiere a la utilización de secuencias genéticas y su introducción en células para alterar la constitución genética de las células y por lo tanto cambiar las propiedades o funcionamiento de dichas células. La terapia génica puede ser utilizada, por ejemplo, para corregir un defecto genético proporcionando a las células una buena copia de un gen que funcione como se desee, o para proporcionar un gen que codifique para un ARN o proteína que inhiba una actividad celular o patogénica indeseable.
La terapia génica puede dirigirse a cualquiera de entre una variedad de enfermedades en las cuales exista un aspecto genético. Resultan de interés particular las enfermedades de los sistemas sanguíneo o inmune, puesto que las células hematopoyéticas son relativamente fáciles de recoger en un sujeto, permitiendo que sean usados los procedimientos ex vivo. Comprenden hemaglobinopatías, defectos de la producción o función de los leucocitos, deficiencias inmunes, enfermedades de almacenamiento lisosomal y defectos de células troncales como la anemia de Fanconi, enfermedad granulomatosa crónica, enfermedad de Gaucher, eficiencia de G6PD, etc. Muchos de esos trastornos han sido tratados exitosamente mediante transplantes de células de médula ósea alogénicos (Parkman 1986). Sin embargo, el requerimiento de supresión inmune u ocurrencia de efectos inmunológicos como el rechazo de injertos es una desventaja del transplante de médula ósea alogénico. La terapia génica de células hematopoyéticas troncales ha sido sugerida como medio alternativo para tratar enfermedades que afecten al sistema hematopoyético en humanos.
A pesar del primer éxito prometedor en la terapia génica en humanos, el éxito clínico ha sido muy difícil de lograr a pesar del esfuerzo masivo en la última década (Mountain, 2000). Esto se debe por lo menos en parte a las bajas eficiencias de transferencia de genes, una incapacidad por modificar suficientes células, una incapacidad por dirigir los tipos de células apropiados, y una falta de persistencia del efecto deseado en los sujetos humanos.
Se ha demostrado la dificultad de poner en práctica la terapia génica de las células hematopoyéticas troncales humanas (HS) (Kohn et al 1998, Halene y Kohn 2000, Kume et al 1999). En la mayoría de los ensayos en humanos, el nivel de leucocitos en sangre periférica que contienen el gen ha sido bajo y han vivido un corto tiempo, sugiriendo una falla en la transducción de células HS reconstituyentes (Bordignon et al 1995, Kohn 1995, Kohn et al 1998, Dunbar et al 1995, Hoogerbrugge et al 1996). Esto se relaciona en parte con las relativamente pocas HS y células hematopoyéticas progenitoras (HP) en el cuerpo (Bertolini et al 1998, Reis 1999) y el requerimiento de que las células sean activadas cuando se usen algunos de vectores retrovirales murinos para la transducción. Esto se relaciona con el bajo nivel de receptores anfotrópicos en células HS humanas en reposo (Bodine et al 1998). La mayoría de las células HS humanas están en reposo, responden de manera relativamente lenta a estímulos (Hao et al 1996, Gothot et al 1998) y cuando son inducidas a dividirse, deben perder la capacidad de repoblación a largo plazo (Traycoff et al 1998). Casi todos los intentos de terapia génica en humanos usando células HS hasta ahora han presentado dos problemas básicos: números insuficientes de células HS que sean totipotentes y que puedan haber sido transducidas en un injerto a largo plazo para tener un efecto terapéutico, y en segundo lugar, las células transducidas no han persistido en proporcionar células hematopoyéticas modificadas a largo plazo.
El ensayo más prometedor de terapia génica en células HP humanas implicó la transferencia de un gen en un niño con inmunodeficiencia combinada severa ligada al cromosoma X (SCID) que condujo la reconstitución de un sistema inmune con linfocitos T que contenían el gen (Cavazzana-Calvo et al 2000; Hacein-Bey-Abina et al 2002). Ese ensayo usó células CD34+ de médula ósea de pacientes pediátricos (< 12 meses) y proporcionó más de 106 células transducidas por kg. El numero de células CD34+ (por kg de peso) que puede ser aislado de niños, particularmente de bajo peso, es mucho mayor que en los adultos. La timopoyésis es también más activa en niños. Además, este estudio es inusual dado que la quimiopoyesis en el contexto SCID-X1 resulta únicamente de células CD34+ que contienen el gen exógeno (Cavazzana-Calvo et al 2001). De alguna manera, este estudio es análogo a los que presentan la mieloablación dado que las células infundidas pueden llenar el espacio fisiológico que no es ocupado en el paciente SCID. Los primeros estudios con transplante de médula ósea alogénicos mostraron que el injerto de células HS no se sostuvo en pacientes que no fueron sometidos a mieloablación, principalmente debido a la presencia continua de las células HS en el receptor (Parkman 1986). Por lo tanto, las conclusiones extraídas de los estudios de injerto anteriores usando células HS humanas en el contacto ablativo no pueden ser transferidas simplemente a los sistemas no ablativos.
Otros informes de ensayos clínicos en humanos para la terapia génica de células hematopoyéticas progenitoras son menos positivos. Kohn et al 1999 informaron de resultados de un ensayo clínico usando células CD34+ derivadas de medula ósea de pacientes pediátricos (8-17 años) transducidas con un gen que codifica para una RRE señuelo (molécula de ARN) contra el VIH. Este ensayo no logró una transducción significativa y el injerto de células progenitoras. En otro ensayo, fueron tratados pacientes con cáncer de mama u ovario con células HP después de la transducción con un gen marcador, después de la mieloablación, pero únicamente se observó la presencia transitoria de células marcadas (Bagnis et al 2002). Un ensayo clínico que incluyó 3 pacientes con la enfermedad de Gaucher mostró la presencia del vector que contenía el gen en sangre periférica y médula ósea hasta 3 meses después de la infusión pero a niveles muy bajos (Dunbar et al 1998). En otro ejemplo, se llevó a cabo un ensayo con cinco pacientes que padecían la enfermedad granulomatosa crónica (CGD) en el que fue introducido el gen p47phox en células CD34+ de sangre periférica. Aunque se encontraron neutrófilos corregidos en la sangre periférica durante los primeros meses después de la infusión, no fueron detectables a los seis meses después de la infusión (Malech et al 1997). Además, un ensayo para corregir la anemia de Fanconi donde se insertó el gen C del grupo de complementación en células CD34+ dio como resultado únicamente una detección transitoria del gen en pacientes después de la infusión (Liu et al 1999).
Los pobres resultados en esos ensayos pueden reflejar la ausencia de una ventaja de supervivencia de las células corregidas en comparación con las células no corregidas, en contraste con el caso de SCID ligada al cromosoma
X. Además, la mayoría de esos ejemplos, las poblaciones de células manipuladas fueron administradas a pacientes con
o sin mieloablación parcial, requiriendo que las células transducidas compitieran con las células troncales residentes que se deben injertar.
También pueden actuar otros factores. Las células HS pueden ser reducidas en número en pacientes con infección por VIH (Maradin et al 1996), dificultando la obtención de un número suficiente de esas células. Además, las células HS de individuos infectados por VIH están comprometidas en su reproducción y capacidades clonogénicas y muestran una mayor propensión a la apoptosis (Vignoli et al 1998, Zauli et al 1996). La movilización de células HP de sangre periférica usando el factor estimulante de la colonia de los granulocitos (G-CSF) fue demostrada en individuos infectados por VIH (Law et al 1999). La movilización... [Seguir leyendo]
Reivindicaciones:
1. Composición para su utilización en el tratamiento de la infección por VIH en un sujeto humano, que comprende un portador farmacéuticamente aceptable y por lo menos 1,63 x 106 células hematopoyéticas CD34+ por kg de peso corporal de un sujeto humano al que debe administrarse la composición, siendo por lo menos 0,52 X 106 de dichas células hematopoyéticas CD34+ por kg de peso corporal de dicho sujeto transducidas con un constructo viral que expresa un agente anti-VIH y en la que las células CD34+ transducidas pueden ser injertadas, dando lugar a células de progenie durante por lo menos 12 meses, en el sujeto.
2. Composición según la reivindicación 1, que comprende por lo menos 9,37 x 106 células hematopoyéticas CD34+ por kg de peso corporal de un sujeto humano, en la que por lo menos 5 x 106 células hematopoyéticas CD34+ son transducidas.
3. Composición según las reivindicaciones 1 a 2, en la que el agente anti-VIH es un ARN.
4. Composición según las reivindicaciones 1 a 2, en la que el agente anti-VIH es una molécula de ARNi.
5. Composición según las reivindicaciones 1 a 2, en la que el agente anti-VIH es una molécula antisentido.
6. Composición según las reivindicaciones 1 a 2, en la que el agente anti-VIH es una ribozima.
7. Composición según la reivindicación 6, en la que el agente anti-VIH es una ribozima codificada por los nucleótidos de ADN que presentan la secuencia 5-TTA GGA TCC TGA TGA GTC CGT GAG GAC GAA ACT GGC TC3.
8. Composición según cualquiera de las reivindicaciones 1 a 7, en la que las células son transducidas con un vector retroviral.
9. Composición según cualquiera de las reivindicaciones 1 a 8, en la que la composición está sustancialmente libre de citocinas.
10. Composición según cualquiera de las reivindicaciones 1 a 9, en la que la composición está sustancialmente libre de virus.
11. Composición según cualquiera de las reivindicaciones 1 a 10, en la que las células CD34+ transducidas pueden ser injertadas, y dar lugar a células de progenie durante por lo menos 24 meses, en el sujeto.
12. Composición según cualquiera de las reivindicaciones 1 a 11, en la que el sujeto es un adulto.
13. Composición según cualquiera de las reivindicaciones 1 a 12, en la que las células hematopoyéticas CD34+ son autólogas.
14. Procedimiento para la preparación in vitro de la composición según la reivindicación 1, que comprende: a) aislar las células hematopoyéticas CD34+ mediante un procedimiento inmunoselectivo a partir de leucocitos aislados que pueden obtenerse de un sujeto humano que ha sido sometido a la movilización de las células hematopoyéticas CD34+ en la sangre y el aislamiento de los leucocitos por aféresis; b) someter las células hematopoyéticas CD34+ de la etapa a) a un procedimiento de transducción con un gen de interés que codifica un agente anti-VIH en presencia de un agente que colocaliza las células con un vector de transducción; y c) determinar el número total de células hematopoyéticas CD34+ tras la etapa b), y si el número total de células hematopoyéticas CD34+ tras la etapa b) es inferior a 1,63 x 106 células por kg de peso corporal del sujeto humano, realizando de nuevo a continuación las etapas a) y b) y combinar las células hematopoyéticas CD34+.
15. Procedimiento según la reivindicación 14, en el que el agente anti-VIH es una ribozima codificada por nucleótidos de ADN que presentan la secuencia 5-TTA GGA TCC TGA TGA GTC CGT GAG GAC GAA ACT GGC TC3.
16. Procedimiento según la reivindicación 14, en el que el agente que colocaliza las células con el constructo viral es un fragmento de fibronectina.
17. Procedimiento según la reivindicación 16, en el que el fragmento de fibronectina es el fragmento de fibronectina recombinante CH-296.
Patentes similares o relacionadas:
Composición para el tratamiento de enfermedades isquémicas o trastornos inflamatorios neurogénicos, que contienen el secretoma de células progenitoras neurales como ingrediente activo, del 22 de Julio de 2020, de S-BIOMEDICS: Una composición para uso en el tratamiento de enfermedad cerebrovascular isquémica, cardiopatía isquémica, infarto de miocardio, enfermedad de Alzheimer, enfermedad […]
Agente profiláctico y/o agente terapéutico para el linfoma difuso de células B grandes, del 17 de Junio de 2020, de ONO PHARMACEUTICAL CO., LTD.: 6-amino-9-[(3R)-1-(2-butinoil)-3-pirrolidinil]-7-(4-fenoxifenil)-7,9-dihidro-8H-purin-8-ona, una sal de la misma, un solvato de la misma o un N-óxido de la misma, […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]
Método para preparar una célula dendrítica, célula dendrítica preparada mediante el mismo y uso del mismo, del 13 de Mayo de 2020, de JW Creagene Inc: Un método para preparar una célula dendrítica que comprende: cultivar una célula dendrítica inmadura hasta una célula dendrítica madura en presencia de […]
Transfección mediada por células apoptóticas de células de mamífero con ARN de interferencia, del 22 de Abril de 2020, de LOMA LINDA UNIVERSITY: Una célula de mamífero apoptótica o preapoptótica para su uso en la prevención del rechazo de trasplantes, en la que la célula de mamífero […]
Métodos mejorados para producir terapias celulares adoptivas, del 22 de Abril de 2020, de Bluebird Bio, Inc: Un método in vitro para producir un producto terapéutico de células T que comprende: a) proporcionar una población de células mononucleares […]
Solución de preservación del trasplante basada en polímeros, del 25 de Marzo de 2020, de Kizhakkedathu, Jayachandran: Una solución de preservación del trasplante que comprende un poliglicerol hiperramificado o dendrítico en el que el poliglicerol hiperramificado […]