Peptidasas de basidiomicetos.
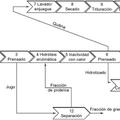
Método para producir hidrolizados de proteína y/o fracciones de la misma,
que comprende las etapas de:
a. proporcionar una mezcla de peptidasas obtenida de micelios de Basidiomicetos cultivados en un cultivo anegado,
b. añadir la mezcla a un sustrato que contenga dicha proteína y/o fracciones de la misma y
c. realizar la hidrólisis de dicha proteína y/o fracciones de la misma para obtener dichos hidrolizados;
en el que la mezcla de peptidasas comprende al menos una peptidasa que comprende la secuencia proporcionada en las SEC ID Nos 1, 2, 3 o 4.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/003386.
Solicitante: NESTEC S.A..
Nacionalidad solicitante: Suiza.
Dirección: AVENUE NESTLE 55 1800 VEVEY SUIZA.
Inventor/es: ULMER,HELGE, ZORN,HOLGER, LINKE,DIANA, KRINGS,ULRICH, RABE,SWEN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A23J3/00 NECESIDADES CORRIENTES DE LA VIDA. › A23 ALIMENTOS O PRODUCTOS ALIMENTICIOS; SU TRATAMIENTO, NO CUBIERTO POR OTRAS CLASES. › A23J COMPOSICIONES A BASE DE PROTEINAS PARA LA ALIMENTACION; TRATAMIENTO DE PROTEINAS PARA LA ALIMENTACION; COMPOSICIONES A BASE DE FOSFATIDOS PARA LA ALIMENTACION. › Tratamiento de proteínas para la alimentación.
- C12N9/48 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre los enlaces peptídicos, p. ej. tromboplastina, aminopeptidasa de la leucina (3.4).
- C12P21/06 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › preparados por hidrólisis de un enlace peptídico, p. ej. hidrolizados.
PDF original: ES-2530760_T3.pdf



Fragmento de la descripción:
E087491
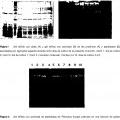
Peptidasas de basidiomicetos Campo de la invención La presente invención se refiere a enzimas peptidasas derivadas de los micelios de basidiomicetos, en particular a enzimas peptidasas específicas de gluten, a su método de producción y a su uso en la hidrólisis de proteínas.
Antecedentes de la invención La hidrólisis de proteínas vegetales representa uno de los procesos más antiguos de la biotecnología alimenticia. Empíricamente realizado durante siglos en países asiáticos, la proteína de soja se hidroliza para producir, entre otros, Shoyu, una salsa de soja y un condimento habitual que en el mundo occidental ha llegado a ser casi sinónimo de cocina china. En estos procesos eternos, algunas veces tediosos, las actividades peptidolíticas requeridas proceden de una fermentación consecutiva de Aspergilli, de bacterias ácido lácticas y de levaduras que se desarrollan en sus sustratos vegetales respectivos.
Los países occidentales han imitado este proceso usando proteínas de trigo, arroz o cacahuete y reemplazando la hidrólisis enzimática por hidrólisis ácida, por ejemplo, usando ácido clorhídrico, para abrir eficazmente los enlaces peptídicos cinéticamente muy estables. Los productos, normalmente denominados proteína vegetal hidrolizada (PVH) , son condimentos líquidos o concentrados para obtener pastas, polvos, premezclas para su uso en composiciones de sopa o salsa, o cubitos de caldo. Todos los productos confieren un olor y un sabor similar a la carne, aunque la carne no interviene en ninguna fase del proceso.
Dado que el ácido debe neutralizarse después de haberse completado los procesos hidrolíticos, se añade hidróxido sódico. El cloruro sódico formado durante esta reacción de neutralización mantiene las propiedades potenciadoras de sabor del hidrolizado vegetal y con frecuencia se acepta en el producto final.
Sin embargo, la hidrólisis ácida soporta muchas desventajas. Los ácidos y bases fuertes son sustancias peligrosas y se considera que no son compatibles con la seguridad y las operaciones de calidad alimenticia, especialmente a temperaturas por encima de 100 º C. Incluso más prob lemático es la inevitable formación de compuestos dicloro, tales como 1, 2-y 1, 3-dicloropropanol, que se ha observado que es carcinogénico en estudios de alimentación animal. El contacto de la fracción lipídica de las materias primas con el ácido clorhídrico también genera esteroides clorados, aunque compuestos tales como el 5- (clorometil) furfural proceden de las rutas de Maillard.
Para impedir la formación de compuestos peligrosos o tóxicos, la atención se ha dirigido de nuevo a procesos enzimáticos en los que estos compuestos ni se requieren ni deben formarse. Como consecuencia, ha habido un inmenso interés en mejorar los procesos enzimáticos.
Las peptidasas se clasifican según su mecanismo de acción sobre el sustrato de proteína (endo o exopeptidasas; las exopeptidasas pueden ser amino o carboxilpeptidasas) o sobre uno de los cuatro mecanismos catalíticos. Las serina endopeptidasas están representadas por las superfamilias de quimotripsina y subtilisina; presentan una amplia especificidad por sustratos y contienen la denominada tríada catalítica. Las cisteína endopeptidasas están representadas por cuatro superfamilias y se producen en fuentes microbianas, vegetales y animales; el nombre hace referencia al resto de cisteína en la tríada catalítica. Las ácido aspártico endopeptidasas escinden enlaces peptídicos mediante una acción concertada de dos restos de aspartato. Las metalopeptidasas son enzimas antiguas evolutivas, que normalmente contienen zinc, con especificidades de tipo exo y endo.
Son peptidasas comunes, por ejemplo, la alcalasa (una serina peptidasa de Bacillus licheniformis) , la papaína (una cisteína peptidasa de Carica papaya) , la quimosina (rennet) de cepas Mucor recombinantes y la neutrasa (una metalopeptidasa de Bacillus subtilis) . El documento US 3694316 describe un proceso para la preparación de proteasas de basidiomicetos. Otras peptidasas comerciales, tales como pronasa o Flavorzyme®, son mezclas de diversos tipos de actividades producidas por bacterias tales como Streptomyces griseus o por hongos ascomicetos tales como Aspergillus or y zae.
Debido a su naturaleza biocatalítica, el proceso enzimático puede realizarse en condiciones físicas suaves y por tanto es más ecológico que su homólogo catalizado ácido. Sin embargo, a diferencia de la hidrólisis ácida, los procesos enzimáticos a menudo no alcanzan la terminación y pueden dar como resultado productos parcialmente hidrolizados con un sabor amargo; el nivel de amargor aumenta con el aumento del grado de hidrólisis hasta alcanzar un máximo, y después disminuye con el progreso de la hidrólisis.
Se han publicado numerosos intentos para acelerar los procesos enzimáticos (Pedroche, J. et al., Electronic Journal of Environmental, Agricultural and Food chemistr y , 2003) y para impedir la formación de péptidos amargos (Maehashi K. et al., Molecular Methods of plant Analysis, 2002, 47-68) .
E087491
Las proteínas de origen vegetal (Lamsal, B.P. et al., Journal of the American Oil Chemistsâ? Society, 83 (8) , 731-737, 2006) o animal (Je, J. et al., European Food Research and Technology, 221 (1-2) , 157-162, 2005) o desechos de procesamiento, tales como salvado de arroz, han servido como sustratos (Jarunrattanasri, A. et al., ACS Symposium Series, 83-97, 2005) . También se han investigado sustratos tales como hemoglobina, caseína e insulina (Suzuki, N. et al. Phytochemistr y , 2005, 66, 983-990) .
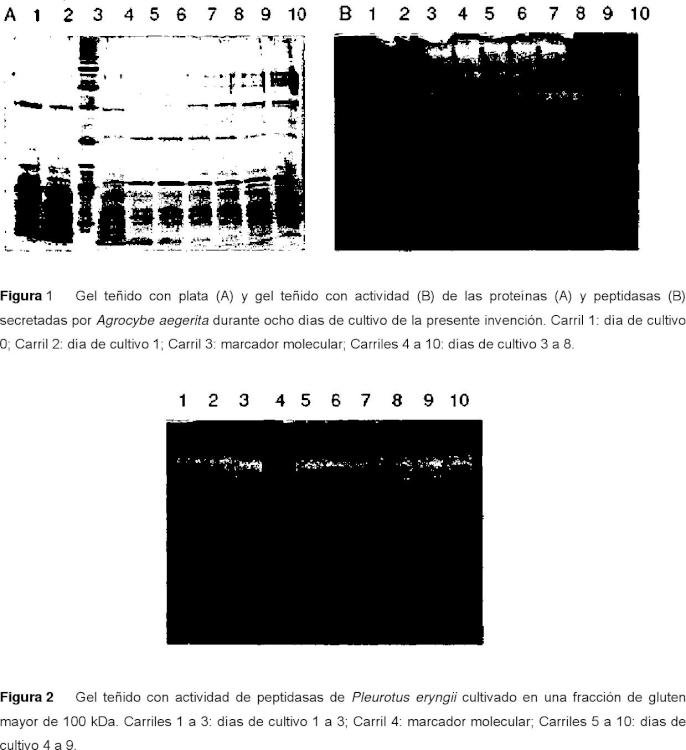
Se han sugerido enzimas de muchas fuentes microbianas, incluso de especies patógenas (Moreira, F.G. et al., Brazilian Journal of Microbiology, 36 (1) , 7-11, 2005) . Por ejemplo, se descubrió que una aspártico peptidasa de Pleurotus er y ngii es activa frente a la caseína (Wang, H. et al. Biochem. Biophys. Res. Commun. 2001, 289, 750755) . Las metalopeptidasas de Grifola frondosa y de Pleurotus ostreatus se han caracterizado y evaluado mecanísticamente (Nonaka, T. et al., J. Biol. Chem., 1997, 272, 30032-30039; Hori, T. et al., Acta Cr y stallogr. D Biol. Chr y stallogr., 2001, 57, 361-368) . El documento EP1074632 también se refiere a la hidrólisis enzimática de proteínas usando cultivos fúngicos.
Se ha sugerido que las combinaciones de actividades hidrolíticas muestran propiedades sinérgicas (Minones Conde, J. et al., Journal of Agricultural and Food Chemistr y , 53 (20) , 8038-8045, 2005) . La presencia de una actividad glutaminasa fue importante para obtener un hidrolizado con un sabor intenso y típico (Schlichtherle-Cerny, H. et al., Journal of Agricultural and Food Chemistr y , 50 (6) , 1515-1522, 2002 and EP 1290951) . El documento US3912822 se refiere a un proceso para la producción de un hidrolizado de proteína que tiene un contenido particularmente alto de ácido glutámico.
Sin embargo, solo muy pocas patentes proporcionan detalles sobre la composición química de los productos de hidrólisis (documento US 6465209) o sobre el tipo de enlaces peptídicos preferiblemente escindidos (documento JP 01291795) .
Las enzimas vegetales son particularmente adecuadas para degradar un sustrato vegetal; el uso de la misma planta como una fuente de proteína y enzima fue una idea fascinante (Tchorbanov, B., Special Publication -Royal Society of Chemistr y , 491-494, 2001) .
La soja (documentos WO 2002/069733; WO 2004/056980) y el trigo (documento WO2006/104022, Abe, M. et al. Biosci. Biotechnol. Biochem., 2003, 67, 2018-2021) continúan siendo los sustratos más comunes de la hidrólisis enzimática, aunque la hidrólisis de proteínas animales es a menudo una tentativa para minimizar corrientes secundarias del procesamiento de alimentos, tales como huesos o sangre de peces (JP 2005176620; RU2003106447) . Entre los microorganismos usados se encuentran combinaciones de bacterias (documento WO2002/085131) , mezclas de especies tradicionales (documento JP2006/075006) , Aspergillus recombinante (documento JP2005/328738) , o un basidiomiceto (documento JP2006/094757) . Sabotic, J. et al. en J. Biotechnology, 128, págs. 297-307, 2006, informan sobre la diversidad de peptidolítica de basidiomicetos europeos. Si el biocatalizador no era una célula intacta, se sugerían peptidasas sencillas, tales como neutrasa (documento WO2006/103628) , o combinaciones de enzimas vegetales y microbianas (CN1397644 WO2002 / 078461) .
Las mezclas de actividades hidrolíticas también son útiles, si se desea un alto grado de hidrólisis (documentos WO2001/076391; WO2003/061675; WO2002/001961) . Se produjo un extracto de levadura rico en 5'-nucleótidos en un proceso secuencial usando enzimas de actinomicetos y después... [Seguir leyendo]
Reivindicaciones:
1. Método para producir hidrolizados de proteína y/o fracciones de la misma, que comprende las etapas de:
a. proporcionar una mezcla de peptidasas obtenida de micelios de Basidiomicetos cultivados en un cultivo anegado,
b. añadir la mezcla a un sustrato que contenga dicha proteína y/o fracciones de la misma y
c. realizar la hidrólisis de dicha proteína y/o fracciones de la misma para obtener dichos hidrolizados;
en el que la mezcla de peptidasas comprende al menos una peptidasa que comprende la secuencia proporcionada en las SEC ID Nos 1, 2, 3 o 4.
2. Método de acuerdo con la reivindicación 1, en el que la proteína se selecciona de gluten, suero, soja, preferentemente gluten. 15
3. Método de acuerdo con la reivindicación 1, en el que las peptidasas son enzimas extracelulares.
4. Método de acuerdo con cualquiera de las reivindicaciones 1 a 3, en el que los Basidiomicetos se seleccionan de
Himenomicetos. 20
5. Método de acuerdo con cualquiera de las reivindicaciones 1 a 4, en el que los Basidiomicetos se seleccionan de los géneros Pleurotus, Lentinula, Agrocybe o Grifola.
6. Método de acuerdo con cualquiera de las reivindicaciones 1 a 5, en el que los Basidiomicetos se seleccionan de
las cepas de Pleurotus sapidus, Pleurotus er y ngii, Pleurotus ostreatus, Lentinula edodes, Agrocybe aegerita, Pleurotus floridanus o Grifola frondosa.
7. Método de acuerdo con cualquiera de las reivindicaciones 1 a 6, en el que los hidrolizados son péptidos y/o aminoácidos. 30
8. Uso de una mezcla de peptidasas obtenidas de micelios de Basidiomicetos para la hidrólisis de gluten y/o fracciones del mismo, en el que la mezcla de peptidasas comprende al menos una peptidasa que comprende la secuencia proporcionada en las SEQ ID Nos 1, 2, 3 o 4.
9. Uso de hidrolizados obtenidos mediante un método de una cualquiera de las reivindicaciones 1 a 7 en una composición alimenticia, una composición cosmética y/o una composición farmacéutica o médica.
10. Uso de acuerdo con la reivindicación 9, en el que la composición es una bebida, quesos, dulces, postres, aderezos, bebidas de fruta, productos cárnicos, aperitivos, complementos nutricionales, alimentos, complementos de alimento para animales, dietas médicas, productos para la piel o el cabello, fertilizantes, preparaciones veterinarias, constituyentes para el cultivo in vitro de células de mamífero etc.
11. Mezcla de peptidasas, en la que dicha mezcla se produce por micelios de Basidiomicetos, preferentemente de Himenomicetos, y en la que al menos una peptidasa comprende la secuencia proporcionada en las SEC ID Nos 1, 2, 45 3º4.
12. Mezcla de peptidasas de acuerdo con la reivindicación 11, en la que los Basidiomicetos se seleccionan de los géneros Pleurotus, Lentinula, Agrocybe, o Grifola, preferentemente seleccionado a partir de cepas de Pleurotus sapidus, Pleurotus er y ngii, Pleurotus, ostreatus, Lentinula edodes, Agrocybe aegerita, Pleurotus floridanus o Grifola 50 frondosa.
13. Mezcla de peptidasas de acuerdo con las reivindicaciones 11 o 12, teniendo dicha mezcla una eficacia de conversión de 3 a 20 DH, preferentemente de 6 a 19 DH.
Patentes similares o relacionadas:
 Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
 Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Uso de tripeptidil peptidasas tolerantes a la prolina en composiciones de aditivo para piensos, del 26 de Febrero de 2020, de Dupont Nutrition Biosciences ApS: Un método para preparar una composición de aditivo para piensos que comprende: mezclar al menos una tripeptidil peptidasa tolerante a la prolina que tiene […]
Enzimas específicas de sitio y métodos de uso, del 19 de Febrero de 2020, de Poseida Therapeutics, Inc: Un polipéptido que comprende al menos una secuencia de aminoácidos que tiene la secuencia de LSTEQVVAIASX1X2GGKQALEAVKAQLLVLRAAPYE (SEQ ID NO: 1), en donde […]
Composiciones para unir módulos de dedos de cinc, del 15 de Enero de 2020, de Sangamo Therapeutics, Inc: Una proteína de dedos de cinc de múltiples dedos que se une específicamente a un sitio diana, comprendiendo la proteína de dedos de cinc de […]
Concentrado de proteínas de granos que contienen almidón: composición, método de fabricación y usos del mismo, del 1 de Enero de 2020, de THE UNITED STATES OF AMERICA AS REPRESENTED BY THE SECRETARY OF AGRICULTURE: Un proceso para producir un concentrado de proteinas a partir de un grano o semilla oleaginosa que contiene almidon, el proceso comprende: (i) moler el […]
 Terapia de ARNm para el tratamiento de enfermedades oculares, del 25 de Diciembre de 2019, de Translate Bio, Inc: Una composición que comprende un ARNm que codifica un péptido o polipéptido terapéutico para su uso en el tratamiento de una enfermedad, trastorno o afección ocular en un […]
Terapia de ARNm para el tratamiento de enfermedades oculares, del 25 de Diciembre de 2019, de Translate Bio, Inc: Una composición que comprende un ARNm que codifica un péptido o polipéptido terapéutico para su uso en el tratamiento de una enfermedad, trastorno o afección ocular en un […]
 Purificación de proteínas con prefiltrado, del 27 de Noviembre de 2019, de EMD Millipore Corporation: Un método para eliminar constituyentes de unión no específica de una corriente que contiene proteínas que comprende:
hacer fluir la corriente que contiene proteínas […]
Purificación de proteínas con prefiltrado, del 27 de Noviembre de 2019, de EMD Millipore Corporation: Un método para eliminar constituyentes de unión no específica de una corriente que contiene proteínas que comprende:
hacer fluir la corriente que contiene proteínas […]