METODO PARA LA PRODUCCION DE GLICEROL POR ORGANISMOS RECOMBINANTES.
LA PRESENTE PETICION SE REFIERE A UNOS ORGANISMOS RECOMBINADOS QUE TIENEN GENES QUE CODIFICAN PARA UNA ACTIVIDAD DE GLICEROL 3 - FOSFATO DESHIDROGENASA Y/O GLICEROL - 3 - FOSFATASA.
DICHOS ORGANISMOS SON UTILES PARA LA OBTENCION DE GLICEROL A PARTIR DE VARIOS SUBSTRATOS CARBONADOS
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US97/20293.
Solicitante: E.I. DU PONT DE NEMOURS AND COMPANY
GENENCOR INTERNATIONAL, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1007 MARKET STREET,WILMINGTON DELAWARE 19898.
Inventor/es: BULTHUIS, BEN, A., HAYNIE, SHARON, LORETTA, GATENBY,ANTHONY,ARTHUR, HSU,AMY,KUANG-HUA, LAREAU,RICHARD,D.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Junio de 2010.
Clasificación Internacional de Patentes:
- C12P7/20 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 7/00 Preparación de compuestos orgánicos que contienen oxígeno. › Glicerol.
Clasificación PCT:
- C12N1/15 C12 […] › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › modificados por la introducción de material genético extraño.
- C12N1/19 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/53 C12N […] › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Oxidorreductasas (1).
- C12N15/55 C12N 15/00 […] › Hidrolasas (3).
- C12N9/04 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre grupos CHOH como dadores, p. ej. glucosa oxidasa de glucosa, deshidrogenasa láctica (1.1).
- C12N9/16 C12N 9/00 […] › actúan sobre los enlaces éster (3.1).
- C12P7/20 C12P 7/00 […] › Glicerol.
Clasificación antigua:
- C12N1/15 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N1/19 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N1/21 C12N 1/00 […] › modificados por la introducción de material genético extraño.
- C12N15/53 C12N 15/00 […] › Oxidorreductasas (1).
- C12N15/55 C12N 15/00 […] › Hidrolasas (3).
- C12N9/04 C12N 9/00 […] › actúan sobre grupos CHOH como dadores, p. ej. glucosa oxidasa de glucosa, deshidrogenasa láctica (1.1).
- C12N9/16 C12N 9/00 […] › actúan sobre los enlaces éster (3.1).
- C12P7/20 C12P 7/00 […] › Glicerol.
Fragmento de la descripción:
Método para la producción de glicerol por organismos recombinantes.
Campo de la invención
La presente invención se refiere al campo de la biología molecular y al uso de organismos recombinantes para la producción de compuestos deseados. Más específicamente, describe la expresión de genes clonados para glicerol-3-fosfato deshidrogenasa (G3PDH) y glicerol-3-fosfatasa (G3P fosfatasa) para la producción reforzada de glicerol.
Antecedentes
El glicerol es un compuesto muy demandado por la industria para uso en cosméticos, jabones líquidos, alimentos, productos farmacéuticos, lubricantes, soluciones anti-congelantes, y en numerosas otras aplicaciones. Los ésteres de glicerol son importantes en la industria de las grasas y del aceite.
No todos los organismos tienen una capacidad natural de sintetizar glicerol. Sin embargo, la producción biológica de glicerol es conocida para algunas especies de bacterias, algas y levaduras. Las bacterias Bacillus licheniformis y Lactobacillus lycopersica sintetizan glicerol. La producción de glicerol se encuentra en las algas halotolerantes Dunaliella sp. y Asteromonas gracilis para la protección frente a concentraciones salinas externas elevadas (Ben-Amotz et al., (1982) Experientia 38:49-52). De manera similar, diversas levaduras osmotolerantes sintetizan glicerol como medida protectora. La mayoría de las cepas de Saccharomyces producen cierta cantidad de glicerol durante la fermentación alcohólica, y esto se puede incrementar fisiológicamente mediante la aplicación de estrés osmótico (Albertyn et al., (1994) Mol. Cell.Biol. 14, 4135-4144). En los primeros años de este siglo, el glicerol se produjo comercialmente con cultivos de Saccharomyces a los cuales se añadieron reactivos de dirección, tales como sulfitos o álcalis. Por medio de la formación de un complejo inactivo, los agentes de dirección bloquean o inhiben la conversión de acetaldehído a etanol; así, los equivalentes reductores (NADH) en exceso están disponibles o "se dirigen" hacia el dihidroxiacetona fosfato (DHAP) para la reducción para producir glicerol. Este método está limitado por la inhibición parcial del crecimiento de las levaduras debido a los sulfitos. Esta limitación se puede superar parcialmente mediante el uso de álcalis que crean equivalentes de NADH en exceso mediante un mecanismo diferente. En esta práctica, los álcalis inician una desproporción de Cannizzaro para producir etanol y ácido acético a partir de dos equivalentes de acetaldehído.
El gen que codifica glicerol-3-fosfato deshidrogenasa (DAR1,GPD1) ha sido clonado y secuenciado a partir de Saccharomyces diastaticus (Wang et al., (1994), J. Bact. 176:7091-7095). El gen DAR1 se clonó en un vector lanzadera y se usó para transformar E. coli, en donde la expresión produjo la enzima activa. Wang et al., anteriormente mencionado, reconoce que DAR1 está regulado por el medio osmótico celular, pero no propone cómo se podría usar el gen para incrementar la producción de glicerol en un organismo recombinante.
Se han aislado otras enzimas de glicerol-3-fosfato deshidrogenasa. Por ejemplo, sn-glicerol-3-fosfato deshidrogenasa ha sido clonada y secuenciada a partir de S. cerevisiae (Larason et al., (1993) Mol. Microbiol., 10:1101, (1993)). Albertyn et al., (1994) Mol. Cell. Biol. 14: 4135) enseñan la clonación de GPD1 que codifica una glicerol-3-fosfato deshidrogenasa de S. cerevisiae. Al igual que Wang et al., tanto Albertyn et al. como Larason et al. reconocen la osmo-sensibilidad de la regulación de este gen, pero no sugieren cómo se podría usar el gen en la producción de glicerol en un organismo recombinante.
Como con G3DPH, la glicerol-3-fosfatasa se ha aislado a partir de Saccharomyces cerevisiae, y se ha identificado que la proteína está codificada por los genes GPP1 y GPP2 (Norbeck et al., (1996) J. Biol. Chem. 271:13875). Al igual que los genes que codifican G3DPH, parece que GPP2 está osmóticamente inducido.
No existe técnica conocida que enseñe que la producción de glicerol a partir de organismos recombinantes con G3PDH/G3P fosfatasa se exprese junto o por separado. Tampoco existe técnica conocida que enseñe que la producción de glicerol a partir de cualquier organismo de tipo salvaje con estas dos actividades de enzima no requiere aplicar un cierto estrés (una sal o un osmolito) a la célula. Eustace ((1987), Can. J. Microbiol., 33:112-117)) enseñan conseguir la producción de glicerol mediante técnicas de ADN recombinante. Por técnicas de cultivo selectivas, estos investigadores crearon una cepa de levadura hibridada que producía glicerol a niveles más altos que las cepas parentales; sin embargo, la actividad de G3PDH permanecía constante o era ligeramente más baja.
Nevoight et al. (Yeast 12:1331-1337, 1996) describe que la sobre-expresión de glicerol-3-fosfato deshidrogenasa en Saccharomyces cerevisiae se puede combinar con un nivel incrementado de fosfatasas para la producción de glicerol.
Un microorganismo capaz de producir glicerol en condiciones fisiológicas es industrialmente deseable, en especial cuando el propio glicerol será utilizado como un sustrato in vivo como parte de una vía catabólica o biosintética más compleja que podría ser perturbada por el estrés osmótico o la adición de agentes de dirección.
Por lo tanto, el problema a resolver es cómo dirigir el flujo de carbono hacia la producción de glicerol mediante la adición o el refuerzo de determinadas actividades enzimáticas, en especial G3PDH y G3P fosfatasa que catalizan, respectivamente, la conversión de dihidroxiacetona fosfato (DHAP) en glicerol-3-fosfato (G3P) y luego en glicerol. Este procedimiento no ha sido descrito previamente para un organismo recombinante y requería el aislamiento de genes que codifiquen las dos enzimas y su expresión subsiguiente. Una dificultad sorprendente y no anticipada con la que se topó era la toxicidad de G3P fosfatasa al hospedante que requería un control cuidadoso de sus niveles de expresión para evitar la inhibición del crecimiento.
Sumario de la invención
La presente invención proporciona un método para la producción de glicerol a partir de un organismo recombinante, que comprende:
(i) transformar una célula de E.coli con una casete de expresión, que comprende:
(ii) cultivar la célula de E.coli de (i) en presencia de al menos una fuente de carbono seleccionada del grupo que consiste en monosacáridos, oligosacáridos, polisacáridos y sustratos de un solo carbono, con lo que se produce glicerol; y
(iii) recuperar el glicerol. La glucosa es la fuente de carbono más preferida.
La invención proporciona, además, células hospedantes de E. coli transformadas, que comprenden:
(a) un gen que codifica una enzima glicerol-3-fosfato deshidrogenasa NADH-dependiente o una enzima glicerol-3-fosfato deshidrogenasa NADH-dependiente; y
(b) un gen que codifica una enzima glicerol-3-fosfato fosfatasa.
Breve descripción de depósitos biológicos y listado de secuencias
La solicitante hizo los siguientes depósitos biológicos bajo los términos del Tratado de Budapest sobre el Reconocimiento Internacional del Depósito de Microorganismos para los Fines del Proceso de Patentes:
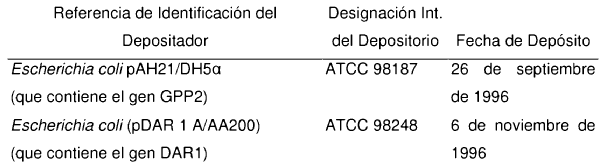
"ATCC" se refiere al depositario internacional American Type Culture Collection situado en 12301 Parklawn Drive, Rockville, MD 20852 EE.UU. La denominación se refiere al número de registro del material depositado.
La solicitante ha proporcionado 23 secuencias en conformidad con las Normas para la Representación Estándar de Secuencias de Nucleótidos y Aminoácidos en Solicitudes de Patente (Anexos I y II a la Decisión del Presidente de la EPO, publicados en el Suplemento nº 2 a OJ EPO, 12/1992) y con 37 C.F.R. 1.821-1.825 y Apéndices A y B (Requisitos para Descripciones de Solicitud que Contienen Secuencias de Nucleótidos y/o Aminoácidos).
Descripción...
Reivindicaciones:
1. Un método para la producción de glicerol a partir de un microorganismo recombinante, que comprende:
2. Un método de acuerdo con la reivindicación 1, en el que la fuente de carbono es glucosa.
3. Un método de acuerdo con la reivindicación 1, en el que el gen que codifica una enzima glicerol-3-fosfato deshidrogenasa NADH-dependiente o una enzima glicerol-3-fosfato deshidrogenasa NADPH-dependiente codifica la secuencia de aminoácidos dada en SEQ ID NO:7, SEQ ID NO:8 o SEQ ID NO: 10.
4. Un método de acuerdo con la reivindicación 1, en el que el gen que codifica una enzima de glicerol-3-fosfato fosfatasa codifica la secuencia de aminoácidos proporcionada en SEQ ID NO 13 o SEQ ID NO:14.
5. Una célula hospedadora transformada de E.coli, que comprende:
6. Una célula hospedadora de E. coli transformada de acuerdo con la reivindicación 5, en la que el gen que codifica una enzima de glicerol-3-fosfato fosfatasa codifica la secuencia de aminoácidos proporcionada en SEQ ID NO 13 o SEQ ID NO:14.
Patentes similares o relacionadas:
Métodos para la degradación o la conversión de polisacáridos de la pared celular vegetal, del 6 de Mayo de 2020, de NOVOZYMES, INC.: Metodo para degradar o convertir los polisacaridos de la pared celular vegetal en uno o mas azucares, que comprende: tratar los polisacaridos de la pared celular vegetal con […]
Método de producción de hidrocarburos y compuestos que contienen oxígeno a partir de biomasa que incluye fermentación con adición de aminoácidos (leu, ile, val), del 4 de Diciembre de 2019, de Bio Petroleum Limited: Un método de producción de hidrocarburos y compuestos que contienen oxígeno a partir de biomasa, que comprende las etapas de: preparación de un sustrato […]
Producción de aceites adaptados en microorganismos heterotróficos, del 27 de Mayo de 2019, de Corbion Biotech, Inc: Una célula del género Prototheca que comprende un gen exógeno, en donde el gen exógeno está en un ligamiento operable con un promotor, y codifica una acil-ACP tioesterasa […]
Fabricación de aceites personalizados en microorganismos heterotróficos recombinantes, del 15 de Mayo de 2019, de Corbion Biotech, Inc: Una composición de aceite de triglicéridos producida cultivando una población de células de Prototheca recombinantes y extraída de dichas células […]
Fermentación de azúcares de pentosa, del 24 de Enero de 2018, de DSM IP ASSETS B.V.: Célula huésped eucariótica transformada con un constructo de ácidos nucléicos que comprende una secuencia de nucleótidos, la cual a su vez codifica […]
Fermentación en ecosistemas gestionados (FEG) con rumen y una fuente de nitrógeno, del 23 de Agosto de 2017, de Integrated BioChem, LLC: Un método ex vivo de generación de recursos a partir de materias primas, comprendiendo el método: (a) fermentar una materia prima orgánica […]
Bacterias recombinantes que poseen la capacidad de metabolizar sacarosa, del 27 de Noviembre de 2015, de E.I. DU PONT DE NEMOURS AND COMPANY: Una bacteria recombinante que comprende en su genoma o en al menos una construcción recombinante: (a) una secuencia de nucleótidos heteróloga que codifica un polipéptido […]
Procedimiento para la preparación de ésteres alquílicos de ácidos grasos y acroleína a partir de triglicéridos, del 23 de Marzo de 2012, de EVONIK DEGUSSA GMBH: Procedimiento para la preparación de ésteres alquílicos de ácidos grasos de la fórmula general I: (I) y acroleína mediante reacción de triglicéridos […]