MÉTODO PARA PRODUCIR PROTEÍNAS GAMMA-CARBOXILADAS.
Una célula huésped eucariota que comprende al menos un vector de expresión que comprende:
una molécula de ácido nucleico que codifica una proteína que requiere gamma-carboxilación y secuencias control asociadas a la expresión que comprenden un primer promotor y una molécula de ácido nucleico que codifica una γ-glutamil carboxilasa y secuencias control asociadas a la expresión que comprenden un segundo promotor, en el que el primer promotor se selecciona de promotor temprano inmediato del citomegalovirus humano (hCMV), pEF-1α, pRSV o pUbC, y el segundo promotor se selecciona de promotor temprano inmediato de SV40, promotor FIX minimizado o promotor de quinasa timidina de HSV
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/SE2004/001453.
Solicitante: MEDIMMUNE LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: Milstein Building Granta Park Cambridge CB21 6GH.
Inventor/es: FENGE,Christel, LÖVGREN,Ann, THELIN,Anders.
Fecha de Publicación: .
Fecha Solicitud PCT: 12 de Octubre de 2004.
Clasificación Internacional de Patentes:
- C12N9/74 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Trombina.
- C12P21/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › que tienen una secuencia conocida de varios aminoácidos, p. ej. glutation.
Clasificación PCT:
- C12N9/64 C12N 9/00 […] › que provienen de tejido animal, p. ej. renina.
Clasificación antigua:
- C12N9/64 C12N 9/00 […] › que provienen de tejido animal, p. ej. renina.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357603_T3.pdf
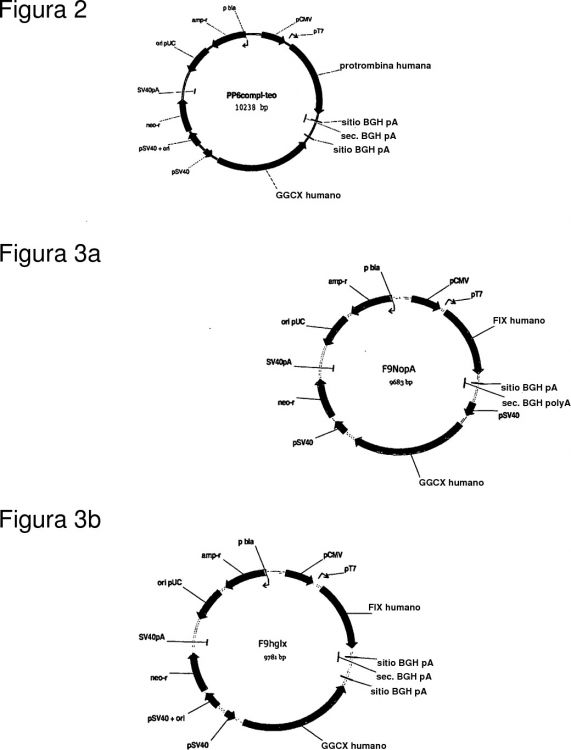
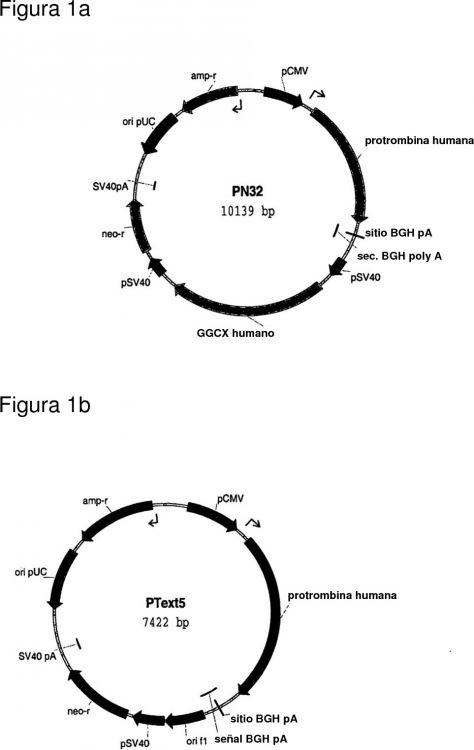
Fragmento de la descripción:
Campo técnico
La presente invención se refiere a una célula huésped que comprende un vector de expresión que comprende una molécula de ácido nucleico que codifica una proteína que requiere gamma-carboxilación y secuencias control asociadas a la expresión que comprenden un primer promotor y una molécula de ácido nucleico 5 que codifica una γ-glutamil carboxilasa y secuencias control asociadas a la expresión que comprenden un segundo promotor. La invención además se refiere a un método para producir una proteína que requiere gamma-carboxilación con altos rendimientos.
Antecedentes de la invención
El sangrado es un problema clínico común. Se da como consecuencia de enfermedad, traumatismo, cirugía 10 y tratamiento medicinal. Es urgente parar mecánicamente el sangrado. Esto puede ser difícil o incluso imposible debido a la localización del sangrado o porque difunda desde muchos vasos (pequeños). Los pacientes que están sangrando pueden requerir además un tratamiento con agentes que favorezcan la hemostasis. Pueden ser productos derivados de la sangre (hemoterapia), agentes que causen la liberación de agentes hemostáticos endógenos, factores de coagulación recombinantes (F), o agentes que retrasen la disolución de los coágulos de 15 sangre.
La primera línea de tratamiento entre los productos derivados de la sangre, a menudo obtenidos del hospital local, son sangre entera para la sustitución de volumen y apoyo de la hemostasis, glóbulos rojos empaquetados para la mejora de la capacidad del transporte de oxígeno, concentrados de plaquetas para hacer crecer el número de plaquetas (si es bajo o deficiente) y plasma congelado fresco para facilitar la hemostasis (coagulación de la sangre y 20 agregación de plaquetas). La segunda línea de productos derivados del plasma que facilitan la hemostasis son crioprecipitados de plasma, concentrados de complejo de protrombina, concentrados de complejo de protrombina activada y factores de coagulación purificados. Hoy en día están disponibles diversos factores de coagulación como proteínas recombinantes humanas, inactivos (factores de coagulación VIII y IX) y activados (factor de coagulación VIIa). 25
La hemofilia es un trastorno del sangrado hereditario o adquirido tanto con el factor de coagulación anormal o deficiente o anticuerpos dirigidos hacia un factor de coagulación que inhibe la función procoagulante. Las hemofilias más comunes son la hemofilia A (falta del factor de coagulación VIII) y la hemofilia B (factor IX). Los factores de coagulación simple purificados o recombinantes son el principal tratamiento de los pacientes con hemofilia. Los pacientes con anticuerpos inhibitorios presentan un problema con el tratamiento ya que también 30 pueden neutralizar el factor de coagulación que se administra al paciente. La forma activa de la proteína C (APC) es un inhibidor de la coagulación del plasma por degradación de los factores de coagulación Va y VIIIa activados. Se ha mostrado que la APC recombinante es un tratamiento eficaz de una indebida coagulación del plasma en pacientes con sépsis.
Los factores de coagulación para uso terapéutico se pueden obtener de plasma humano, aunque el 35 procedimiento de purificación no es simple y requiere de muchas etapas cuyos fines son, algunos, eliminar los virus contaminantes. Pero incluso con medidas de seguridad extensivas y la evaluación de productos derivados de la sangre, la contaminación con virus infecciosos o priones no puede descartarse. Debido a este riesgo, es muy deseable producir proteínas terapéuticas humanas a partir de células recombinantes cultivadas en medio sin componentes derivados de animales. Esto no siempre es inmediato ya que muchas proteínas requieren un huésped 40 mamífero para producirse en una forma totalmente funcional, es decir para modificarse correctamente post-translacionalmente. Entre los factores de coagulación producidos comercialmente en células recombinantes están FVII (NovoSeven), FVIII (Kogenate, Recombinate, Refacto) y FIX (BeneFix) (Roddie y Ludlam. Blood Rev. 11:169 - 177, 1997) y Proteína C Activa (Xigris). Uno de los principales obstáculos en la obtención de grandes cantidades de factores de coagulación humanos recombinantes completamente funcionales se basa en el dominio Gla presente en 45 FII, FVII, FIX, FX y proteína C. Este dominio contiene residuos de ácido glutámico que están modificados post-translacionalmente por la adición de grupos carboxilo. La producción de estos factores está dificultada por el hecho de que la sobre-expresión de estos da como resultado una proteína infra-carboxilada y, por lo tanto, inactiva. Las modificaciones Gla son el resultado de la acción de una enzima dependiente de la vitamina K denominada γ-glutamil carboxilasa (GGCX). Esta enzima ha sido estudiada extensivamente por muchos científicos, particularmente 50 aquellos implicados en la investigación del factor de coagulación (documento WO-A-8803926; Wu et al. Science 254(5038): 1634-1636, 1991; Rehemtulla et al., Proc Natl Acad Sci USA 90:4611-4615, 1993; Stanley J. Biol. Chem. 274(24):16940-16944, 1999; Vo et al., FEBS letters 445:256-260, 1999; Begley et al., The Journal of Biological Chemistry 275(46):36245-36249, 2000; Walker et al., The Journal of Biological Chemistry 276(11):7769-7774, 2001; Bandyopadhyay, et al. Proc Natl Acad Sci USA 99(3):1264-1269, 2002; Czerwiec et al., Eur J Biochem 269:6162-55 6172, 2002; Hallgren et al., Biochemistry 41(50):15045-15055, 2002; Harvey et al., The Journal of Biological Chemistry 278(10):8363-8369, 2003). Al menos dos grupos científicos han intentado enfoques para incrementar los rendimientos expresando conjuntamente GGCX con el factor de coagulación FIX, pero no tuvieron éxito (Rehemtulla, et al. 1993, ibid; Hallgren et al. 2002, ibid). Considerando el gran interés en las proteínas γ-carboxiladas, se puede asumir que han fallado muchos más ensayos de expresión conjunta y que por eso no han 60 sido publicados.
Para el FII humano (protrombina) al menos 8 de cada 10 residuos Glu tienen que modificarse correctamente para obtener completamente la protrombina funcional (Malhotra, et al., J. Biol. Chem. 260:279-287, 1985; Seegers y Walz 'Prothrombin and other vitamin K proteins', CRC Press, 1986). Se han realizado grandes esfuerzos en la obtención de unos altos niveles de producción de rhFII usando diversos sistemas diferentes tales como células CHO, células BHK, células 293 y sistemas de expresión de virus de vacuna, pero han fallado todos o 5 han dado como resultado un producto infra-carboxilado y por eso una protrombina funcionalmente inactiva (Jørgensen et al., J. Biol. Chem. 262:6729-6734, 1987; Russo et al., Biotechnol Appl Biochem 14(2):222-233, 1991; Fischer et al., J Biotechnol 38(2):129-136, 1995; Herlitschka et al. Protein Expr. Purif. 8(3):358-364, 1996; Russo et al., Protein Expr. Purif. 10:214-225, 1997; Vo et al. 1999, ibid; Wu y Suttie Thromb Res 96(2):91-98, 1999). Las primeras productividades publicadas para la protrombina recombinante carboxilada humana son bajas; 20 mg/L para 10 protrombina mutante (Côte et al., J. Biol. Chem 269:11374-11380, 1994), 0,55 mg/L para protrombina humana expresada en células CHO (completamente carboxilada, Jørgensen et al. 1987, ibid), 25 mg/L en células CHO (grado de carboxilación no mostrado, Russo et al. 1997, ibid).
El documento WO 92/19636 describe la clonación e identificación de la secuencia de una carboxilasa dependiente de la vitamina K humana y bovina. La solicitud sugiere la expresión conjunta de la carboxilasa 15 dependiente de la vitamina K y una proteína dependiente de la vitamina K en una célula huésped adecuada para preparar la proteína dependiente de la vitamina K. No se ilustra la expresión conjunta de la carboxilasa y la proteína dependiente de la vitamina K.
Son todavía necesarios mejores métodos para producir factores de coagulación de la sangre activados con altos rendimientos. La presente invención se establece para abordar esta necesidad. 20
Compendio de la invención
De acuerdo con un primer aspecto de la invención se proporciona una célula huésped eucariota que comprende un vector de expresión que comprende una molécula de ácido nucleico que codifica una proteína que requiere gamma-carboxilación y secuencias control asociadas a la expresión que comprenden un primer promotor y una molécula de ácido nucleico que codifica una γ-glutamil carboxilasa y secuencias control asociadas a la 25 expresión que comprenden un segundo promotor, en el que el primer promotor se selecciona de promotor temprano inmediato del citomegalovirus... [Seguir leyendo]
Reivindicaciones:
1. Una célula huésped eucariota que comprende al menos un vector de expresión que comprende:
una molécula de ácido nucleico que codifica una proteína que requiere gamma-carboxilación y secuencias control asociadas a la expresión que comprenden un primer promotor y
una molécula de ácido nucleico que codifica una γ-glutamil carboxilasa y secuencias control asociadas a la 5 expresión que comprenden un segundo promotor,
en el que el primer promotor se selecciona de promotor temprano inmediato del citomegalovirus humano (hCMV), pEF-1α, pRSV o pUbC, y
el segundo promotor se selecciona de promotor temprano inmediato de SV40, promotor FIX minimizado o promotor de quinasa timidina de HSV. 10
2. La célula huésped que se reivindica en la reivindicación 1, en la que las moléculas de ácido nucleico están dentro de un vector de expresión sencillo.
3. La célula huésped que se reivindica en la reivindicación 1 o 2, en la que el primer promotor es el promotor temprano inmediato del citomegalovirus humano (hCMV) y el segundo promotor es el promotor temprano de SV40. 15
4. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 3, en la que la proteína que requiere gamma-carboxilación se selecciona del grupo que consiste en: factor de coagulación VII, factor de coagulación IX, protrombina (factor de coagulación II), factor de coagulación X, proteína C, proteína S, proteína Z, proteína Bone Gla, proteína de Matriz Gla, proteína específica de detención del crecimiento 6 y proteína del tipo FXa de Acanthophiinae. 20
5. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 4, en la que la proteína que requiere gamma-carboxilación es un factor de coagulación dependiente de la vitamina K.
6. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 5, en la que la proteína que requiere gamma-carboxilación es el Factor IX.
7. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 5, en la que la proteína que 25 requiere gamma-carboxilación es el Factor X.
8. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 5, en la que la proteína que requiere gamma-carboxilación es la protrombina.
9. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 5, en la que la proteína que requiere gamma-carboxilación es la proteína C. 30
10. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 5, en la que la proteína que requiere gamma-carboxilación es el Factor VII.
11. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 10, en la que la proteína que requiere gamma-carboxilación es una proteína humana.
12. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 11, en la que la γ-glutamil 35 carboxilasa es una proteína humana.
13. Una célula como se reivindica en cualquiera de las reivindicaciones 1 a 12, en la que la célula se selecciona del grupo que consiste en: una célula de mamífero, célula de levadura o célula de insecto.
14. Una célula como se reivindica en la reivindicación 13, en la que la célula es una célula de mamífero. 40
15. Un vector que comprende una molécula de ácido nucleico que codifica una proteína que requiere gamma-carboxilación y secuencias control asociadas a la expresión que comprenden un primer promotor y una molécula de ácido nucleico que codifica una γ-glutamil carboxilasa y secuencias control asociadas a la expresión que comprenden un segundo promotor,
en el que el primer promotor se selecciona de promotor temprano inmediato del citomegalovirus humano (hCMV), 45 pEF-1α, pRSV o pUbC, y
el segundo promotor se selecciona de promotor temprano inmediato de SV40, promotor FIX minimizado o promotor de quinasa timidina de HSV.
16. Un vector como se reivindica en la reivindicación 15, en el que el primer promotor es el promotor temprano inmediato del citomegalovirus humano (hCMV) y el segundo promotor es el promotor temprano de SV40. 50
17. Un vector como se reivindica en la reivindicación 15 o 16, en elque la proteína que requiere gamma-carboxilación se selecciona del grupo que consiste en: factor de coagulación VII, factor de coagulación IX, protrombina (factor de coagulación II), factor de coagulación X, proteína C, proteína S, proteína Z, proteína Bone Gla, proteína de Matriz Gla, proteína específica de detención del crecimiento 6 y proteína del tipo FXa de Acanthophiinae. 5
18. Un vector como se reivindica en cualquiera de las reivindicaciones 15 a 17, en el que la proteína que requiere gamma-carboxilación es el Factor IX.
19. Un vector como se reivindica en cualquiera de las reivindicaciones 15 a 17, en el que la proteína que requiere gamma-carboxilación es el Factor X.
20. Un vector como se reivindica en cualquiera de las reivindicaciones 15 a 17, en el que la proteína 10 que requiere gamma-carboxilación es la protrombina.
21. Un vector como se reivindica en cualquiera de las reivindicaciones 15 a 17, en el que la proteína que requiere gamma-carboxilación es la proteína C.
22. Un vector como se reivindica en cualquiera de las reivindicaciones 15 a 17, en el que la proteína que requiere gamma-carboxilación es el Factor VII. 15
23. Un método para producir la proteína gamma-carboxilada que comprende:
(i) cultivar una célula eucariota que comprende al menos un vector de expresión que comprende una molécula de ácido nucleico que codifica una proteína que requiere gamma-carboxilación y secuencias control asociadas a la expresión que comprenden un primer promotor y
una molécula de ácido nucleico que codifica una γ-glutamil carboxilasa y secuencias control asociadas a la 20 expresión que comprenden un segundo promotor,
en el que el primer promotor se selecciona del promotor temprano inmediato del citomegalovirus humano (hCMV), pEF-1α, pRSV y pUbC, y
el segundo promotor se selecciona del promotor temprano inmediato de SV40, promotor FIX minimizado o promotor de quinasa timidina de HSV, y 25
(ii) aislar la proteína gamma-carboxilada.
24. Un método como se reivindica en la reivindicación 23, en el que la proteína gamma-carboxilada se selecciona del grupo que consiste en: factor de coagulación VII, factor de coagulación IX, protrombina (factor de coagulación II), factor de coagulación X, proteína C, proteína S, proteína Z, proteína Bone Gla, proteína de Matriz Gla, proteína específica de detención del crecimiento 6 y proteína del tipo FXa de Acanthophiinae. 30
25. Un método como se reivindica en la reivindicación 23 o 24, en el que la proteína que requiere gamma-carboxilación es un factor de coagulación dependiente de la vitamina K o su forma activada.
26. Un método como se reivindica en la reivindicación 23 o 25, en el que la proteína que requiere gamma-carboxilación es el Factor IX o su forma activada.
27. Un método como se reivindica en la reivindicación 23 o 25, en el que la proteína que requiere 35 gamma-carboxilación es el Factor X o su forma activada.
28. Un método como se reivindica en la reivindicación 23 o 25, en el que la proteína que requiere gamma-carboxilación es la protrombina o su forma activada.
29. Un método como se reivindica en la reivindicación 23 o 25, en el que la proteína que requiere gamma-carboxilación es la proteína C o su forma activada. 40
30. Un método como se reivindica en la reivindicación 23 o 25, en el que la proteína que requiere gamma-carboxilación es el Factor VII o su forma activada.
31. Un método para producir una composición farmacéutica adecuada para inducir la coagulación de la sangre o promover un incremento o decrecimiento de la coagulación, que comprende la etapas de
(i) expresar una proteína carboxilada activa en una célula huésped de acuerdo con la reivindicación 1, 45
(ii) purificar la proteína carboxilada activa, y
(iii) mezclar la proteína carboxilada purificada con uno o varios vehículos farmacéuticamente aceptables o excipientes.
Patentes similares o relacionadas:
Método para preparar una disolución acuosa que contiene medio de cultivo y agente quelante, del 22 de Julio de 2020, de Kyowa Kirin Co., Ltd: Método para preparar una disolución acuosa que presenta una filtrabilidad de membrana mejorada que comprende un medio de cultivo, en el que el medio de […]
PROCEDIMIENTO DE OBTENCIÓN DE SUBPRODUCTOS A PARTIR DE RESIDUOS DE CAFÉ Y APLICACIONES DE LOS MISMOS, del 13 de Julio de 2020, de UNIVERSIDAD DE GRANADA: Procedimiento de obtención de subproductos a partir de residuos de café y aplicaciones de los mismos. La presente invención consiste en un proceso […]
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Métodos para controlar la producción de proteasas, del 1 de Julio de 2020, de ROAL OY: Una célula hospedadora que comprende al menos un gen cromosómico inactivado en donde el gen cromosómico inactivado comprende una secuencia de ácido nucleico que codifica un […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Proceso para la purificación de daptomicina, del 6 de Mayo de 2020, de Cubist Pharmaceuticals LLC: Un método para purificar daptomicina que comprende: a) someter a la daptomicina a condiciones en las que una solución micelar de daptomicina se forma alterando el pH; y […]
Lipopéptidos de alta pureza, micelas de lipopéptidos y procesos para preparar los mismos, del 6 de Mayo de 2020, de Cubist Pharmaceuticals LLC: Un método para purificar daptomicina a partir de moléculas o agregados de alto peso molecular, en donde la daptomicina se proporciona en forma micelar, dicho […]
Métodos para ajustar los niveles de producción de carotenoides y composiciones en géneros de Rhodosporidium y Rhodotorula, del 15 de Abril de 2020, de TEMASEK LIFE SCIENCES LABORATORY LIMITED: Un método para ajustar el nivel de producción y la composición de carotenoides en un huésped fúngico que comprende: (a) manipular genéticamente […]