Implante de retina y prótesis visual que incorpora tal implante.
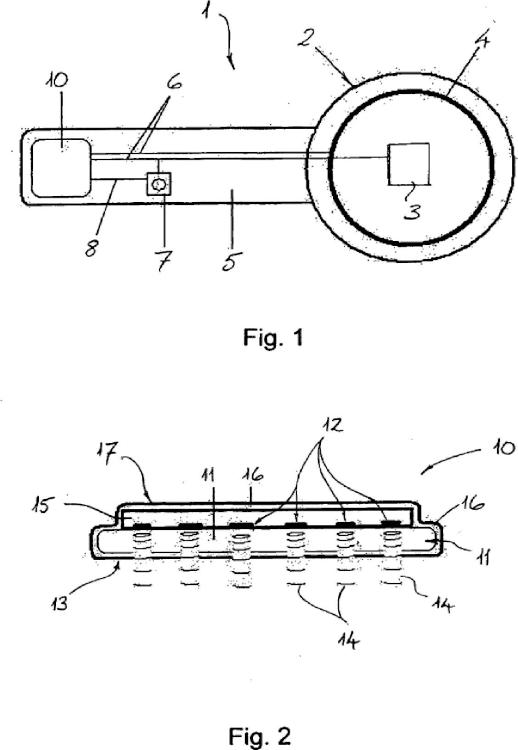
Prótesis de retina que comprende una parte interna (1) configurada para implantarse en el ojo de un sujeto y situarse sobre la retina o junto a la misma,
comprendiendo la parte interna (1) un sustrato (11), caracterizada porque la parte interna (1) comprende además múltiples fuentes de luz (12) dispuestas en una matriz sobre el sustrato (11),estando configurada cada una de las fuentes de luz (12) para que emita radiación infrarroja con el fin de estimular células nerviosas de la retina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2010/002112.
Solicitante: Pixium Vision SA.
Nacionalidad solicitante: Francia.
Dirección: 74 rue du Faubourg Saint Antoine 75012 Paris FRANCIA.
Inventor/es: TIEDTKE, HANS-JURGEN, DAPPER,MARCUS, KLAVER,TOM.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61F9/08 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › A61F 9/00 Métodos o dispositivos para el tratamiento de los ojos; Dispositivos para colocar las lentes de contacto; Dispositivos para corregir el estrabismo; Aparatos para guiar a los ciegos; Dispositivos protectores de los ojos que se llevan sobre el cuerpo o en la mano (gorras con medios para la protección de los ojos A42B 1/0181; viseras para cascos A42B 3/22; baños para los ojos A61H 35/02; gafas de sol o de protección con las mismas características que las gafas normales G02C). › Dispositivos o métodos que permitan al paciente ver mediante la sustitución de la percepción visual directa por otro tipo de percepción.
- A61N1/36 A61 […] › A61N ELECTROTERAPIA; MAGNETOTERAPIA; RADIOTERAPIA; TERAPIA POR ULTRASONIDOS (medida de corrientes bioeléctricas A61B; instrumentos quirúrgicos, dispositivos o métodos para transferir formas no mecánicas de energía hacia o desde el cuerpo A61B 18/00; aparatos de anestesia en general A61M; lámparas incandescentes H01K; radiadores de infrarrojos utilizados como calefactores H05B). › A61N 1/00 Electroterapia; Circuitos correspondientes (A61N 2/00 tiene prioridad; preparaciones conductoras de la electricidad que se utilizan en terapia o en examen in vivo A61K 50/00). › para estimular, p. ej. marcapasos.
PDF original: ES-2552765_T3.pdf
Patentes similares o relacionadas:
Dispositivos de estimulación para tratar la sequedad ocular, del 15 de Julio de 2020, de Oculeve, Inc: Dispositivo para suministrar un estímulo eléctrico a la mucosa nasal de un paciente, que comprende: una sonda de estimulador que comprende una punta de inserción […]
UN DISPOSITIVO PARA CORREGIR EL BRUXISMO DEL SUEÑO, MEDIANTE LA UTILIZACIÓN DE UN SISTEMA DE ESTIMULACIÓN ELÉCTRICA DEL NERVIO MENTONIANO, del 2 de Julio de 2020, de UNIVERSIDAD DE CONCEPCION: Un dispositivo para corregir el bruxismo de! sueño, mediante la utilización de un sistema de estimulación eléctrica del nervio mentoniano, el cual […]
Dispositivo de neuroestimulación multisegmental invasiva efectiva, del 1 de Julio de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Dispositivo de estimulación de las neuronas, que comprende - una unidad de estimulación implantable en el cuerpo de un paciente con una […]
Antena para implantes y aparatos y procedimientos asociados, del 17 de Junio de 2020, de CAMBRIDGE CONSULTANTS LIMITED: Un procedimiento para diseñar una antena para un dispositivo de implante para implante en un cuerpo humano o animal, comprendiendo […]
Aparato y métodos para ayudar a respirar, del 27 de Mayo de 2020, de Apellis Holdings, LLC: Un aparato que comprende: (a) un sensor adecuado para detectar cuándo un sujeto exhala; y (b) un dispositivo adaptado para suministrar […]
 Dispositivo para el tratamiento de las condiciones del sistema nervioso central utilizando un estímulo sensorial, del 27 de Mayo de 2020, de Phoenix NeuroStim Therapeutics, LLC: Un dispositivo de neuromodulación cerebral, que comprende:
al menos un estimulador configurado para proporcionar un estímulo sensorial […]
Dispositivo para el tratamiento de las condiciones del sistema nervioso central utilizando un estímulo sensorial, del 27 de Mayo de 2020, de Phoenix NeuroStim Therapeutics, LLC: Un dispositivo de neuromodulación cerebral, que comprende:
al menos un estimulador configurado para proporcionar un estímulo sensorial […]
Órtesis de estimulación, del 6 de Mayo de 2020, de COMPEX MEDICAL S.A: Sistema para tratamiento de estimulación eléctrica del cuerpo de un usuario, comprendiendo el sistema: una órtesis ortopédica que presenta […]
APARATO DE ESTIMULACIÓN BILATERAL, del 30 de Abril de 2020, de CEBALLOS RUIZ, Ana Maria: Aparato de estimulación bilateral caracterizado porque comprende: - Una caja o carcasa exterior donde se alojan todos los componentes en su interior […]