Fucosiltransferasas novedosas y sus aplicaciones.
Una célula anfitriona para la producción de un oligosacárido fucosilado,
conteniendo la célula anfitriona una secuencia que consiste en un polinucleótido que codifica un polipéptido con actividad alfa-1,2-fucosiltransferasa y que comprende una secuencia seleccionada del grupo que consiste en, a) el SEQ ID NO: 1 de la lista de secuencias adjunta, b) una secuencia de ácido nucleico complementaria al SEC ID NO: 1, o c) secuencias de ácidos nucleicos que hibridan en condiciones rigurosas con las secuencias de ácido nucleico definidas en a) y b) o sus cadenas complementarias, en donde la secuencia es una secuencia foránea para la célula anfitriona y en donde la secuencia se integra en el genoma de la célula anfitriona, o que contiene un vector que comprende dicho polinucleótido, en donde la secuencia de ácido nucleico está conectada operativamente a secuencias de control reconocidas por una célula anfitriona transformada con el vector.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E11151571.
Solicitante: Jennewein Biotechnologie GmbH.
Nacionalidad solicitante: Alemania.
Dirección: Maarweg 32 53619 Rhienbrettbach ALEMANIA.
Inventor/es: ELLING, LOTHAR, DR., PARKOT,JULIA, HÜFNER,ERIC, JENNEWEIN,STEFAN, ENGELS,LEONIE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N9/10 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Transferasas (2.) (ribonucleasas C12N 9/22).
- C12P19/18 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › preparados por acción de una transferasa glicosílica, p. ej. alfa-, beta- o gamma-ciclodextrinas.
- C12P21/00 C12P […] › Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00).
PDF original: ES-2439507_T3.pdf
Fragmento de la descripción:
Fucosiltransferasas novedosas y sus aplicaciones La presente invención se refiere a una nueva fucosiltransferasa y sus aplicaciones.
Muchas (glico) proteínas, (glico) lípidos u oligosacáridos requieren la presencia de estructuras fucosiladas concretas, con el fin de exhibir una actividad biológica particular. Por ejemplo, muchos mecanismos de reconocimiento intercelular requieren un oligosacárido fucosilado: p. ej., con el fin de unirse mediante moléculas de adherencia celular, tales como la L-selectina, estructuras celulares específicas tienen que comprender carbohidratos fucosilados. Otro ejemplo de estructuras fucosiladas que tiene una función biológica son las estructuras que forman el sistema de grupos sanguíneos AB0. Por otra parte, las (glico) proteínas terapéuticas representan la clase de más rápido crecimiento de los reactivos farmacéuticos, por lo que sus propiedades farmacocinéticas y su estabilidad se atribuyen a sus glicanos.
Debido a su naturaleza compleja y propiedades químicas inherentes, la síntesis química de productos glicoconjugados es un gran desafío y se asocia con importantes dificultades. A diferencia de las proteínas y los ácidos nucleicos, para los que están disponibles en el mercado sintetizadores automáticos, los glicanos - y dejando solos los productos glicoconjugados - no pueden (todavía) ser sintetizados usando un sistema comercial general. Además del requerimiento de control de la estereoquímica, sigue siendo difícil la formación de vínculos específicos.
En vista de la complejidad asociada con la química o la síntesis enzimática/química combinada de los productos glicoconjugados, enfoques recientes han utilizado glicosiltransferasas para sintetizar enzimáticamente (glico) proteínas y (glico) lípidos que comprenden los residuos de oligosacáridos.
Las fucosiltransferasas, que pertenecen a la familia enzimática de las glicosiltransferasas, se expresan ampliamente en vertebrados, invertebrados, plantas y bacterias. Catalizan la transferencia de un residuo de fucosa de un donador, generalmente guanosina-difosfato fucosa (GDP-fucosa) a un aceptor, que incluye oligosacáridos, (glico) proteínas y (glico) lípidos. Los sustratos aceptores fucosilados de este modo están implicados en una variedad de procesos biológicos y patológicos.
Basándose en el sitio de la adición de fucosa, las fucosiltransferasas se clasifican en alfa-1, 2 -, alfa-1, 3/4- y Ofucosiltransferasas. Se han identificado varias alfa-1, 2-fucosiltransferasas, p. ej., en las bacterias Helicobacter pylori y Escherichia coli, en mamíferos, Caenorhabditis elegans y Schistosoma mansoni, así como en plantas. La mayoría de estas enzimas puede no expresarse ya sea en una forma activa en sistemas bacterianos, o puede no utilizar lactosa como aceptor.
Liu et al. ("Sequencing and analysis of the Escherichia coli serogroup 0117, 0126, and O146 O-antigen gene clusters and development of PCR assays targeting serogroup 0117-, O126-, and 0146-specific DNA sequences", MOLECULAR AND CELLULAR PROBES 21 (2007) 295-302) describen la secuenciación e identificación de agrupaciones de genes de antígeno O de serogrupos O117, O126, y O146 de Escherichia coli. Liu et al. también describen que el serogrupo O126 de Escherichia coli contiene naturalmente un gen que tiene una identidad de 42%/ similitud de 57% con los genes de la glicosiltransferasa de Salmonella enterica.
Albermann et al. ("Synthesis of the milk oligosaccharide 2'-fucosyllactose using recombinant bacterial enzymes", CARBOHYDRATE RESEARCH 334 (2001) 97-103) describen la síntesis del oligosacárido de la leche 2'-fucosil lactosa utilizando enzimas bacterianas recombinantes con secuencias específicas de Helicobacter pylori.
Del un modo similar, el documento EP 1 275 714 A1 describe procesos y células para la producción de un carbohidrato complejo que contiene fucosa, cuyas células incorporan fucosiltransferasa recombinante de Bacteroides fragilis.
En los mamíferos, la GDP-fucosa se sintetiza en el citoplasma a través síntesis de novo y la ruta salvaje. Con la síntesis de novo, la GDP-manosa se convierte en el GDP-fucosa a través de dos enzimas, mientras que la ruta salvaje utiliza la fucosa citosólica libre como sustrato. En la célula, la GDP-fucosa se concentra en vesículas y es reconocida por fucosiltransferasas como sustrato donador. Sin embargo, la expresión funcional heteróloga de las glicosiltransferasas eucarióticas, y en particular las fucosiltransferasas resultó difícil en sistemas de expresión procarióticos. Los oligosacáridos de mamíferos y en particular de seres humanos tales como los HMO no son conocidos a partir de fuentes procarióticas, haciendo así extremadamente improbable el descubrimiento de las glicosiltransferasas que elaboran estos oligosacáridos.
Puesto que la actividad biológica de muchos oligosacáridos, (glico) proteínas y (glico) lípidos comercialmente importantes depende de la presencia de determinados residuos de fucosa, existe una necesidad en el estado de la técnica de sintetizar o producir de manera eficiente productos glicoconjugados que tengan el residuo o los residuos de oligosacárido deseados.
Por lo tanto, un objeto de la presente invención es proporcionar herramientas y métodos por medio de los cuales se puedan producir sustratos fucosilados de forma eficaz con ahorro de tiempo y coste, que produzca altas cantidades del sustrato deseado.
De acuerdo con la invención, este objeto se resuelve, entre otras cosas, por el uso de un polinucleótido recombinante o sintético, aislado que codifica un polipéptido con actividad alfa-1, 2-fucosiltransferasa y que comprende una secuencia o que consiste en una secuencia seleccionada del grupo que consiste en:
a) el SEC ID NO: 1 de la lista de secuencias adjunta; b) una secuencia de ácido nucleico complementaria al SEC ID NO: 1; c) secuencias de ácidos nucleicos que hibridan en condiciones rigurosas con las secuencias de ácidos nucleicos definidas en a) y b) o sus cadenas complementarias.
El polinucleótido usado en la invención (véase el SEQ ID NO: 1) representa una fucosiltransferasa de la especie Escherichia coli serogrupo 0126.
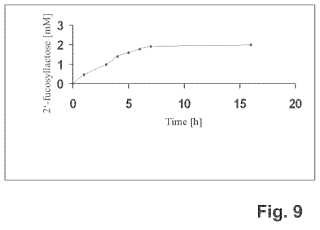
La fucosiltransferasa tiene efectos sorprendentes ya que mediante su uso se pueden realizar reacciones que no son de origen natural en el organismo fuente: Dentro del alcance de la presente invención se ha encontrado que la alfa1, 2-fucosiltransferasa anteriormente identificada es capaz de utilizar lactosa como sustrato y es capaz de producir oligosacáridos fucosilados, en particular, 2'-fucosil lactosa. Hasta la fecha, no se ha demostrado que ninguna de las alfa-1, 2-fucosiltransferasas conocidos aisladas de bacterias utilice la lactosa como sustrato natural para la producción de fucosil lactosa. Por lo tanto, la idoneidad de la fucosiltransferasa recientemente identificada que se va a utilizar para la producción de oligosacáridos fucosilados es altamente sorprendente, y, por lo tanto, su uso representa una excelente herramienta para producir fácilmente, eficazmente y con ahorro de coste, p. ej., oligosacáridos de leche humana (HMO) , tales como fucosil lactosa. Hoy en día, se han caracterizado estructuralmente más de 80 compuestos pertenecientes a los HMO; representan una clase de oligosacáridos complejos que funcionan como prebióticos. Además, la homología estructural de los HMO con epítopos epiteliales explica las propiedades de protección contra los patógenos bacterianos. Dentro del tracto gastrointestinal de lactantes, los HMO fomentan selectivamente el crecimiento de cepas de bacterias seleccionadas y están, por lo tanto, cebando el desarrollo de una microbiota intestinal única en lactantes amamantados con leche materna.
Dado que, hasta ahora, la complejidad estructural de estos oligosacáridos ha impedido su producción sintética, la principal fuente de los HMO sigue siendo la leche humana. Por lo tanto, existe una necesidad de HMO obtenibles rápida y fácilmente, que puedan ser proporcionados mediante el uso de la -sorprendentemente adecuada - fucosiltransferasa presentada en la presente memoria.
De acuerdo con la presente invención, los términos "polinucleótido o polinucleótidos" se refieren generalmente a cualquier polirribonucleótido o polidesoxirribonucleótido, que puede ser ARN o ADN no modificado o ARN o ADN modificado. "Polinucleótido o polinucleótidos" incluyen, sin limitación, ADN de cadena sencilla o doble, ADN que es una mezcla de regiones de cadena sencilla o doble, o regiones de cadena sencilla, doble y triple, ARN de cadena sencilla y doble, y ARN que es una mezcla de regiones de cadena sencilla y doble, moléculas híbridas que comprenden ADN y ARN que puede ser de cadena sencilla o, más típicamente,... [Seguir leyendo]
Reivindicaciones:
1. Una célula anfitriona para la producción de un oligosacárido fucosilado, conteniendo la célula anfitriona una secuencia que consiste en un polinucleótido que codifica un polipéptido con actividad alfa-1, 2-fucosiltransferasa y que comprende una secuencia seleccionada del grupo que consiste en, a) el SEQ ID NO: 1 de la lista de secuencias adjunta, b) una secuencia de ácido nucleico complementaria al SEC ID NO: 1, o c) secuencias de ácidos nucleicos que hibridan en condiciones rigurosas con las secuencias de ácido nucleico definidas en a) y b) o sus cadenas complementarias, en donde la secuencia es una secuencia foránea para la célula anfitriona y en donde la secuencia se integra en el genoma de la célula anfitriona, o que contiene un vector que comprende dicho polinucleótido, en donde la secuencia de ácido nucleico está conectada operativamente a secuencias de control reconocidas por una célula anfitriona transformada con el vector.
2. La célula anfitriona de acuerdo con la reivindicación 1, caracterizada porque la célula anfitriona se selecciona del grupo que consiste en células de hongos, incluyendo levaduras, bacterias, insectos, animales y vegetales.
3. La célula anfitriona, de acuerdo con las reivindicaciones 1 o 2, caracterizada porque la célula anfitriona es una célula de Escherichia coli.
4. La célula anfitriona, de acuerdo con una de las reivindicaciones 1 a 3, caracterizada porque el ácido nucleico que codifica el polipéptido con actividad alfa-1, 2-fucosiltransferasa se adapta al uso del codón de la célula respectiva.
5. El uso de un polinucleótido que codifica un polipéptido con actividad alfa-1, 2-fucosiltransferasa y que comprende
una secuencia seleccionada del grupo que consiste en: a) el SEQ ID NO: 1 de la lista de secuencias adjunta; b) una secuencia de ácido nucleico complementaria al SEC ID NO: 1; c) secuencias de ácidos nucleicos que hibridan en condiciones rigurosas con las secuencias de ácido nucleico definidas en a) y b) o sus cadenas complementarias,
(a) la secuencia de aminoácidos mostrada en el SEQ ID NO: 2; b) una secuencia de aminoácidos de una variante alélica de la secuencia de aminoácidos mostrada en el SEQ ID NO: 2, en donde dicha variante alélica es codificada por una molécula de ácido nucleico que hibrida en condiciones rigurosas con la cadena opuesta de una molécula de ácido nucleico mostrada en el SEQ ID NO: 1; c) una secuencia de aminoácidos de un ortólogo de una secuencia de aminoácidos mostrada en el SEQ ID NO: 2, en donde dicho ortólogo es codificado por una molécula de ácido nucleico que hibrida en condiciones rigurosas con la cadena opuesta de la molécula de ácido nucleico mostrada en el SEQ ID NO: 1; y
(d) un fragmento de la secuencia de aminoácidos mostrada en el SEQ ID NO: 2, en donde dicho fragmento
comprende al menos 10 aminoácidos contiguos, para la producción de un oligosacárido fucosilado.
6. El uso de acuerdo con la reivindicación 5, caracterizado porque la producción de dicho oligosacárido fucosilado se lleva a cabo por medio de una expresión heteróloga u homóloga del polinucleótido que codifica la alfa-1, 2fucosiltransferasa, en donde la secuencia es una secuencia foránea a la célula anfitriona.
7. Uso de acuerdo con la reivindicación 5 o 6, caracterizado porque el oligosacárido fucosilado es un oligosacárido conocido de la leche humana.
8. Uso de acuerdo con la reivindicación 7, caracterizado porque el oligosacárido fucosilado es l.
2. fucosil lactosa.
9. Un método para la producción de oligosacáridos fucosilados que comprende las etapas de: a) proporcionar un polipéptido con actividad alfa-1, 2-fucosiltransferasa que consiste en una secuencia de aminoácidos seleccionada del grupo que consiste de (a) la secuencia de aminoácidos mostrada en el SEQ ID NO: 2, b) una secuencia de aminoácidos de una variante alélica de la secuencia de aminoácidos mostrada en el SEQ ID NO: 2, en donde dicha variante alélica es codificada por una molécula de ácido nucleico que hibrida en condiciones rigurosas con la cadena opuesta de una molécula de ácido nucleico mostrada en el SEQ ID NO: 1, c) una secuencia de aminoácidos de un ortólogo de una secuencia de aminoácidos mostrada en el SEQ ID NO: 2, en donde dicho ortólogo es codificado por una molécula de ácido nucleico que hibrida en condiciones rigurosas con la cadena opuesta de la molécula de ácido nucleico mostrada en el SEQ ID NO: 1, y (d) un fragmento de la secuencia de aminoácidos mostrada en el SEQ ID NO: 2, en donde dicho fragmento comprende al menos 10 aminoácidos contiguos, b) poner en contacto el polipéptido con actividad alfa-1, 2-fucosiltransferasa de la etapa a. con una mezcla que comprende un sustrato donador que comprende un residuo de fucosa, y un sustrato aceptor que comprende un
mono- u oligosacárido o en condiciones en las que el polipéptido cataliza la transferencia de un residuo de fucosa del sustrato donador al sustrato aceptor, produciendo de este modo un oligosacárido fucosilado.
10. Un método para la producción de oligosacáridos fucosilados que comprende las etapas de:
a) cultivar, en condiciones nutrientes adecuadas permisivas para la producción del oligosacárido fucosilado, y permisivas para la expresión de un polipéptido con actividad alfa-1, 2-fucosiltransferasa, una célula anfitriona como se reivindica en las reivindicaciones 1 a 4; b) proporcionar simultáneamente o posteriormente a la etapa a. un sustrato donador que comprende un residuo de fucosa y un sustrato aceptor que comprende un mono- u oligosacárido, para que el polipéptido de alfa-1, 2
fucosiltransferasa catalice la transferencia de un residuo de fucosa del sustrato donador al sustrato aceptor, produciendo de este modo un oligosacárido fucosilado; y c) aislar dicho oligosacárido fucosilado de la célula anfitriona o de su medio de crecimiento.
11. El método de acuerdo con la reivindicación 9 o 10, caracterizado porque el sustrato donador es la GDP-fucosa. 15
12. El método de acuerdo con la reivindicación 11, caracterizado porque la GDP-fucosa es proporcionada por una enzima expresada de forma simultánea en la célula anfitriona o por el metabolismo de la célula anfitriona.
Secuencia del gen que codifica la alfa-1, 2-fucosiltransferasa WbgL de E. coli O126 (SEQ ID NO: 1)
Secuencia del polipéptido/proteína de WbgL (SEQ ID NO: 2)
Patentes similares o relacionadas:
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Microorganismo con productividad de l-lisina aumentada y procedimiento para producir l-lisina utilizando el mismo, del 27 de Mayo de 2020, de CJ CHEILJEDANG CORPORATION: Una subunidad beta prima (subunidad-β') mutante de la ARN polimerasa, en la que la subunidad beta prima (subunidad-β') mutante de la ARN polimerasa tiene […]
Reducción de sacarosa y generación de fibra insoluble en zumos, del 27 de Mayo de 2020, de DANISCO US INC: Un método para producir una bebida baja en calorías y alta en fibras insolubles comprendiendo; tratamiento de una bebida que contiene sacarosa con una glucosiltransferasa para […]
Una célula acetogénica genéticamente modificada, del 13 de Mayo de 2020, de Evonik Operations GmbH: Una célula microbiana acetogénica que es capaz de producir al menos un alcohol superior a partir de una fuente de carbono, en donde la célula microbiana acetogénica está genéticamente […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 6 de Mayo de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: 1. Una dextransacarasa que consiste en una secuencia que tiene el 90 %, el 95 % o el 98 % de similitud de secuencia con una secuencia de aminoácidos seleccionada del fragmento […]
Fábrica de células bacterianas modificadas genéticamente para la producción de tiamina, del 22 de Abril de 2020, de Biosyntia ApS: Bacteria modificada genéticamente para la producción de tiamina no fosforilada; en la que dicha bacteria se caracteriza por tener transgenes […]
Producción mejorada de ácidos grasos y derivados de ácidos grasos por microorganismos recombinantes, del 22 de Abril de 2020, de EXXONMOBIL RESEARCH AND ENGINEERING COMPANY: Una cianobacteria recombinante transformada con una secuencia de ácido nucleico no originario que codifica una acil-ACP tioesterasa procedente de una planta superior, unida […]
Células virales resistentes y sus usos, del 22 de Abril de 2020, de Sigma-Aldrich Co. LLC: Una línea celular de ovario de hámster chino (CHO) modificada genéticamente en la que la entrada y/o propagación del virus diminuto del ratón (MVM) […]