Formulación en polvo seco inhalable que comprende GLP-1 para usar en el tratamiento de la hiperglucemia y diabetes por administración pulmonar.
Una formulación de polvo seco inhalable que comprende una cantidad terapéuticamente eficaz de una molécula de péptido similar al glucagón de tipo 1 (GLP-1) para uso en la administración pulmonar en el tratamiento de hiperglucemia y/o diabetes en un paciente por administración prandial de dicha formulación,
en la que la formulación previene o reduce efectos adversos seleccionados del grupo consistente en náuseas, vómitos y sudoración profusa.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/081218.
Solicitante: MANNKIND CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 28903 NORTH AVENUE PAINE VALENCIA, CA 91355 ESTADOS UNIDOS DE AMERICA.
Inventor/es: RICHARDSON, PETER, COSTELLO,DONALD, BAUGHMAN,ROBERT A.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/495 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen ciclos con seis eslabones con dos nitrógenos como únicos heteroátomos de un ciclo, p. ej. piperazina (A61K 31/48 tiene prioridad).
- A61K38/26 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Glucagón.
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61P3/10 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 3/00 Medicamentos para el tratamiento de trastornos del metabolismo (de la sangre o de fluido extracelular A61P 7/00). › para la hiperglucemia, p.ej. antidiabéticos.
PDF original: ES-2547529_T3.pdf



Fragmento de la descripción:
Formulación en polvo seco inhalable que comprende GLP-1 para usar en el tratamiento de la hiperglucemia y diabetes por administración pulmonar
CAMPO TÉCNICO
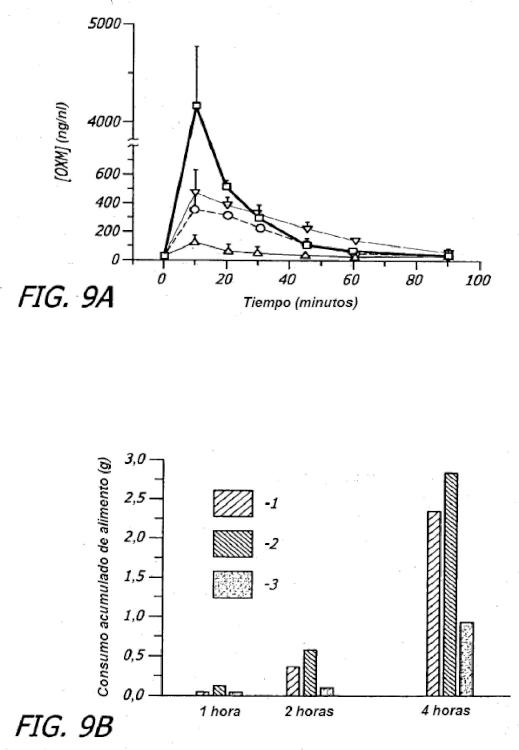
Se da a conocer en la presente memoria una composición para uso en un método para prevenir o reducir efectos adversos tales como sudoración profusa, náuseas y vómitos que están normalmente asociados a la administración subcutánea e intravenosa de terapia de péptido similar al glucagón de tipo 1 (GLP-1) . En particular, el método comprende la administración de GLP-1 a la circulación pulmonar tal como mediante inhalación en los capilares alveolares pulmonares usando un sistema de suministro de fármaco en polvo seco.
ANTECEDENTES
Los sistemas de suministro de fármaco para el tratamiento de enfermedades que introducen ingredientes activos en la circulación son numerosos e incluyen administración oral, transdérmica, subcutánea e intravenosa. Aunque estos sistemas se han usado durante bastante tiempo y pueden suministrar suficiente medicación para el tratamiento de muchas enfermedades, existen numerosos desafíos asociados a estos mecanismos de suministro de fármaco. En particular, el suministro de cantidades eficaces de proteínas y péptidos para tratar una enfermedad diana ha sido problemático. Están implicados muchos factores en la introducción de la cantidad correcta de agente activo, por ejemplo, la preparación de la formulación de suministro de fármaco apropiada para que la formulación contenga una cantidad de agente activo que alcance su sitio o sitios diana de acción a una cantidad eficaz.
El agente activo debe ser estable en la formulación de suministro de fármaco y la formulación debería permitir la absorción del agente activo en la circulación y que permanezca activo de modo que pueda alcanzar el sitio o sitios de acción a niveles terapéuticos eficaces. Por tanto, en la técnica farmacológica, son de la máxima importancia sistemas de suministro de fármaco que puedan suministrar un agente activo estable.
Elaborar formulaciones de suministro de fármaco terapéuticamente adecuadas para tratar enfermedades depende de las características del ingrediente o agente activo para suministrar al paciente. Dichas características pueden incluir de manera no limitante pH, estabilidad, toxicidad, velocidad de liberación y facilidad de expulsión del cuerpo por procesos fisiológicos normales. Por ejemplo, en la administración oral, si el agente es sensible a ácido, se han desarrollado recubrimientos entéricos que usan materiales farmacéuticamente aceptables que pueden prevenir que el agente activo se libere al pH bajo (ácido) del estómago. Por tanto, se usan polímeros que no son solubles a pH ácido para formular y suministrar una dosis que contiene agentes sensibles a ácido al intestino delgado, donde el pH es neutro. A pH neutro, el recubrimiento polimérico puede disolverse liberando el agente activo, que se absorbe entonces en la circulación sistémica entérica. Los agentes activos administrados por vía oral entran en la circulación sistémica y pasan a través del hígado. En ciertos casos, se metaboliza y/o desactiva cierta porción de la dosis en el hígado antes de alcanzar los tejidos diana. En algunas ocasiones, los metabolitos pueden ser tóxicos para el paciente o pueden producir efectos secundarios indeseados.
De forma similar, la administración subcutánea e intravenosa de agentes farmacéuticamente activos no está desprovista de degradación e inactivación. Con la administración intravenosa de fármacos, los fármacos o ingredientes activos pueden metabolizarse también, por ejemplo en el hígado, antes de alcanzar el tejido diana. Con la administración subcutánea de ciertos agentes activos, incluyendo diversas proteínas y péptidos, existe adicionalmente una degradación y desactivación por las enzimas del tejido periférico y vascular en el sitio de suministro de fármaco durante el recorrido a través de la corriente sanguínea venosa. Para suministrar una dosis que produzca una cantidad aceptable para tratar enfermedades con la administración subcutánea e intravenosa de un agente activo, los regímenes de dosificación tendrán siempre que contar con la inactivación del agente activo por tejido venoso periférico y vascular y en última instancia el hígado.
SUMARIO
Se da a conocer una composición para uso en un método para prevenir o reducir efectos adversos tales como sudoración profusa, náuseas y vómitos que están asociados normalmente a la administración subcutánea e intravenosa de terapia de péptido similar al glucagón de tipo 1 (GLP-1) . En particular, la composición para uso comprende GLP-1 administrado a la circulación pulmonar tal como por inhalación en capilares alveolares pulmonares usando un sistema de suministro de fármaco en polvo seco.
En una realización, se proporciona un método para el tratamiento de hiperglucemia y/o diabetes en un paciente que comprende la etapa de administrar de forma prandial a un paciente necesitado de tratamiento una formulación de polvo seco inhalable que comprende una cantidad terapéuticamente eficaz de una molécula de GLP-1; en el que la administración no da como resultado al menos un efecto secundario seleccionado del grupo consistente en náuseas, vómitos y sudoración profusa.
En otra realización, el paciente es un mamífero que padece diabetes sacarina de tipo 2. En otra realización, la formulación de GLP-1 comprende de aproximadamente 0, 5 mg a aproximadamente 3 mg de GLP-1 en la
formulación. En aún otra realización, la formulación de polvo seco inhalable comprende adicionalmente un inhibidor de DPP-IV.
En una realización, se proporciona una composición para uso en la reducción de los niveles de glucosa en un paciente diabético de tipo 2 que padece hiperglucemia, comprendiendo el método la etapa de administrar al paciente necesitado de tratamiento una formulación de polvo seco inhalable para administración pulmonar que comprende una cantidad terapéuticamente eficaz de GLP-1, y una dicetopiperazina o sal farmacéuticamente aceptable de la misma.
En otra realización, la formulación de polvo seco inhalable comprende una dicetopiperazina. En otra realización, la dicetopiperazina es 2, 5-diceto-3, 6-di (4-X-aminobutil) piperazina; en la que X se selecciona del grupo de succinilo, glutarilo, maleilo y fumarilo; o una sal farmacéuticamente aceptable de la misma.
En otra realización, la molécula de GLP-1 se selecciona del grupo consistente en un GLP-1 nativo, un metabolito de GLP-1, un derivado de GLP-1, un GLP-1 de acción prolongada, un mimético de GLP-1, una exendina o un análogo de los mismos o combinaciones de los mismos.
En otra realización, el método comprende adicionalmente administrar una formulación que comprende un análogo de GLP-1 de acción prolongada.
En otra realización, la formulación de polvo seco inhalable carece de inhibición del vaciado gástrico.
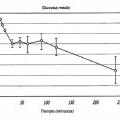
En otra realización, los niveles de glucosa se reducen en aproximadamente 0, 1 mmol/l a aproximadamente 3 mmol/l durante un periodo de aproximadamente 4 horas después de la administración de la formulación inhalable al paciente. En otra realización, la formulación inhalable se administra al paciente diabético de tipo 2 de forma prandial, preprandial, prandial, postprandial o en estado de ayuno. En otra realización, la formulación de GLP-1 comprende de aproximadamente 0, 02 mg a aproximadamente 2 mg de GLP-1 en la formulación.
En una realización, se proporciona un kit para el tratamiento de diabetes y/o hiperglucemia que comprende: a) un cartucho de medicamento configurado operativamente para encajar en un inhalador de polvo seco y que contiene una formulación de polvo seco que comprende una molécula de GLP-1 y una dicetopiperazina de fórmula: 2, 5diceto-3, 6-di (4-X-aminobutil) piperazina; en la que X se selecciona del grupo consistente en succinilo, glutarilo, maleilo y fumarilo o una sal de los mismos, y b) un dispositivo de inhalación configurado operativamente para aceptar/mantener y fijar con seguridad el cartucho.
En otra realización, se proporciona un kit para el tratamiento de hiperglucemia en un paciente diabético de tipo 2 que comprende un sistema de suministro pulmonar de fármaco que comprende: a) un cartucho de medicamento configurado operativamente para encajar en un inhalador de polvo seco y que contiene una formulación de polvo seco que comprende una molécula de GLP-1 y una dicetopiperazina de fórmula: 2, 5-diceto-3, 6-di (4-Xaminobutil) piperazina; en la que X se selecciona del grupo consistente en succinilo, glutarilo, maleilo y fumarilo o una sal de los mismos, y b) un dispositivo de inhalación configurado operativamente para adaptar... [Seguir leyendo]
Reivindicaciones:
1. Una formulación de polvo seco inhalable que comprende una cantidad terapéuticamente eficaz de una molécula de péptido similar al glucagón de tipo 1 (GLP-1) para uso en la administración pulmonar en el tratamiento de hiperglucemia y/o diabetes en un paciente por administración prandial de dicha formulación, en la que la formulación previene o reduce efectos adversos seleccionados del grupo consistente en náuseas, vómitos y sudoración profusa.
2. La formulación para uso según la reivindicación 1, en la que el paciente es un mamífero que padece diabetes sacarina de tipo 2.
3. La formulación para uso según la reivindicación 1, en la que la formulación de GLP-1 comprende de 0, 01 a 3 mg de GLP-1 en la formulación.
4. La formulación para uso según la reivindicación 1, en la que la formulación de polvo seco inhalable comprende un inhibidor de DPP-IV.
5. La formulación para uso según la reivindicación 1, en la que la formulación de polvo seco inhalable comprende una dicetopiperazina que tiene la fórmula 2, 5-diceto-3, 6-di (4-X-aminobutil) piperazina y en la que X se selecciona del grupo consistente en glutarilo, maleilo y fumarilo, o una sal farmacéuticamente aceptable de la misma.
6. La formulación para uso según la reivindicación 1, en la que la molécula de GLP-1 se selecciona del grupo consistente en un GLP-1 nativo, un metabolito de GLP-1, un análogo de GLP-1, un derivado de GLP-1, un mimético de GLP-1, una exendina, un análogo peptídico de GLP-1 o un análogo biosintético de GLP-1, o combinaciones de los mismos.
7. La formulación para uso según la reivindicación 1, en la que la formulación de polvo seco inhalable que comprende la molécula de GLP-1 comprende adicionalmente una cantidad terapéuticamente eficaz de una molécula de insulina.
8. La formulación para uso según la reivindicación 1, en la que la molécula de insulina se va a administrar separadamente, en forma de una formulación en polvo seco inhalable, de la formulación de la reivindicación 1.
9. La formulación para uso según la reivindicación 1, en la que la formulación de polvo seco inhalable carece de inhibición del vaciado gástrico.
10. La formulación para uso según la reivindicación 7 u 8, en que la insulina es una insulina de acción rápida o de acción prolongada.
11. Una formulación de polvo seco inhalable que comprende una cantidad terapéuticamente eficaz de una molécula de péptido similar al glucagón de tipo 1 (GLP-1) para uso en la administración pulmonar en el tratamiento de hiperglucemia y/o diabetes en un paciente por administración prandial de dicha formulación, en la que la formulación se proporciona en un kit,
en la que el kit comprende:
a) un cartucho de medicamento configurado operativamente para ajustarse a un inhalador de polvo seco y que contiene la formulación de polvo seco inhalable y b) un dispositivo de inhalación configurado operativamente para aceptar/mantener y fijar con seguridad dicho cartucho;
y en la que la formulación previene o reduce efectos adversos seleccionados del grupo consistente en náuseas, vómitos y sudoración profusa.
12. Uso de una formulación de polvo seco inhalable que comprende una cantidad terapéuticamente eficaz de una molécula de péptido similar al glucagón de tipo 1 (GLP-1) en la fabricación de un kit para el tratamiento de diabetes y/o hiperglucemia en un paciente por administración prandial, en el que el kit comprende:
a) un cartucho de medicamento configurado operativamente para ajustarse a un inhalador de polvo seco y que contiene la formulación de polvo seco inhalable y b) un dispositivo de inhalación configurado operativamente para aceptar/mantener y fijar con seguridad dicho cartucho;
en el que la formulación es para administración pulmonar y en el que la formulación previene o reduce efectos adversos seleccionados del grupo consistente en náuseas, vómitos y sudoración profusa.
13. Una formulación inhalable de polvo seco para uso en la reducción de los niveles de glucosa en un paciente diabético de tipo 2 que padece hiperglucemia, en la que la formulación es para administración pulmonar y comprende una cantidad terapéuticamente eficaz de GLP-1 y una dicetopiperazina o una sal farmacéuticamente aceptable de la misma.
14. La formulación para uso según la reivindicación 13, en la que la formulación es para administración junto con un análogo de GLP-1 de acción prolongada.
15. La formulación para uso según la reivindicación 13, en la que los niveles de glucosa se reducen en 0, 1 mmol/l a 3 mmol/l durante un periodo de aproximadamente 4 horas después de la administración de dicha formulación inhalable a dicho paciente.
16. La formulación para uso según la reivindicación 13, en la que la formulación inhalable es para administrar a dicho paciente diabético de tipo 2 de forma prandial, preprandial, postprandial o en estado de ayuno.
17. La formulación para uso según la reivindicación 13, en la que la formulación de GLP-1 comprende de 0, 02 a 2 mg de GLP-1 en la formulación.
Patentes similares o relacionadas:
Análogos de (E)-N''-(1-feniletiliden) benzohidrazida sustituida como inhibidores de desmetilasas de histonas, del 15 de Julio de 2020, de UNIVERSITY OF UTAH RESEARCH FOUNDATION: Un compuesto que tiene una estructura representada por una fórmula: **(Ver fórmula)** en donde m es 1; n es un número entero de 0 a […]
Antagonista del receptor NK1, del 27 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Un compuesto representado por la fórmula (I): **(Ver fórmula)** donde W es un átomo de hidrógeno o un átomo de flúor; el anillo A es un […]
Formulación granular compleja con estabilidad mejorada, que comprende levocetirizina y montelukast, del 13 de Mayo de 2020, de HANMI PHARM. CO., LTD.: Una formulación granular compleja que comprende: (a) una primera parte granular que comprende levocetirizina o una sal farmacéuticamente aceptable de la misma, ciclodextrina […]
Composiciones y compuestos terapéuticos, del 6 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un compuesto de Fórmula (I) o una sal del mismo farmacéuticamente aceptable, en donde: **(Ver fórmula)** A es arilo o heteroarilo, en donde el arilo o heteroarilo […]
Composiciones farmacéuticas para terapia de combinación, del 29 de Abril de 2020, de Acesion Pharma ApS: Una combinación de (i) un inhibidor del canal de potasio (SK) activado por calcio de pequeña conductancia, o una sal o solvato farmacéuticamente aceptable de este; […]
Combinaciones de inhibidores de histona desacetilasa y fármacos inmunomoduladores, del 29 de Abril de 2020, de Acetylon Pharmaceuticals, Inc: Una combinación farmacéutica para su uso en el tratamiento del linfoma que comprende una cantidad terapéuticamente eficaz de un inhibidor específico de histona desacetilasa […]
Formulaciones farmacéuticas de liberación controlada de nitazoxanida, del 15 de Abril de 2020, de ROMARK LABORATORIES, L.C.: Composición farmacéutica en forma de una forma de dosificación oral sólida que comprende: (a) una primera parte que comprende una primera […]
Composiciones congeladas fluidas que comprenden un agente terapéutico, del 8 de Abril de 2020, de Tavakoli, Zahra: Una composición fluida congelada que comprende un agente terapéutico y al menos un agente aromatizante para su uso en terapia, donde dicha composición […]