FORMA NO EFERVESCENTE DE NAPROXENO DE SODIO QUE COMPRENDE ENTRE OTROS HIDROGENOCARBONATO DE SODIO.
Comprimido no efervescente para la administración oral de naproxeno de sodio,
que comprende un núcleo de comprimido y, si se desea, un recubrimiento de azúcar o de película sobre dicho núcleo de comprimido, en el que el núcleo de comprimido consiste en entre 30 y 95% en peso de naproxeno de sodio, sobre la base del peso del núcleo de comprimido, y entre 70 y 5% en peso de componente de agente auxiliar, sobre la base del peso del núcleo de comprimido, comprendiendo dicho componente de agente auxiliar uno o más agentes auxiliares básicos seleccionados de entre sales básicas de metales alcalinos, sales básicas de metales alcalinotérreos, sales básicas de amonio y aminoácidos básicos, en una cantidad total, por lo menos, del 5%, sobre la base del peso del núcleo de comprimido, en el que el naproxeno de sodio presenta un contenido en agua del 0,05 al 14% en peso, medido como pérdida por secado a 105ºC
Tipo: Resumen de patente/invención. Número de Solicitud: W04000655CH.
Solicitante: BAYER CONSUMER CARE AG.
Nacionalidad solicitante: Suiza.
Dirección: PETER MERIAN-STRASSE 84,4052 BASEL.
Inventor/es: GRUBER, PETER, DR., SIEGMUND, MARTIN.
Fecha de Publicación: .
Fecha Concesión Europea: 16 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/192 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen grupos aromáticos, p. ej. sulindac, ácidos 2-aril-propiónicos, ácido etacrínico.
- A61K9/20H2
Clasificación PCT:
- A61K31/192 A61K 31/00 […] › que tienen grupos aromáticos, p. ej. sulindac, ácidos 2-aril-propiónicos, ácido etacrínico.
- A61K9/20 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Píldoras, pastillas o comprimidos.
Clasificación antigua:
- A61K31/192 A61K 31/00 […] › que tienen grupos aromáticos, p. ej. sulindac, ácidos 2-aril-propiónicos, ácido etacrínico.
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
Fragmento de la descripción:
Forma no efervescente de naproxeno de sodio que comprende entre otros hidrogenocarbonato de sodio.
La presente invención se refiere a una formulación de comprimido no efervescente para la administración oral de naproxeno de sodio y a un procedimiento para la preparación del mismo.
El naproxeno, es decir el ácido (S)-2-(6-metoxi-2-naftil)propiónico, es un medicamento conocido con propiedades analgésicas, antiflogísticas y antipiréticas, que se utiliza particularmente para el tratamiento de enfermedades inflamatorias y contra el dolor, tal como enfermedades reumáticas, dolor de cabeza, migraña, dolor de muelas, dolor de espalda, dolores musculares, dolor postoperatorio y similares. El efecto extendido del naproxeno en dolores de cabeza prolongados y dolores musculares y articulares continuados constituye una ventaja particular.
Otro punto esencial, particularmente en el tratamiento del dolor, es el hecho de alcanzar una rápida iniciación del efecto. A efectos de alcanzar dicho efecto, el ingrediente activo debe ser rápidamente liberado y absorbido, lo cual, en el caso de formas de dosificación sólidas, requiere además que las mismas se desintegren rápidamente en el tracto gastrointestinal. Por otro lado, las formas de dosificación sólidas deben ser suficientemente pequeñas para poder ser tragadas sin problemas.
Sin embargo, las formulaciones deben contener agentes auxiliares adecuados en cantidades suficientes, de tal modo que las formulaciones puedan ser comprimidas con los instrumentos habituales de preparación de comprimidos, no se adhieran a los mismos, y den lugar a comprimidos de desintegración rápida con una dureza suficiente. Además, el hecho de alcanzar una rápida iniciación del efecto se ve dificultado por el hecho de que el naproxeno es prácticamente insoluble en un medio ácido, particularmente en los ácidos gástricos, por lo que la disolución y resorción del ingrediente activo se puede retrasar considerablemente.
En consecuencia, se han llevado a cabo intentos de mejorar la solubilidad del naproxeno ácido.
En consecuencia, en el documento WO 97/18245 se ha preparado un complejo de naproxeno (forma acídica) y ß-ciclodextrina. Sin embargo, la proporción entre el ingrediente activo y la ß-ciclodextrina es tan desfavorable que no se pueden preparar comprimidos tragables a partir del mismo. Además, no existe ninguna seguridad de que, in vivo, el naproxeno se libere suficientemente rápido por disolución del complejo de ß-ciclodextrina y se absorba. En cualquier caso, se debe asumir que la liberación del naproxeno a partir del complejo está sometida a considerables fluctuaciones en función de las condiciones de pH, concentraciones iónicas, etc., en el tracto gastrointestinal.
En el documento DE 4410470 se describe una composición de naproxeno con 0,8-1,5 mol de arginina y 0-0,7 mol de agente auxiliar básico, ambas cantidades sobre la base de 1 mol de naproxeno. Las formas farmacológicas preferentes consisten en granulados, que se disuelven en agua antes de ser tomados. A pesar del pH básico de la solución, se forma progresivamente una sal correspondiente a partir del naproxeno. Definitivamente, este proceso de disolución no tiene lugar de este modo con el correspondiente comprimido en el estómago, en presencia de ácidos gástricos. Dado que los agentes auxiliares son muy solubles en agua, preferentemente se tamponan frente a los ácidos gástricos antes de liberar en solución el naproxeno de baja solubilidad. Además, una formulación de este tipo da lugar a comprimidos muy grandes y difíciles de tragar, y resulta muy costosa a consecuencia de la adición de 0,8-1,5 equivalentes molares de arginina.
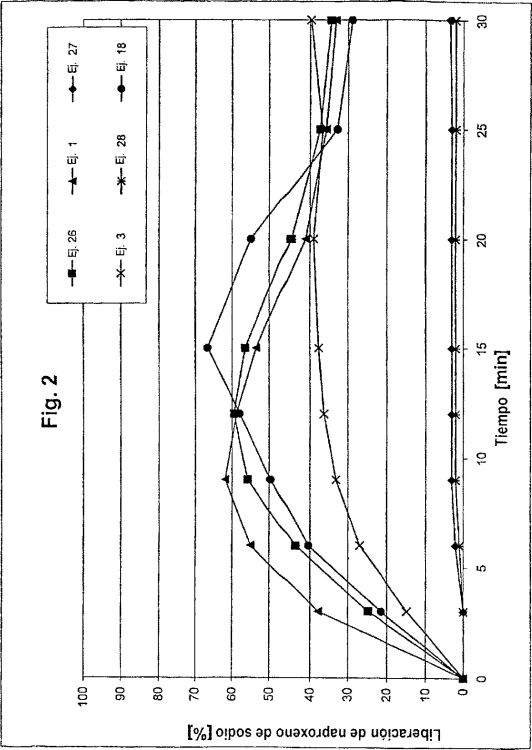
En consecuencia, en el mercado se pueden encontrar ya comprimidos recubiertos de película, que contienen la sal sódica de naproxeno en presencia de agentes auxiliares habituales en el núcleo de comprimido, tales como celulosa microcristalina, desintegrantes y estearato de magnesio. Sin embargo, la liberación de ingrediente activo es muy pobre a un pH de 1,2 (véase figura 2 y ejemplo 27).
Además, se ha intentado mejorar adicionalmente la compresibilidad y la solubilidad del naproxeno a través del secado por pulverización de naproxeno o naproxeno de sodio (US nº 5.470.580). Sin embargo, también se han generado comprimidos con naproxeno de sodio y manitol secado por pulverización (CA 2363528), en los que el manitol secado por pulverización mejora supuestamente de modo parecido el proceso de disolución del ingrediente activo.
En el documento US 2002/187195 se describen cápsulas blandas de gelatina que contienen polietilenglicol, propionato de sodio y un codisolvente, tal como dimetilisosorbide. Se mencionan la aspirina o el naproxeno como ingredientes activos preferentes.
El documento WO 0013672 (NANOSYSTEMS, US) da a conocer una formulación de naproxeno nanopartIculado en dosis sólida efervescente con una velocidad elevada de disolución, que comprende: (a) naproxeno con un tamaño de partícula promedio efectivo de menos de aproximadamente 600 nm; (b) un modificador de superficie adsorbido sobre la superficie del mismo; y (c) un agente alcalino farmacéuticamente aceptable, en el que dicho agente alcalino actúa aumentando la velocidad de disolución del naproxeno nanoparticulado tras la administración.
El documento EP 0274734 (PHARMIDEA SRL) se refiere a un comprimido para uso farmacéutico capaz de liberar sustancia activa en veces sucesivas, que comprende por lo menos: una primera capa que contiene una parte de la sustancia activa con excipientes adecuados, una capa de barrera de material polimérico gelificable y/o soluble en agua y/o líquidos acuosos, que se interpone entre dicha primera capa y una tercera capa que contiene la parte restante de sustancia activa con excipientes adecuados, alojándose dicha capa de barrera y dicha tercera capa en una cápsula que consiste en material polimérico impermeable e insoluble en agua y/o soluble en un entorno alcalino.
Todas las formulaciones descritas anteriormente adolecen, además de los inconvenientes ya mencionados, el inconveniente principal de que se ha prestado poca atención a la dependencia del proceso de disolución de las condiciones fisiológicas del estómago y a la consecución de una disolución reproducible. Así, por ejemplo, el naproxeno de sodio precipita inmediatamente en presencia de ácido en forma de masa grasa hidrofóbica, que retrasa el proceso de desintegración posterior del núcleo de comprimido, así como el proceso de disolución del ingrediente activo. En lugar de ello, la forma ácida, hidrofóbica, grasa, precipitada del naproxeno forma progresivamente cristales de naproxeno que, sin embargo, se disuelven demasiado lentamente en la transición al duodeno y con el aumento resultante del pH en el mismo. A pesar de que el naproxeno se disuelve rápidamente a un pH de 7,4 por formación de la sal, en el duodeno no se alcanzan valores de pH de 7. Este hecho tiene como consecuencia que el naproxeno se disuelve progresivamente solo en las regiones más profundas del intestino y, en consecuencia, no es posible alcanzar una rápida acumulación del nivel de ingrediente activo.
En consecuencia, el objetivo de la presente invención consiste en dar a conocer una formulación de comprimido fabricable técnicamente factible que permita una rápida liberación y resorción del ingrediente activo y que, sin embargo, permita tamaños de comprimido comparativamente pequeños.
Dicho objetivo se alcanza mediante la reivindicación 1.
La sal sódica de naproxeno puede estar presente en las formulaciones de comprimido según la presente invención en forma esencialmente deshidratada o en forma de hidrato, por ejemplo como dihidrato; típicamente, el contenido en agua de la sal sódica de naproxeno puede ser aproximadamente de 0,05 a 14% en peso, sobre la base del peso del hidrato. El componente de agente auxiliar puede contener uno o más agentes auxiliares básicos, siendo por lo menos su cantidad total, sobre la base del peso del núcleo de comprimido, aproximadamente del 5% en peso.
Sorprendentemente, se ha puesto de manifiesto que la capacidad del naproxeno de sodio de ser conformado en comprimidos depende de su contenido en agua y que, contrariamente a la opinión habitual, es posible preparar comprimidos con una dureza suficiente y un tiempo de desintegración suficientemente breve que, además de naproxeno de sodio, únicamente debe contener una pequeña proporción de agente auxiliar básico, si se utiliza un naproxeno de sodio con un contenido en agua comprendido entre 0,05 y 14% en peso,...
Reivindicaciones:
1. Comprimido no efervescente para la administración oral de naproxeno de sodio, que comprende un núcleo de comprimido y, si se desea, un recubrimiento de azúcar o de película sobre dicho núcleo de comprimido, en el que el núcleo de comprimido consiste en entre 30 y 95% en peso de naproxeno de sodio, sobre la base del peso del núcleo de comprimido, y entre 70 y 5% en peso de componente de agente auxiliar, sobre la base del peso del núcleo de comprimido, comprendiendo dicho componente de agente auxiliar uno o más agentes auxiliares básicos seleccionados de entre sales básicas de metales alcalinos, sales básicas de metales alcalinotérreos, sales básicas de amonio y aminoácidos básicos, en una cantidad total, por lo menos, del 5%, sobre la base del peso del núcleo de comprimido, en el que el naproxeno de sodio presenta un contenido en agua del 0,05 al 14% en peso, medido como pérdida por secado a 105ºC.
2. Comprimido según la reivindicación 1, en el que el núcleo de comprimido consiste en entre 60 y 95% en peso de naproxeno de sodio y entre 40 y 5% en peso de componente de agente auxiliar, sobre la base del peso del núcleo de comprimido.
3. Comprimido según cualquiera de las reivindicaciones 1 a 2, en el que el núcleo de comprimido consiste en entre 70 y 93% en peso de naproxeno de sodio y entre 30 y 7% en peso de componente de agente auxiliar, sobre la base del peso del núcleo de comprimido.
4. Comprimido según cualquiera de las reivindicaciones 1 a 3, en el que el naproxeno de sodio presenta un contenido en agua del 6 al 12,5% en peso.
5. Comprimido según cualquiera de las reivindicaciones 1 a 4, en el que el componente de agente auxiliar comprende uno o más agentes auxiliares básicos en una cantidad total del 10 al 30% en peso, sobre la base del peso del núcleo de comprimido.
6. Comprimido según cualquiera de las reivindicaciones 1 a 5, en el que el componente de agente auxiliar comprende uno o más agentes auxiliares básicos en una cantidad total del 15 al 25% en peso, sobre la base del peso del núcleo de comprimido.
7. Comprimido según cualquiera de las reivindicaciones 1 a 6, en el que el agente auxiliar básico es soluble en agua.
8. Comprimido según cualquiera de las reivindicaciones 1 a 7, en el que el agente auxiliar básico se selecciona de entre hidrogenocarbonato de sodio, hidrogenocarbonato de potasio, carbonato de sodio, carbonato de potasio, citrato de trisodio y fosfato de trisodio.
9. Comprimido según cualquiera de las reivindicaciones 1 a 8, en el que el agente auxiliar básico se selecciona de entre hidrogenocarbonato de sodio e hidrogenocarbonato de potasio.
10. Comprimido según cualquiera de las reivindicaciones 1 a 9, en el que el componente de agente auxiliar comprende una o más sustancias de relleno entre neutras y débilmente ácidas que mejoran la compresibilidad.
11. Comprimido según cualquiera de las reivindicaciones 1 a 10, en el que el componente de agente auxiliar comprende una o más sustancias de relleno solubles en agua entre neutras y débilmente ácidas que mejoran la compresibilidad.
12. Comprimido según cualquiera de las reivindicaciones 1 a 11, en el que el componente de agente auxiliar comprende una o más sustancias de relleno seleccionadas de entre azúcares, hexosas, almidones hidrolizados o divididos enzimáticamente, ciclodextrinas, polivinilpirrolidona no reticulada, sales de metales alcalinos entre neutras y débilmente ácidas, sales de metales alcalinotérreos de neutras a débilmente ácidas, y sales de amonio entre neutras y débilmente ácidas.
13. Comprimido según cualquiera de las reivindicaciones 1 a 12, en el que el componente de agente auxiliar comprende una o más sustancias de relleno seleccionadas de entre hexosas, polivinilpirrolidona no reticulada, maltodextrina y cloruro de sodio.
14. Comprimido según cualquiera de las reivindicaciones 1 a 13, en el que el componente de agente auxiliar comprende polivinilpirrolidona no reticulada como sustancia de relleno.
15. Comprimido según cualquiera de las reivindicaciones 1 a 14, en el que el componente de agente auxiliar comprende una o más sustancias de relleno no solubles en agua que mejoran la compresibilidad y la desintegración del comprimido.
16. Comprimido según cualquiera de las reivindicaciones 1 a 15, en el que el componente de agente auxiliar comprende una o más sustancias de relleno, seleccionadas de entre celulosas nativas y microcristalinas, almidones, almidones modificados, fosfatos de calcio y óxido de silicio.
17. Comprimido según cualquiera de las reivindicaciones 10 a 16, en el que la proporción de sustancia de relleno está comprendida entre el 3 y el 30% en peso, sobre la base del peso del núcleo de comprimido.
18. Comprimido según cualquiera de las reivindicaciones 10 a 17, en el que la proporción de sustancia de relleno está comprendida entre el 10 y el 25% en peso, sobre la base del peso del núcleo de comprimido.
19. Comprimido según cualquiera de las reivindicaciones 1 a 18, en el que el componente de agente auxiliar básico comprende, por lo menos, un agente auxiliar básico seleccionado de entre hidrogenocarbonato de sodio e hidrogenocarbonato de potasio, y polivinilpirrolidona no reticulada como sustancia de relleno.
20. Comprimido según cualquiera de las reivindicaciones 1 a 19, en el que el componente de agente auxiliar básico comprende, sobre la base del peso del núcleo de comprimido, de 5 a 20% en peso de agente auxiliar básico, seleccionado de entre hidrogenocarbonato de sodio e hidrogenocarbonato de potasio, y de 5 a 20% en peso de polivinilpirrolidona no reticulada como sustancia de relleno.
21. Comprimido según cualquiera de las reivindicaciones 1 a 20, en el que el componente de agente auxiliar comprende un desintegrante.
22. Comprimido según cualquiera de las reivindicaciones 1 a 21, en el que el componente de agente auxiliar comprende un desintegrante seleccionado de entre croscarmelosa, crospovidona y almidón carboximetílico de sodio reticulado.
23. Comprimido según cualquiera de las reivindicaciones 1 a 22, en el que el componente de agente auxiliar comprende uno o más lubricantes y/o deslizantes.
24. Comprimido según cualquiera de las reivindicaciones 1 a 20, en el que el núcleo de comprimido no contiene ningún lubricante y no contiene ningún deslizante.
25. Comprimido según cualquiera de las reivindicaciones 1 a 24, en el que el componente de agente auxiliar contiene uno o más tensoactivos iónicos o no iónicos.
26. Comprimido según cualquiera de las reivindicaciones 1 a 25, en el que el componente de agente auxiliar contiene uno o más tensoactivos seleccionados de entre laurilsulfato de sodio, dodecilsulfato de sodio, polisorbato y monopalmitato de sacarosa.
27. Comprimido según la reivindicación 25 a 26, en el que la proporción de tensoactivo es del 0,1 al 5% en peso, sobre la base del peso del núcleo de comprimido.
28. Comprimido según cualquiera de las reivindicaciones 1 a 27, en el que el núcleo de comprimido consiste en un granulado con una distribución de tamaño de gránulo comprendida entre 0,25 y 1,25 mm.
29. Comprimido según cualquiera de las reivindicaciones 1 a 28, en el que la dureza del núcleo de comprimido es, por lo menos, de 30 N.
30. Comprimido según cualquiera de las reivindicaciones 1 a 29, con un contenido de naproxeno de sodio comprendido entre 110 y 660 mg, sobre la base del naproxeno de sodio deshidratado.
31. Comprimido según cualquiera de las reivindicaciones 1 a 9 y 28 a 30, en el que el núcleo de comprimido consiste en naproxeno de sodio y agente auxiliar básico.
32. Comprimido según la reivindicación 1, que comprende naproxeno de sodio, hidrogenocarbonato de sodio, celulosa microcristalina, croscarmelosa, talco y estearato de magnesio.
33. Comprimido según la reivindicación 32, que comprende de 50 a 60% en peso de naproxeno de sodio, de 15 a 25% en peso de hidrogenocarbonato de sodio, de 15 a 25% en peso de celulosa microcristalina, de 2 a 6% en peso de croscarmelosa, de 1 a 5% en peso de talco, y de 0,5 a 2,2% en peso de estearato de magnesio.
34. Comprimido según la reivindicación 32, que comprende de 55 a 65% en peso de naproxeno de sodio, de 10 a 25% en peso de hidrogenocarbonato de sodio, de 2 a 15% en peso de celulosa microcristalina, de 2 a 6% en peso de croscarmelosa, de 1 a 5% en peso de talco, y de 0,5 a 2,2% en peso de estearato de magnesio.
35. Comprimido según la reivindicación 34, que comprende de 55 a 65% en peso de naproxeno de sodio, de 10 a 25% en peso de hidrogenocarbonato de sodio, de 5 a 10% en peso de hidroxipropilcelulosa, de 2 a 15% en peso de celulosa microcristalina, de 2 a 6% en peso de croscarmelosa, de 1 a 5% en peso de talco, y de 0,5 a 2,2% en peso de estearato de magnesio.
Patentes similares o relacionadas:
 Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Composición y método para la reparación y regeneración del músculo, del 29 de Julio de 2020, de THOMAS JEFFERSON UNIVERSITY: Un agonista de receptor gamma de ácido retinoico (RARγ) para uso en la reparación o regeneración del músculo en un sujeto, en el que el uso comprende […]
Composición farmacéutica en forma de solución oral de la sal de ibuprofeno con lisina, del 27 de Julio de 2020, de MMC INTERNATIONAL HEALTH HOLDING, S.L: La presente invención se refiere a una composición farmacéutica en forma de solución oral de la sal de ibuprofeno con lisina, que comprende un sistema viscosizante […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Complemento alimenticio que comprende ácidos resínicos, del 15 de Julio de 2020, de HANKKIJA OY: Utilización no terapéutica de un complemento alimenticio que comprende una composición basada en ácido resínico que comprende más del 10 % (p/p) de ácidos […]
Composición que comprende cinamaldehído y cinc, del 8 de Julio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Composición que comprende cinamaldehído y cinc para la utilización en la mejora de uno o más de rendimiento cognitivo, cognición, humor o memoria en un […]
Uso de ácido cannabidiólico en el tratamiento de la epilepsia, del 1 de Julio de 2020, de GW Research Limited: Una cantidad terapéuticamente eficaz de ácido cannabidiólico (CBDA) para su uso en el tratamiento de la epilepsia, en la que CBDA está en forma de extracto de […]
Composiciones tópicas que comprenden un corticosteroide y un retinoide para tratar la psoriasis, del 1 de Julio de 2020, de Bausch Health Ireland Limited: Una composición farmacéutica tópica para usar en el tratamiento de la psoriasis, la composición que comprende: (a) propionato de halobetasol […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]