Composiciones farmacéuticas que comprenden anagrelida.
Un granulado farmacéutico que comprende un principio activo, donde el principio activo es clorhidrato de anagrelida monohidrato,
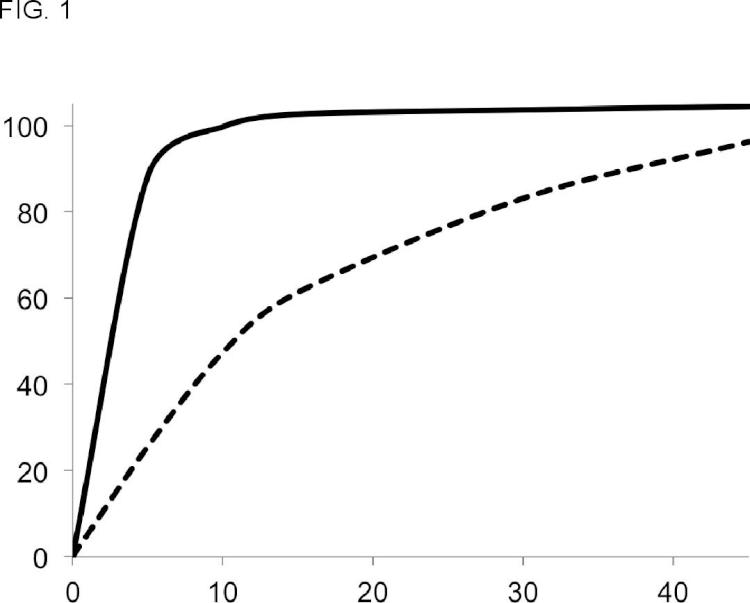
donde el principio activo tiene un tamaño de partícula con una distribución de volumen con D50 entre 0,5 y 6,0 micras y D90 entre 4,0 y 12,0 micras, medido por análisis de difracción laser; donde dicho granulado tiene un tamaño de partícula con una distribución de volumen con D90 entre 50 y 800 micras, preferiblemente con D90 entre 70 y 700 micras, más preferiblemente con D90 entre 80 y 600 micras, medido por análisis granulométrico; y donde al menos el 85 %, preferiblemente al menos el 90 % del principio activo del granulado farmacéutico se disuelve en 15 minutos en un test de disolución de palas, a 50 rpm con una solución de HCl a pH 1,2 como medio de disolución y un volumen de 900 ml por vaso.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E15158157.
Solicitante: GALENICUM HEALTH, S.L.
Nacionalidad solicitante: España.
Inventor/es: ARROYO HIDALGO,SERGIO, PUIGVERT COLOMER,Marina.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K9/16 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Aglomerados; Granulados; Microbolitas.
PDF original: ES-2549106_T1.pdf
Reivindicaciones:
1. Un granulado farmacéutico que comprende un principio activo, donde el principio activo es clorhidrato de anagrelida monohidrato, donde el principio activo tiene un tamaño de partícula con una distribución de volumen 5 con 050 entre 0, 5 y 6, 0 micras y 090 entre 4, 0 y 12, 0 micras, medido por análisis de difracción laser; donde dicho granulado tiene un tamaño de partícula con una distribución de volumen con 090 entre 50 y 800 micras, preferiblemente con 090 entre 70 y 700 micras, más preferiblemente con 090 entre 80 y 600 micras, medido por análisis granulométrico; y donde al menos el 85 %, preferiblemente al menos el 90 % del principio activo del granulado farmacéutico se disuelve en 15 minutos en un test de disolución de palas, a 50 rpm con una solución de Hel a pH 1, 2 como medio de disolución y un volumen de 900 mi por vaso.
2. El granulado farmacéutico según la reivindicación anterior, donde la cantidad de principio activo es de entre 0, 43 y 2, 0 % en peso con respecto a la cantidad total del granulado farmacéutico.
3. Una composición farmacéutica que comprende el granulado farmacéutico según cualquiera de las reivindicaciones anteriores o una composición farmacéutica que consiste esencialmente en el granulado farmacéutico según cualquiera de las reivindicaciones anteriores.
4. Una composición farmacéutica que comprende un principio activo, donde el principio activo es clorhidrato de anagrelida monohidrato, donde la cantidad de principio activo es de entre 0, 42 y 1, 59 % en peso con respecto a la cantidad total de la composición farmacéutica , preferiblemente de entre 0, 43 y 0, 53 % en peso con respecto a la cantidad total de la composición farmacéutica, y donde al menos el 85 %, preferiblemente al menos 90 % del principio activo de la composición farmacéutica se disuelve en 15 minutos en un test de disolución de palas, a 50 rpm con una solución de HCI a pH 1, 2 como medio de disolución y un volumen de 900 mi por vaso.
2.
5. l a composición farmacéutica según la reivindicación anterior, donde la composición farmacéutica comprende un granulado que contiene el principio activo, preferiblemente donde dicho granulado tiene un tamaño de partícula con una distribución de volumen con 090 entre 70 y 700 micras, medido por análisis granulométrico.
6. l a composición farmacéutica según cualquiera de las dos reivindicaciones anteriores, donde la composición farmacéutica comprende al menos un lubricante, preferiblemente el lubricante es estearato de magnesio y I o el lubricante es preferiblemente extragranular.
7. l a composición farmacéutica según la reivindicación anterior, donde la cantidad de lubricante oscila entre 0, 3
Y 1, 2 % en peso con respecto a la cantidad total de la composición farmacéutica, preferiblemente oscila entre 0, 4 y 0, 6 % en peso respecto a la cantidad total de la composición farmacéutica, y I o donde la composición farmacéutica comprende una cantidad de principio activo por cápsula dura de entre 0, 45 y 1, 30 mg, preferiblemente de entre 0, 48 y 1, 27 mg, más preferiblemente la composición farmacéutica comprende una cantidad de principio activo por cápsula dura equivalente a 0, 5 mg o 1 mg del principio activo como base libre.
4.
8. La composición farmacéutica según cualquiera de las cuatro reivindicaciones anteriores, donde la composición farmacéutica comprende un diluyente seleccionado entre lactosa, celulosa microcristalina y mezclas de las mismas, preferiblemente, el diluyente es una mezcla de lactosa y celulosa microcristalina, preferiblemente el diluyente es tanto intragranular como extragranular y preferiblemente el diluyente extragranular es lactosa 45 anhidra.
9. La composición farmacéutica según cualquiera de las reivindicaciones anteriores, donde la composición farmacéutica se prepara por granulación húmeda y I o está en forma de una cápsula dura.
10. Una cápsula dura que comprende entre 90 y 145 mg de una composición farmacéutica que comprende un principio activo, donde el principio activo es clorhidrato de anagrelida monohidrato; donde al menos el 85 % del principio activo de la composición farmacéutica, preferiblemente al menos el 90 % del principio activo de la composición farmacéutica, se disuelve en 15 minutos en un test de disolución de palas, a 50 rpm con una solución de HCI a pH 1, 2 como medio de disolución y un volumen de 900 mi por vaso; y donde la composición 55 farmacéutica comprende una cantidad de principio activo por cápsula dura de entre 0, 45 y 1, 30 mg, preferiblemente de entre 0, 48 y 1, 27 mg.
11. Un lote farmacéutico que comprende al menos 20.000, preferiblemente al menos SO.OOO, más preferiblemente al menos 100.000 cápsulas duras tal y como se definen en cualquiera de las reivindicaciones 60 anteriores.
12. Un proceso para la fabricación de una cápsula dura de acuerdo con cualquiera de las reivindicaciones 9 ó 10, caracterizado por que comprende las siguientes etapas:
i) pesar, opcionalmente tamizar y mezclar el principio activo y opcionalmente al menos un excipiente farmacéuticamente aceptable; ii) granular en húmedo la mezcla obtenida en la etapa (i) ; iii) secar el granulado obtenido en la etapa (ii) ;
iv) opcionalmente tamizar el granulado obtenido en la etapa (iii) ; v) at'iadir opcionalmente al menos un excipiente extragranular farmacéuticamente aceptable al granulado obtenido en la etapa (iii) o (iv) ; y vi) llenar cápsulas duras con la mezcla obtenida en la etapa (i) , o el granulado obtenido en la etapa (iii) o en la etapa (iv) , o la mezcla obtenida en la etapa (v) .
13. Una cápsula dura fabricada por el proceso según la reivindicación anterior.
14. El granulado farmacéutico según cualquiera de las reivindicaciones 1 ó 2; o la composición farmacéutica según cualquiera de las reivindicaciones 3 a 9; o la cápsula dura según la reivindicación 10; o el lote 15 farmacéutico según la reivindicación 11, para su uso en el tratamiento de la trombocitemia esencial.
15. Una composición farmacéutica envasada en forma de una botella que contiene al menos cinco cápsulas duras como se definen en cualquiera de las reivindicaciones 9 ó 10, preferiblemente donde dicha botella es resistente a la luz y comprende un desecante; o una caja de cartón con un prospecto que comprende al menos 20 una botella que contiene al menos cinco cápsulas duras como se definen en cualquiera de las reivindicaciones 9
010.
Patentes similares o relacionadas:
Unidad de dosificación farmacéutica sólida desintegrante por vía oral que contiene una sustancia de control de partos, del 22 de Julio de 2020, de Oxytone Bioscience B.V: Unidad de dosificacion farmaceutica solida desintegrante por via oral que tiene un peso de entre 50 y 1.000 mg, donde dicha unidad de dosificacion consiste en: • 5-100 […]
Granulados secos de polvos de sílice mesoporosa, del 1 de Julio de 2020, de FORMAC PHARMACEUTICALS N.V: Un granulado seco que comprende desde el 50% al 100% p/p de sílice mesoporosa ordenada que tiene una organización bidimensional hexagonalmente […]
COMPOSICIONES DE ALPRAZOLAM AMORFO CON ACTIVIDAD ANSIOLÍTICA, CON ETILCELULOSA Y CROSPOVIDONA, Y PROCEDIMIENTOS CORRESPONDIENTES, del 18 de Junio de 2020, de LABORATORIOS BAGO S.A.: Composición de alprazolam amorfo con actividad ansiolítica que comprende: a) una premezcla que contiene: - entre 0,33 y 0,66% p/p de alprazolam; - entre […]
Sales de butirato para uso en enfermedades inflamatorias, del 17 de Junio de 2020, de Birrbeheer B.V: Una preparación que comprende una sal de butirato para uso en el tratamiento de un sujeto que padece una enfermedad que está asociada con inflamación sistémica, […]
Métodos para el tratamiento de la enfermedad ocular en sujetos humanos, del 10 de Junio de 2020, de Clearside Biomedical, Inc: Una formulación farmacéutica que comprende un fármaco para su uso en un método de tratamiento de un trastorno ocular posterior en un sujeto humano que […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Gránulos de dispersión rápida, comprimidos de desintegración oral y métodos, del 3 de Junio de 2020, de Adare Pharmaceuticals, Inc: Microgránulos de dispersión rápida, farmacéuticamente aceptables, que tienen una mediana del tamaño de partícula en el rango de 100 μm a 300 […]
Composiciones de polifenol, del 3 de Junio de 2020, de Nugerontix Limited: Enoteína B para uso en terapia para tratar, prevenir o retrasar la aparición de disfunción endotelial donde el tratamiento, prevención o retraso comprende […]