Procedimiento para la detección colorimétrica de lisozima por nanopartículas agregadas de oro.
Procedimiento para la detección colorimétrica de lisozima por nanopartículas agregadas de oro.
La presente invención tiene por objeto un procedimiento que permite detectar lisozima en disolución acuosa, añadiendo nanopartículas de oro protegidas con iones citrato y agregadas previamente mediante el uso de una sal como es el NaCl a una determinada concentración.
Es una herramienta de diagnóstico médico eficaz que permitirá la detección de diversas patologías como leucemia o enfermedades renales.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201300722.
Solicitante: UNIVERSIDAD DE SEVILLA.
Nacionalidad solicitante: España.
Inventor/es: CASTILLO HERNANDEZ,PAULA MARGARITA, PRADO GOTOR,Rafael.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/34 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que interviene una hidrolasa.
- G01N21/33 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 21/00 Investigación o análisis de los materiales por la utilización de medios ópticos, es decir, utilizando rayos infrarrojos, visibles o ultravioletas (G01N 3/00 - G01N 19/00 tienen prioridad). › utilizando la luz ultravioleta (G01N 21/39 tiene prioridad).
- G01N33/493 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › de orina.
PDF original: ES-2527893_A2.pdf
Fragmento de la descripción:
Procedimiento para la detección colorimétrica de lisozima por nanopartículas agregadas de oro.
Objeto de la invención
La presente invención tiene por objeto un procedimiento que permite detectar lisozima, añadiendo nanopartículas de oro protegidas con iones citrato y agregadas previamente mediante el uso de una sal como es el NaCI a una determinada concentración.
Es una herramienta de diagnóstico médico eficaz que permitirá la detección de diversas patologías como leucemia o enfermedades renales.
Estado de la técnica
La nanotecnología ha abierto nuevas vías de investigación aplicadas a la medicina, tanto en diagnóstico médico, como en imagen (Sequence-selective detection of double-stranded DNA sequences using pyrrole-imidazole polyamide microarrays. Ishwar Singh, Christian Wendeln, Alasdair William Clark, Jonathan Mark Cooper, Bart Jan Ravoo, and Glenn A. Burley. J. Am. Chem. Soc., Just Accepted (Feb 2013)) o como vehículos farmacéuticos (Folate-Receptor-Targeted Delivery of Doxorubicin Using Polyethylene Glycol-Functionalized Gold Nanoparticles. Bahareh Asadishad, Manouchehr Vossoughi, and Irán Alemzadeh. Ind. Eng. Chem. Res. 1958, 49, pp1958-1963(2010)). Las np de base orgánica están ampliamente aceptadas y se emplean especialmente como transportadores de fármacos (Polymeric emulsión and crosslink-mediated synthesis of super-stable nanoparticles as sustained-release anti-tuberculosis drug carriers. Yahya E. Choonara, Viness Pillay, Valence M.K. Ndesendo, Lisa C. du Toit, Pradeep Kumar, Riaz A. Khan, Caragh S. Murphy, Debbie-Leigh Jarvis. Colloids and Surfaces B: Biointerfaces 87. pp 243- 254 (2011)). De entre las inorgánicas, son las compuestas de óxidos de hierro en la forma de magnetita, las que gozan de mayor aceptación; aprobadas por la FDA, pueden ser usadas como agente de contraste en RMI o destrucción tumoral por hipertermia (One-Pot Synthesis of PEGylated Ultrasmall Iron-Oxide Nanoparticles and Their in Vivo Evaluation as Magnetic Resonance Imaging Contrast Agents. Jean-Francois Lutz, Sabrina Stiller, Ann Hoth, Lutz Kaufner, Ulrich Pisón, and Régis Cartier. Biomacromolecules, 7, pp 3132-3138 (2006).). Además de las de magnetita, las np de metales nobles, especialmente de plata y/o oro son las más empleadas en aplicaciones
biomédicas pues sus interesantes propiedades ópticas que las diferencian del resto de np dan lugar a detecciones rápidas y directas por técnicas espectroscopias (Surface Plasmon Resonance Scattering and Absorption of anti- EGFR Antibody Conjugated Gold Nanoparticles in Cáncer Diagnostics: Applications in Oral Cáncer Ivan H. El-Sayed, Xiaohua Huang, and Mostafa A. El- Sayed Nano Lett.,5 (5), pp 829-834 (2005)). Estas propiedades ópticas o su gran capacidad de dispersión de luz, las convierten en sensores ideales, por lo que desde hace más de una década las nanopartículas de oro se emplean en aplicaciones biomédicas como en la detección de ADN (A DNA-based method for rationally assembling nanoparticles into macroscopic materials. Mirkin, CA et al. Nature, 382, pp 607-609 (1996)), sensores de glucosa (Polymerized Colloidal Crystal hydrogel films as intelligent Chemical sensing materials. H.J. Holtz, S.A. Asher. Nature 389, pp 829-832 (1997)) e incluso en la detección de células cancerosas (Gold Nanoparticle-Based Colorimetric Assay for the Direct Detection of Cancerous Cells. Colin D. Medley, Joshua E. Smith, Zhiwen Tang, Yanrong Wu, Suwussa Bamrungsap, and Weihong Tan. Anal. Chem. 80, pp 1067-1072 (2008)).
Las nanopartículas de metales nobles son especialmente interesantes como sensores colorimétricos. Cuando una biomolécula interacciona con la superficie de una nanopartícula, la distancia entre nanopartícula cambia y con ella la dispersión de la luz emitida, pudiendo ser visible a simple vista. Existen sensores colorimétricos, basados en np de plata (Interaction of DNA bases with silver nanoparticles: Assembly quantified through SPRS and SERS. Basu.S., et al. Journal of Colloid and Interface Science. 321, pp. 288-293 (2008)) y oro (Sensitive and Visual Detection of Sequence-Specific DNA Binding Protein via a Gold Nanoparticle-Based Colorimetric Biosensor. Li-Juan Ou, Pei-Yan Jin, Xia Chu, Jian-Hui Jiang, and Ru-Qin Yu Anal. Chem. 82, pp 6015-6024 (2010)) que cambian de color a simple vista debido a la presencia de ADN ó como detectores de células cancerosas (Gold Nanoparticle-Based Colorimetric Assay for the Direct Detection of Cancerous Cells. Colin D. Medley, Joshua E. Smith, Zhiwen Tang, Yanrong Wu, Suwussa Bamrungsap, and Weihong Tan. Anal. Chem. 80, pp 1067- 1072 (2008)) (Aptamer-Nanoparticle Strip Biosensor for Sensitive Detection of Cáncer Cells. Guodong Liu, Xun Mao, Joseph A. Phillips, Hui Xu, Weihong Tan, and Lingwen Zeng. Anal. Chem. 81, pp 10013-10018 (2009)).
Desde hace más de una década, el reconocimiento de proteínas es una de las aplicaciones más interesantes de las nanopartículas de oro en aplicaciones de diagnóstico médico (Colloidal Gold, Principies, Methods and Applications; Hayat, M. A. Academic Press: New York, (1989).)- Otras aplicaciones que se describen en la bibliografía, se refieren al uso de nanopartículas de oro como sensores de diversos carbohidratos en aplicaciones biológicas como en el marcado de proteínas (Metal nanocolloids. Belloni, J. Curr. Opin. Colloid Interface Sci.1, pp184- 196 (1996)). Igualmente, se han formado bioconjugados de nanopartículas de oro con lípidos (Spatial organization and patterning of gold nanoparticles on self- assembled biolipid tubular templates. Burkett, S. L.; Mann, S. Chem. Commun., 321-322 (1996)), enzimas (A Method to Construct a Third-Generation Horseradish Peroxidase Biosensor: Self-Assembling Gold Nanoparticles to Three-Dimensional Sol-Gel Network.Jia, J.; Wang, B.; Wu, A.; Cheng, G.; Li, Z.; Dong, S. Anal. Chem. 74, pp 2217-2223 (2002)) o virus (Gold Nanoparticles as Spectroscopic Enhancers for in Vitro Studies on Single Viruses. Dragnea, B.; Chen, C.; Kwak, E.-S.; Stein, B.; Kao, C. C. J. Am. Chem. Soc., 125, pp 6374-6375. (2003)).
Las nanopartículas compuestas por metales nobles como plata y oro son sensores colorimétricos ideales, debido a sus propiedades ópticas como la capacidad de dispersar luz en intensos colores. En los sensores convencionales basados en nanopartículas, se parte de una dispersión estable de nanopartículas sobre la cual se va adicionando la especie de interés provocando el cambio de color en la dispersión debido a la agregación de las nanopartículas. Cuando una biomolécula interacciona con la superficie de una nanopartícula, la distancia entre nanopartículas cambia y con ella la dispersión de la luz emitida, pudiendo ser visible a simple vista. Existen sensores colorimétricos, basados en nanopartículas de plata (Interaction of DNA bases with silver nanoparticles: Assembly quantified through SPRS and SERS. Basu, S., et al. Journal of Colloid and Interface Science 321, pp. 288-293 (2008)) y oro (Sensitive and Visual Detection of Sequence- Specific DNA Binding Protein via a Gold Nanoparticle-Based Colorimetric Biosensor. Li-Juan Ou, Pei-Yan Jin, Xia Chu, Jian-Hui Jiang, and Ru-Qin Yu. Anal. Chem. 82, pp 6015-6024. (2010)) que cambian de color a simple vista debido a la presencia de ADN ó como detectores de células cancerosas (Gold Nanoparticle- Based Colorimetric Assay for the Direct Detection of Cancerous Cells. Colín D. Medley, Joshua E. Smith, Zhiwen Tang, Yanrong Wu, Suwussa Bamrungsap, and Weihong Tan. Anal. Chem. 80, pp 1067-1072 (2008)) (Aptamer-Nanoparticle Strip
Biosensor for Sensitive Detection of Cáncer Cells. Guodong Liu, Xun Mao, Joseph A. Phillips, Huí Xu, Weihong Tan, and Lingwen Zeng. Anal. Chem., 81, pp 10013- 10018 (2009)). En cualquier caso, en todas ellas se parte de la nanopartícula aislada, funcionalizada o no, pero no agregada.
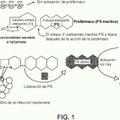
El sensor colorimétrico objeto de la presente invención, es un procedimiento sencillo para la detección de lisozima por nanopartículas aniónicas de oro previamente agregadas. A diferencia de todos los métodos anteriores, se parte de clusters de oro agregados previamente mediante la adición de una sal inerte como el cloruro sódico.
Existen antecedentes relativos a trabajos centrados en el empleo de nanopartículas aniónicas de oro para detectar lisozima en disolución. W.L.Tseng y colaboradores (Colorimetric detection of lysozyme based on electrostatic interaction with human serum albumin-modified gold nanoparticles. Yi-Ming Chen; Cheng-Ju Yu; Tiang-Lu Cheng and Wei-Lung Tseng. Langmuir 24, pp 3654-60 (2008)) estudiaron la interacción de nanopartículas de oro de con esta proteína. Sin embargo, el método descrito no es directo, pues es necesaria modificación covalente previa de la superficie de los nanoclusters. Además, en los métodos descritos, se controla el seguimiento... [Seguir leyendo]
Reivindicaciones:
1Procedimiento colorimétrico para la detección y/o cuantificación de lisozima en disolución acuosa que comprende:
a) añadir un biosensor de color azul constituido por nanopartículas de oro protegidas con iones citrato (AuNPs) agregadas con NaCI, a una muestra problema y
b) determinar el grado de desagregación de las nanopartículas a simple vista o mediante espectroscopia UV-visible tras el estudio del desplazamiento que se produce hacia menores valores en la longitud de onda (color rojo) en la muestra que contiene lisozima.
2.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima de acuerdo a la reivindicación 1, en el que las nanopartículas de Au tienen un diámetro de 10 nm y han sido sintetizadas mediante la reducción en medio acuoso de una sal de oro con citrato sódico.
3.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima, de acuerdo a las reivindicaciones anteriores caracterizado porque las nanopartículas de oro están en disolución acuosa.
4.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima de acuerdo a las reivindicaciones anteriores caracterizado porque en el procedimiento de preparación del biosensor se toman como punto de referencia las nanopartículas de oro que han sido agregadas de forma controlada.
5.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima de acuerdo a la reivindicación 4, caracterizado porque el punto de referencia se establece mediante la adición sobre las nanopartículas de oro, de NaCI a una concentración 0.1 M y 10 minutos de espera para la estabilización.
6.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima de acuerdo a las reivindicaciones anteriores caracterizado porque la determinación de la concentración de lisozima de la muestra problema requiere, el valor obtenido en
el punto de referencia según la reivindicación 5 y el valor obtenido para la muestra problema, logrado con un orden tiempos y concentración fijados.
7.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima de 5 acuerdo a la reivindicación 6, caracterizado porque el orden de adición fijado para obtener el valor de la muestra problema de lisozima es: primero las nanopartículas de oro (7.9x10'9M), posteriormente la sal NaCI (0,1 M) y un tiempo de espera de 10 minutos para su estabilización.
8.- Procedimiento colorimétrico para la detección y/o cuantificación de lisozima de
acuerdo a las reivindicaciones anteriores, caracterizado porque la determinación de la concentración de lisozima (10"9-8.10'4M) se realiza a simple vista o calculada por diferencia, mediante espectroscopia UV-vis, tras el estudio del desplazamiento que se produce hacia menores valores en la longitud de onda en la muestra que
contiene lisozima.
9.- Uso del procedimiento colorimétrico para la detección y/o cuantificación de lisozima de acuerdo a las reivindicaciones 1-8, para detectar/cuantificar la presencia de lisozima en una muestra.
Patentes similares o relacionadas:
Sistema y dispositivos de ensayo de actividad enzimática, del 1 de Julio de 2020, de Københavns Universitet (KU): Un dispositivo de actividad enzimática adecuado para la determinación de la actividad de degradación enzimática de los biopolímeros en una muestra líquida, […]
Método mejorado para la determinación de microorganismos, del 6 de Mayo de 2020, de STORA ENSO OYJ: Un método para determinar el contenido de microorganismos en un material que comprende celulosa en la industria de la pulpa y el papel que comprende las etapas de: […]
Procedimiento rápido de detección de enzimas y de microorganismos, del 20 de Noviembre de 2019, de Bio-Rad Europe GmbH: Procedimiento de detección in vitro de una enzima de un microorganismo a partir de una muestra biológica, estando la enzima que se va a detectar seleccionada entre el grupo […]
Método para predecir la respuesta al tratamiento farmacológico con chaperona de enfermedades, del 12 de Junio de 2019, de AMICUS THERAPEUTICS, INC: Un método para recopilar una tabla de tratamiento de referencia que indica la capacidad de respuesta de una o más mutaciones específicas de […]
Método para la prueba de disolución de composiciones sólidas que contienen enzimas digestivas, del 8 de Mayo de 2019, de Allergan Pharmaceuticals International Limited: Un proceso para medir una cantidad de enzimas digestivas liberadas de una composición sólida de pancrelipasa en un medio de disolución que comprende utilizar espectroscopía […]
Método para detectar condiciones bacteriolíticas en una muestra, del 17 de Abril de 2019, de UNIVERSITAT DE BARCELONA: Un método para detectar una condición bacteriolítica seleccionada del grupo que consiste en estrés físico, la presencia de bacteriófagos, la presencia […]
Inhibidores de glicosidasa, del 27 de Febrero de 2019, de MERCK PATENT GMBH: Un medicamento que comprende un compuesto de fórmula (I)**Fórmula** en la que X1 designa S u O; X2, W designan independientemente […]
 Métodos para usar sustratos enzimáticos marcados con bodipy, del 11 de Febrero de 2019, de THE GENERAL HOSPITAL CORPORATION: Un metodo para detectar la actividad de una enzima beta-lactamasa en una muestra, que comprende:
poner en contacto la muestra con una composicion […]
Métodos para usar sustratos enzimáticos marcados con bodipy, del 11 de Febrero de 2019, de THE GENERAL HOSPITAL CORPORATION: Un metodo para detectar la actividad de una enzima beta-lactamasa en una muestra, que comprende:
poner en contacto la muestra con una composicion […]