Procedimiento de conjugación de polisacáridos bacterianos con proteínas transportadoras.
Un procedimiento de conjugación de un sacárido bacteriano que comprende las etapas de
a) hacer reaccionar el sacárido bacteriano con 0,
001-0,7 equivalentes molares de peryodato para formar un sacárido bacteriano activado;
b) mezclar el sacárido bacteriano activado con una proteína transportadora;
c) hacer reaccionar el sacárido bacteriano activado y la proteína transportadora con un agente reductor para formar un conjugado;
o
a) hacer reaccionar el sacárido bacteriano con 0,001-0,7, equivalentes molares de peryodato para formar un sacárido bacteriano activado;
b) mezclar el sacárido bacteriano activado con un enlazador;
c') hacer reaccionar el sacárido bacteriano activado con el enlazador utilizando un agente reductor para formar un sacárido bacteriano-enlazador;
d) hacer reaccionar el sacárido bacteriano-enlazador con una proteína transportadora para formar un conjugado, en el que la etapa a) ocurre en un tampón que no contiene ningún grupo amino y el tampón tiene una concentración de entre 1-100 mM y en el que el sacárido bacteriano es el sacárido capsular 6B de S. pneumoniae.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2011/053400.
Solicitante: GLAXOSMITHKLINE BIOLOGICALS S.A..
Nacionalidad solicitante: Bélgica.
Dirección: RUE DE L'INSTITUT, 89 1330 RIXENSART BELGICA.
Inventor/es: BIEMANS,RALPH,LEON, DUVIVIER,Pierre, GAVARD,OLLIVIER FRANCIS NICOLAS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/02 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos bacterianos.
PDF original: ES-2545221_T3.pdf



Fragmento de la descripción:
Procedimiento de conjugación de polisacáridos bacterianos con proteínas transportadoras La presente invención se refiere a un procedimiento de conjugación. En particular, se refiere a la conjugación de sacáridos y proteínas utilizando aminación reductora.
Antecedentes Los polisacáridos capsulares bacterianos han sido utilizados ampliamente en inmunología durante muchos años para la prevención de la enfermedad bacteriana. Un problema con un uso de este tipo, sin embargo, es la naturaleza T-independiente de la respuesta inmunitaria. Estos antígenos son por tanto poco inmunogénicos en niños pequeños. Este problema se ha superado a través de la conjugación de los antígenos polisacáridos con una proteína transportadora (una fuente de epítopos de linfocitos T cooperadoras) que pueden entonces utilizarse para provocar una respuesta inmunitaria T-dependiente, incluso en el primer año de vida.
Se conocen diversas técnicas de conjugación en la técnica. Los conjugados pueden prepararse mediante procedimientos de aminación reductora directa como se describe en los documentos US200710184072 (Hausdorff) , US 4365170 (Jennings) y US 4673574 (Anderson) . Se describen otros procedimientos en los documentos EP-0-16115 188, EP-208375 y EP-0-477508. El procedimiento de conjugación puede depender como alternativa de la activación de grupos hidroxilo del sacárido con tetrafluoroborato de 1-ciano-4-dimetilaminopiridinio (CDAP) para formar un éster de cianato. Dichos conjugados se describen en la solicitud publicada del PCT WO 93/15760 Universidad de Servicios Uniformados y WO 95/08348 y WO 96/29094. Véase también Chu C. y col. infect. Immunity, 1983 245 256.
La aminación reductora implica das etapas, (I) la oxidación del antígeno, (2) la reducción del antígeno y de una 20 proteína transportadora para formar un conjugado. La etapa de oxidación puede implicar la reacción con per y odato, sin embargo la oxidación por per y odato puede conducir a la reducción de tamaño (documento WO94/05325) .
Sumario de la invención Los inventores han descubierto sorprendentemente que el uso de concentraciones más bajas de per y odato en presencia de fosfato bajo puede conducir a la retención del tamaño y/o la retención de los epítopos.
En un primer aspecto de la invención, se proporciona un procedimiento para conjugar un sacárido o sacáridos bacterianos que comprende las etapas a) hacer reaccionar el sacárido bacteriano con 0, 001-0, 7, (por ejemplo 0, 005-0, 5, 0, 01-0, 5, 0, 1-0, 5, o 0, 1-0, 2) equivalentes molares de per y odato para formar un sacárido bacteriano activado; b) mezclar el sacárido bacteriano activado con una proteína transportadora;
c) hacer reaccionar el sacárido bacteriano activado y la proteína transportadora con un agente reductor para formar un conjugado; o a) hacer reaccionar el sacárido bacteriano con 0, 001-0, 7, (por ejemplo, 0, 005-0, 5, 0, 01-0, 5, 0, 1-0, 5, o 0, 1-0, 2) equivalentes molares de per y odato para formar un sacárido bacteriano activado;
b) mezclar el sacárido bacteriano activado con un enlazador; c') hacer reaccionar el sacárido bacteriano activado con el enlazador utilizando un agente reductor para formar un sacárido bacteriano-enlazador; d) hacer reaccionar el sacárido bacteriano-enlazador con una proteína transportadora para formar un conjugado,
en el que la etapa a) se produce en un tampón que no contiene un grupo amino y el tampón tiene una concentración 40 de entre 1-100 mM.
Se desvela un conjugado obtenible mediante el procedimiento de la invención.
Se desvela un conjugado obtenido mediante el proceso de la invención.
Se desvela una composición inmunogénica que comprende el conjugado de la invención y un excipiente farmacéuticamente aceptable.
Se desvela una vacuna que comprende la composición inmunogénica de la invención.
Se desvela un uso de la composición inmunogénica de la invención o de la vacuna de la invención en la prevención o el tratamiento de la enfermedad bacteriana.
Se describe un uso de la composición inmunogénica de la invención o de la vacuna de la invención en la preparación de un medicamento para la prevención o el tratamiento de la enfermedad bacteriana.
Se desvela un procedimiento para prevenir o tratar la infección bacteriana que comprende la administración de la composición inmunogénica de la invención o de la vacuna de la invención a un paciente.
Se desvela un sacárido bacteriano activado, en el que el sacárido bacteriano activado comprende una unidad de repetición de fórmula (I) :
en la que el sacárido bacteriano activado comprende n unidades de repetición y n está entre 2 y 2400, entre 500 y 2000, entre 750 y 1500, entre 1000 y 2000 o entre 1500 y 2300. En la que al menos el 0, 001 %, 0, 01 %, 0, 1 %, 0, 5 %, 1 %, 2 %, 5 %, 10 % o 30 % pero menos del 0, 001 %, 0, 01 %, 0, 1%, 0, 5%, 1%, 2%, 5%, 10%, 30% o 50% de S1 es
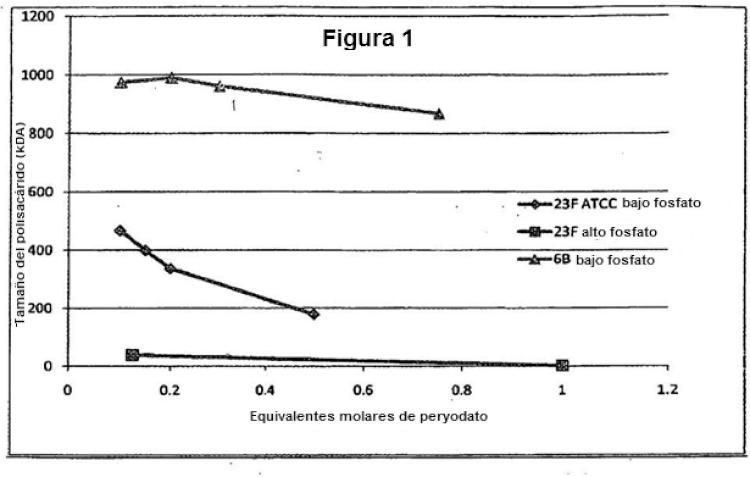
y el resto es en la que S2 es y en la que S3 es Descripción de los dibujos Figura 1. Tamaño de los polisacáridos 23F y 6B después del tratamiento con per y odato. La línea marcada con triángulos muestra el tamaño de 6B en tampón fosfato 10 mM, la línea marcada con diamantes muestra el
tamaño de 23F en tampón fosfato 10 mM y la línea marcada con cuadrados muestra el tamaño de 23F en tampón fosfato 100 mM.
Figura 2. Comparación de la inmunogenicidad de 23F conjugado utilizando ya sea CDAP o conjugación de aminación reductora. El gráfico a) describe los resultados de un ensayo ELISA. El gráfico b) describe los resultados de un ensayo de opsonofagocitosis.
Figura 3. Evaluación de la inmunogenicidad de PS06B-CRM conjugado utilizando los procedimientos de conjugación descritos en el ejemplo 4 en un modelo de ratón Balb/c.
Figura 4. Evaluación de la inmunogenicidad de PS06B-CRM conjugado utilizando los procedimientos de conjugación descritos en el ejemplo 4 en un modelo de conejillo de indias.
Descripción detallada de la invención La invención se refiere a un procedimiento mejorado para conjugar un antígeno con una proteína transportadora. En particular, la invención proporciona un procedimiento para conjugar un sacárido o sacáridos bacterianos que comprende las etapas a) hacer reaccionar el sacárido bacteriano con 0, 001-0, 7 equivalentes molares de per y odato para formar un sacárido bacteriano activado; b) mezclar el sacárido bacteriano activado con una proteína transportadora; c) hacer reaccionar el sacárido bacteriano activado y la proteína transportadora con un agente reductor para formar un conjugado; o a) hacer reaccionar el sacárido bacteriano con 0, 001-0, 7 equivalentes molares de per y odato para formar un sacárido bacteriano activado; b) mezclar el sacárido bacteriano activado con un enlazador; c') hacer reaccionar el sacárido bacteriano activado con el enlazador utilizando un agente reductor para formar un sacárido bacteriano-enlazador; d) hacer reaccionar el sacárido bacteriano-enlazador con una proteína transportadora para formar un conjugado,
en el que la etapa a) se produce en un tampón que no contiene un grupo amino y el tampón tiene una concentración de entre 1-100 mM.
El término "per y odato" incluye tanto el per y odato como el ácido per y ódico. Este término también incluye tanto el metaper y odato (IO4-) como el ortoper y odato (IO65-) , sin embargo en una realización particular, el per y odato utilizado en el procedimiento de la invención es metaper y odato. El término "per y odato" también incluye las diversas sales de per y odato incluyendo el per y odato de sodio y el per y odato de potasio. En una realización el per y odato utilizado es metaper y odato de sodio. Cuando un antígeno reacciona con per y odato, el per y odato oxida los grupos hidroxilo vecinales para formar grupos carbonilo o aldehído y provoca la escisión de un enlace C-C. Por esta razón la expresión "hacer reaccionar un antígeno con per y odato" incluye la oxidación de los grupos hidroxilo vecinales mediante per y odato.
Para los fines de la invención un "sacárido bacteriano activado" es un sacárido bacteriano que se ha activado mediante la etapa a) del proceso de la invención.
Para los fines de la invención, el término "conjugado" indica un sacárido bacteriano ligado covalentemente a una proteína transportadora. En una realización un sacárido bacteriano está unido directamente a una proteína transportadora. En una segunda realización, un sacárido bacteriano está ligado a una proteína a través de un espaciador/enlazador.
El tampón utilizado en la etapa a) es un tampón que no contiene un grupo amino. En una realización el tampón se selecciona... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento de conjugación de un sacárido bacteriano que comprende las etapas de a) hacer reaccionar el sacárido bacteriano con 0, 001-0, 7 equivalentes molares de per y odato para formar un sacárido bacteriano activado;
b) mezclar el sacárido bacteriano activado con una proteína transportadora; c) hacer reaccionar el sacárido bacteriano activado y la proteína transportadora con un agente reductor para formar un conjugado; o a) hacer reaccionar el sacárido bacteriano con 0, 001-0, 7, equivalentes molares de per y odato para formar un sacárido bacteriano activado; b) mezclar el sacárido bacteriano activado con un enlazador; c') hacer reaccionar el sacárido bacteriano activado con el enlazador utilizando un agente reductor para formar un sacárido bacteriano-enlazador; d) hacer reaccionar el sacárido bacteriano-enlazador con una proteína transportadora para formar un conjugado,
en el que la etapa a) ocurre en un tampón que no contiene ningún grupo amino y el tampón tiene una concentración de entre 1-100 mM y en el que el sacárido bacteriano es el sacárido capsular 6B de S. pneumoniae.
2. El procedimiento de la reivindicación 1 en el que el tampón se selecciona entre el grupo que consiste en tampón fosfato, tampón borato, tampón acetato, tampón carbonato y tampón citrato opcionalmente en el que el tampón tiene una concentración de entre 1-50 mM, 1-25 mM, 1-10 mM, 5-15 mM, 8-12 mM, 10-50 mM o aproximadamente 10 mM.
3. El procedimiento de una cualquiera de las reivindicaciones 1-2 en el que el pH en la etapa a) es pH 3, 5-8, 0, 5, 07, 0 o pH 5, 5-6, 5 o aproximadamente pH 6, 0.
4. El procedimiento de una cualquiera de las reivindicaciones 1-3 en el que el peso molecular promedio del sacárido
bacteriano es de entre 1-1100 kDa.
10. 470 kDa.
20. 300 kDa.
60. 1100 kDa .
80. 1000 kDa después de la etapa 25 a) .
5. El procedimiento de una cualquiera de las reivindicaciones 1-4, en el que el proteína transportadora se selecciona entre el grupo que consiste en toxoide tetánico, fragmento C del toxoide tetánico, toxoide diftério, CRM197, neumolisina, proteína D, PhtD, PhtDE y N19.
6. El procedimiento de una cualquiera de las reivindicaciones 1-5, en el que el agente reductor comprende 30 cianoborohidruro de sodio o triacetoxiborohidruro de sodio.
7. El procedimiento de una cualquiera de las reivindicaciones 1-6, que comprende una etapa adicional e) de purificación del conjugado.
8. El procedimiento de una cualquiera de las reivindicaciones 1-7, que contiene una etapa adicional de mezcla del conjugado con antígenos adicionales opcionalmente, en el que los antígenos adicionales comprenden al menos 7, 8,
9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 o 20 sacáridos de S. pneumoniae seleccionados entre el grupo que consiste en 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F y 33F.
9. El procedimiento de la reivindicación 8 en el que los antígenos adicionales comprenden una o más proteínas de S. pneumoniae seleccionadas entre el grupo que consiste en la familia de poli-histidina en triada (PhtX) , la familia de proteínas de unión a la colina (CbpX) , truncados de CbpX, familia LytX, truncados de LytX, proteínas quiméricas (o fusiones) de truncado de CbpX-truncado de LytX, neumolisina (Ply) , PspA, PsaA, Sp128, Sp101, Sp130, Sp125 y SP133.
10. El procedimiento de una cualquiera de las reivindicaciones 1-9, en el que el conjugado se mezcla con un adyuvante o un excipiente farmacéuticamente aceptable.
Patentes similares o relacionadas:
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
Un nuevo antígeno de vacuna no de VIH de la microbiota vaginal capaz de inducir una respuesta de anticuerpos protectores neutralizadores de la mucosa contra la infección por VIH, del 13 de Mayo de 2020, de B Cell Design: Un antígeno de permeasa de Mycoplasma genitalium o un polinucleótido que codifica dicho antígeno en forma expresable, para su uso en la prevención y/o el tratamiento […]
Composición inmunogénica que comprende antígenos de micoplasma, del 13 de Mayo de 2020, de BOEHRINGER INGELHEIM VETMEDICA GMBH: Una composición inmunogénica que comprende: a) una vacuna bacteriana inactivada completa de M. hyorhinis y una vacuna bacteriana inactivada completa de M. […]
Arginina desiminasa con reactividad cruzada reducida hacia anticuerpos para ADI - PEG 20 para el tratamiento del cáncer, del 6 de Mayo de 2020, de TDW Group: Una composición terapéutica que comprende una arginina desiminasa (ADI) aislada y un vehículo farmacéuticamente aceptable, en donde la ADI aislada comprende la secuencia de […]
Composiciones de flagelina y usos, del 6 de Mayo de 2020, de Genome Protection, Inc: Una composición relacionada con la flagelina, comprendiendo la composición una secuencia de aminoácidos que tiene al menos un 95 % de identidad de […]
Una vacuna para usar contra la infección asintomática por Lawsonia en un cerdo, del 6 de Mayo de 2020, de INTERVET INTERNATIONAL B.V: Una vacuna que comprende antígeno de Lawsonia intracellularis no vivo y un vehículo farmacéuticamente aceptable para usar en un método para reducir en un cerdo el impacto negativo […]
Composiciones de vacunas contra el síndrome reproductivo y respiratorio porcino y las enfermedades asociadas al circovirus porcino, del 29 de Abril de 2020, de Reber Genetics Co., Ltd: Una proteína de fusión que comprende: (a) un dominio de unión a células presentadoras de antígeno (APC) ubicado en el N-terminal de la proteína de fusión, en la […]