Células sanguíneas inmunosupresoras y métodos de producir las mismas.
Una composición farmacéutica para su uso en el tratamiento de una enfermedad inflamatoria,
rechazo de injerto de órgano o enfermedad del injerto frente al huésped en un paciente, comprendiendo dicha composición sangre completa aislada o Células Mononucleares de Sangre Periférica (PBMC) tratada
(i) con una cantidad terapéuticamente eficaz de un agente quimioterapéutico, o
(ii) con una cantidad terapéuticamente eficaz de un agente quimioterapéutico y un autoantígeno;
y opcionalmente un vehículo farmacéuticamente aceptable.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/058169.
Solicitante: Universitätsklinikum Heidelberg.
Nacionalidad solicitante: Alemania.
Dirección: Im Neuenheimer Feld 672 69120 Heidelberg ALEMANIA.
Inventor/es: SIMON, HELMUT, TERNESS,PETER, OPELZ,GERHARD, EHSER,SANDRA, KLEIST,CHRISTIAN, SANDRA-PETRESCU,FLAVIUS, IANCU,MIRCEA, JIGA,LUCIAN, CHUANG,JING-JING, OELERT,THILO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/164 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › de un ácido carboxílico con un aminoalcohol, p. ej. ceramidas.
- A61K31/407 A61K 31/00 […] › condensados con sistemas heterocíclicos, p. ej. ketorolac, fisostigmina.
- A61K31/5377 A61K 31/00 […] › no condensadas y conteniendo otros heterociclos, p. ej. timolol.
- A61K31/7072 A61K 31/00 […] › teniendo dos grupos oxo unidos directamente al ciclo de pirimidina, p. ej. uridina, ácido uridílico, timidina, zidovudina.
- A61K35/12 A61K […] › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- A61K35/14 A61K 35/00 […] › Sangre; Sangre artificial (perfluorocarbonos A61K 31/02; sangre del cordón umbilical A61K 35/51; hemoglobina A61K 38/42).
- A61P29/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- A61P37/06 A61P […] › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Inmunosupresores, p. ej. medicamentos para el tratamiento del rechazo en injertos.
PDF original: ES-2552678_T3.pdf



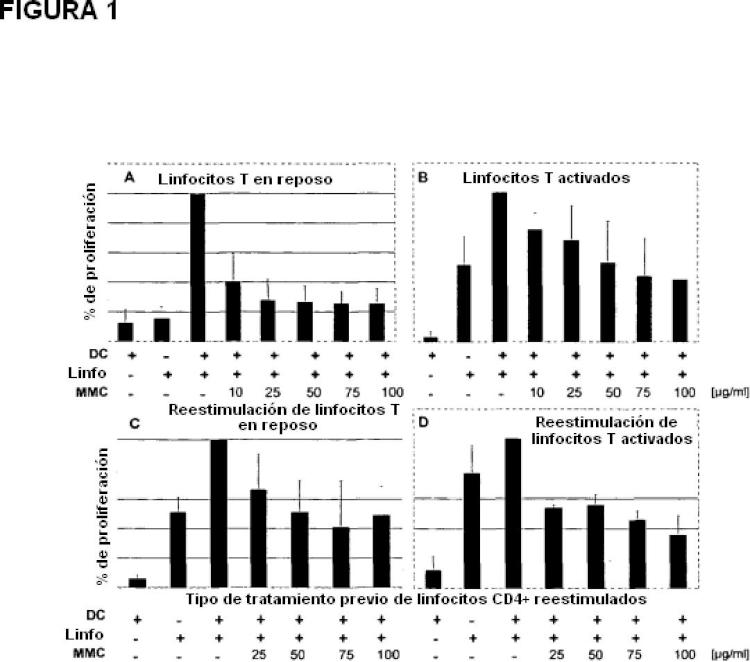
Patentes similares o relacionadas:
Sorbente polimérico para la eliminación de impurezas de sangre completa y productos sanguíneos, del 17 de Junio de 2020, de Cytosorbents Corporation: Un método para tratar la sangre y los productos sanguíneos almacenados que maximiza la vida útil y/o minimiza una complicación relacionada con la transfusión […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]
Composiciones, usos y preparación de lisados de plaquetas, del 27 de Mayo de 2020, de EMORY UNIVERSITY: Una composición que comprende componentes de lisado de plaquetas con una concentración de fibrinógeno de menos de 20 μg/ml.
Procedimiento para obtener células dendríticas inmunoestimulantes, del 4 de Marzo de 2020, de Transimmune AG: Un procedimiento para inducir la diferenciación de monocitos contenidos en una cantidad extracorpórea de una muestra de sangre de sujeto mamífero en células […]
Inmunoterapia mediante la utilización de células capaces de co-expresar un antígeno diana y CD1d y pulsadas con un ligando de CD1d, del 8 de Enero de 2020, de RIKEN: Un inmunoinductor para un antígeno diana, que comprende una célula que co-expresa antígeno diana y CD1d, en donde el antígeno diana y la célula […]
Péptidos terapéuticos, del 25 de Diciembre de 2019, de DANA-FARBER CANCER INSTITUTE, INC.: Composición que comprende un anticuerpo o fragmento de anticuerpo que se une inmunoespecíficamente a la secuencia A relacionada con polipéptido de clase I de […]
Propiedades inmunomoduladoras de las células progenitoras adultas multipotentes y usos de las mismas, del 25 de Diciembre de 2019, de ABT Holding Company: Células para la utilización en la prevención o tratamiento complementario de un neoplasma benigno de células de médula ósea, un trastorno mieloproliferativo, un […]
Tratamiento del cáncer utilizando un receptor de antígeno quimérico anti-CD19 humanizado, del 10 de Diciembre de 2019, de NOVARTIS AG: Dominio de unión anti-CD19 humanizado, en el que dicho dominio de unión anti-CD 19 humanizado comprende una secuencia de aminoácidos de un scFv seleccionada de […]