Bacteriocinas modificadas y métodos para su uso.
Molécula de ácido nucleico que codifica para una proteína de fibras de la cola de bacteriocina de alto pesomolecular (apm),
en la que dicha proteína de fibras de la cola comprende una región de unión a la placa basal(BPAR) de una piocina de tipo R y un dominio de unión al receptor heterólogo (RBD), en la que el RBD es de unafibra de la cola de otra bacteriocina o una fibra de la cola de un bacteriófago o profago, en la que la BPAR consisteen los aminoácidos 1-164 ó 1-240 de la fibra de la cola de piocina de tipo R.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/068908.
Solicitante: AVIDBIOTICS CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 385 OYSTER POINT BOULEVARD, SUITE 6A SOUTH SAN FRANCISCO CA 94080-1970 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MARTIN,David W. Jr, JAMIESON,Andrew C, SCHOLL,Dean M, WILLIAMS,Steven R.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/21 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Pseudomonadaceae (F).
PDF original: ES-2387722_T3.pdf
Fragmento de la descripción:
Bacteriocinas modificadas y métodos para su uso
5 Campo de la descripción
Esta descripción se refiere a formas modificadas de bacteriocinas de alto peso molecular (apm) que se producen de manera natural, tales como las piocinas de tipo R de Pseudomonas aeruginosa. Las bacteriocinas están modificadas en los extremos de sus fibras de la cola en una región responsable de la afinidad y especificidad de unión a sus parejas de unión relacionadas, o receptores, tales como los de la superficie de bacterias. También se describen métodos para el uso de las bacteriocinas modificadas, tales como para unirse a receptores, incluyendo factores de virulencia o adaptación, en las superficies de bacterias.
Antecedentes de la descripción
Actualmente, se presta mucha más atención global a las amenazas de patógenos virales que a las de enfermedades bacterianas. Sin embargo, las bacterias resistentes a antibióticos omnipresentes siguen causando estragos en el cuidado de pacientes y en la contención de costes en hospitales y otras instalaciones de cuidado médico. Al mismo tiempo, hay un repliegue en el desarrollo de antibióticos en favor de fármacos para enfermedades crónicas y mejoras del estilo de vida. En los últimos veinte años, sólo dos nuevas clases de antibióticos (oxazolidinonas y lipopéptidos) se han introducido en el mercado de EE.UU. (Wenzel, 2004) .
Solo en EE.UU., hay más de 2 millones de casos de infecciones bacterianas adquiridas en hospitales cada año. De estos, aproximadamente 90.000 personas morirán. La estadística más alarmante es la de que más del 70% de estos
responsables bacterianos son resistentes a al menos un fármaco antibacteriano (Bad Bugs, No Drugs, 2004) . Este número sigue aumentando a una velocidad alarmante. El coste anual para la economía de EE.UU. de estas infecciones intrahospitalarias resistentes a antibióticos supera los 5000 millones de $. La realidad de esta amenazante situación global forzará a un nuevo enfoque para el desarrollo y uso de agentes antibacterianos (Talbot et al., 2006) . Cuando crece el uso (y abuso) extensivo de anticuerpos en medicina humana y animal, también lo hace el surgimiento de patógenos bacterianos resistentes a antibióticos hasta el punto de que muchos antibióticos que una vez fueron “fármacos milagrosos” son ahora clínicamente ineficaces (Microbial Threats to Health, 2003) .
Como ejemplo, Pseudomonas aeruginosa es un patógeno ubicuo para plantas y animales que está presentando una incidencia rápidamente creciente de resistencia a múltiples fármacos antibióticos (Microbial Threats to Health, 2003;
Bad Bugs, No Drugs, 2004) . P. aeruginosa es un bacilo aerobio, móvil, gram-negativo. P. aeruginosa habita normalmente en el suelo, el agua y la vegetación. Aunque pocas veces provoca enfermedades en personas sanas, es un patógeno oportunista que representa aproximadamente el 10% de todas las infecciones intrahospitalarias (National Nosocomial Infection Survey report-Data Sumario de octubre de 1986-abril de 1996) . P. aeruginosa es el patógeno más común que afecta a pacientes con fibrosis quística (FQ) , presentando el 61% de las muestras cultivadas resultados positivos (Govan, J. R. W. y V. Deretic, 1996, Microbiol. Reviews, 60 (3) :530-574) así como uno de los dos patógenos más comunes observados en unidades de cuidados intensivos (Jarvis, W. R. et al., 1992, J. Antimicrob. Chemother., 29 (un sup.) : 19-24) .
La mortalidad por algunas infecciones por P. aeruginosa puede ser tan alta como el 50%. Actualmente, la infección
45 por P. aeruginosa puede controlarse todavía eficazmente mediante antibióticos, particularmente usando una combinación de fármacos. Sin embargo, se ha mostrado resistencia a varios de los antibióticos comunes y es particularmente problemática en unidades de cuidados intensivos (Archibald, L. et al., 1997, Clin. Infectious Dis., 24 (2) :211-215; Fish, D. N., et al., 1995, Pharmacotherapy, 15 (3) :279-291) . Adicionalmente, P. aeruginosa ha demostrado ya mecanismo para adquirir plásmidos que contienen genes de resistencia a múltiples antibióticos (Jakoby, G. A. (1986) , The bacteria, vol. X, The biology of Pseudomonas, págs. 265-294, J. R. Sokach (ed.) Academic Press, Londres) y en la actualidad no hay ninguna vacuna aprobada para la infección por Pseudomonas.
Como muchas otras especies bacterianas, la variabilidad de cepas en P. aeruginosa es bastante significativa. Se ha mostrado que se produce variabilidad mediante varios mecanismos diferentes, incluyendo estos, pero sin limitarse a,
55 la integración de profagos en un genoma bacteriano (Zierdt, C. H. y P. J. Schmidt, 1964, J. Bacteriol. 87:1003-1010) , la adición del gen de citotoxina de bacteriófagos (Hayashi, T., et al., 1994, FEMS Microbiol. Lett. 122:239-244) y mediante transposones (Sinclair, M. I. y B. W. Holloway, 1982, J. Bacteriol. 151:569-579) . A través de este tipo de diversidad, se han incorporado nuevos mecanismos patógenos en P. aeruginosa. Estas y otras transiciones tales como la conversión al fenotipo mucoide, comúnmente observada en FQ, ilustran claramente la necesidad de una vigilancia continuada.
Estas preocupaciones apuntan a la necesidad de herramientas de diagnóstico y agentes terapéuticos destinados a la identificación apropiada de cepas resistentes a fármacos y la erradicación de la virulencia.
65 Muchas bacterias producen bacteriocinas, que son sustancias bactericidas, durante su crecimiento. Las bacteriocinas están compuestas por polipéptidos y varían en peso molecular. Aunque se han usado bacteriocinas por sus propiedades antibacterianas, algunas tienen espectros bactericidas más limitados que muchos antibióticos usados clínicamente. Por ejemplo, se ha notificado que algunas bacteriocinas reconocen, y de ese modo actúan sólo sobre, miembros de la misma especie o especies estrechamente relacionadas uniéndose a sitios receptores en organismos sensibles, o susceptibles.
Como clasificación amplia, se han dividido las bacteriocinas en tres tipos. Las primeras son moléculas pequeñas que son termoestables. Los ejemplos de este primer tipo incluyen colicina V (siendo las colicinas específicas para bacterias coliformes) . El segundo tipo, piocinas de tipo S producidas por P. aeruginosa, son moléculas proteicas de peso molecular superior. El tercer tipo incluye bacteriocinas que se asemejan genética y mofológicamente a las partes de la cola de bacteriófagos. Los ejemplos de este último tipo incluyen las piocinas de tipo F y de tipo R de P. aeruginosa así como enterocoliticina de Yersinia. Se ha notificado que estas piocinas se derivan de un bacteriófago ancestral, y tienen similitudes con la familia del fago lambda y la familia del fago P2, respectivamente.
Las piocinas de tipo R son similares a las partes de la cola contráctiles y no flexibles de bacteriófagos de la familia
Myoviridae y están codificadas en una única agrupación de genes en el genoma de Pseudomonas (Shinomiya et al., 1983) . Véase la figura 1. Tras unirse específicamente a una bacteria diana, estas piocinas forman un poro en la célula bacteriana, comprometiendo la integridad de su membrana citoplasmática y provocando despolarización de la membrana. Las piocinas de tipo F también son similares a una cola de bacteriófago, pero tienen una estructura similar a un bacilo flexible y no contráctil. Las piocinas se producen por la mayoría de las cepas de P. aeruginosa, y algunas cepas sintetizan más de una piocina.
Las piocinas de tipo R son bacteriocinas de alto peso molecular complejas producidas por algunas cepas de Pseudomonas aeruginosa, y tienen actividad bactericida contra otras determinadas cepas de P. aeruginosa (para una revisión véase Michel-Briand y Baysse, 2002) . Se han identificado hasta la fecha cinco piocinas de tipo R y,
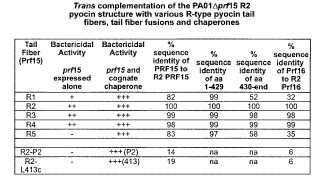
basándose en sus espectros de diana (véase a continuación) , se denominan R1 a R5. La cepa PAO1 produce la piocina R2, que está codificada en una agrupación génica que consiste en 16 marcos de lectura abiertos (ORF) , 12 de los cuales muestran similitud de secuencia significativa con ORF de los bacteriófagos P2, PS17, ΦCTX y otros fagos similares a P2 (Nakayama et al., 2000) . La producción de piocinas se induce por el daño en el ADN (Matsui et al., 1993) y se regula por RecA, que degrada PrtR, el represor de PrtN, un regulador de la transcripción positivo de la agrupación. La inducción de genes de piocinas da como resultado la síntesis de aproximadamente... [Seguir leyendo]
Reivindicaciones:
1. Molécula de ácido nucleico que codifica para una proteína de fibras de la cola de bacteriocina de alto peso molecular (apm) , en la que dicha proteína de fibras de la cola comprende una región de unión a la placa basal
(BPAR) de una piocina de tipo R y un dominio de unión al receptor heterólogo (RBD) , en la que el RBD es de una fibra de la cola de otra bacteriocina o una fibra de la cola de un bacteriófago o profago, en la que la BPAR consiste en los aminoácidos 1-164 ó 1-240 de la fibra de la cola de piocina de tipo R.
2. Molécula de ácido nucleico según la reivindicación 1, en la que dicho RBD de una proteína de fibras de la cola de
bacteriófago comprende desde 347 aminoácidos de longitud hasta 755 aminoácidos de longitud, incluyendo el extremo C-terminal de dicha proteína.
3. Molécula de ácido nucleico según la reivindicación 1, que comprende además una secuencia de ácido nucleico
que codifica para una chaperona relacionada de la proteína de fibras de la cola. 15
4. Molécula de ácido nucleico según la reivindicación 1, en la que el RBD expresado se une a un factor de virulencia
o adaptación en una superficie de una célula bacteriana.
5. Bacteriocina de apm que comprende una proteína de fibras de la cola codificada por una molécula de ácido 20 nucleico según cualquiera de las reivindicaciones 1 a 4.
6. Bacteriocina según la reivindicación 5, en la que la fibra de la cola de piocina de tipo R comprende la secuencia de aminoácidos representada por SEQ ID NO: 1, 3, 5, 7 ó 9.
7. Bacteriocina según la reivindicación 5, en la que dicho RBD se une a un factor de virulencia o adaptación bacteriano.
8. Célula bacteriana transfectada o transformada con, o que contiene, una molécula de ácido nucleico según una
cualquiera de las reivindicaciones 1 a 4. 30
9. Célula bacteriana según la reivindicación 8, en la que una chaperona relacionada de la proteína de fibras de la cola se expresa en la célula.
10. Método de producción de una bacteriocina de apm, comprendiendo dicho método cultivar la célula bacteriana 35 según la reivindicación 9 en condiciones que dan como resultado la producción de la bacteriocina.
11. Método para comprometer la integridad de una membrana citoplasmática de una célula bacteriana, comprendiendo dicho método poner en contacto dicha bacteria con la bacteriocina según la reivindicación 5.
12. Bacteriocina según la reivindicación 5, para su uso en un método para comprometer la integridad de una membrana citoplasmática de una célula bacteriana en un sujeto.
13. Método de formación de una progenie de bacterias no virulentas o no adaptadas a partir de bacterias progenitoras virulentas, comprendiendo dicho método poner en contacto bacterias virulentas con una bacteriocina
45 según la reivindicación 7, en el que la bacteriocina se une a un factor de virulencia o adaptación de dichas bacterias progenitoras virulentas, y seleccionar la progenie de bacterias no virulentas que ya no expresan el factor de virulencia o adaptación.
Patentes similares o relacionadas:
Composiciones de vacunas contra el síndrome reproductivo y respiratorio porcino y las enfermedades asociadas al circovirus porcino, del 29 de Abril de 2020, de Reber Genetics Co., Ltd: Una proteína de fusión que comprende: (a) un dominio de unión a células presentadoras de antígeno (APC) ubicado en el N-terminal de la proteína de fusión, en la […]
POLIPÉPTIDO ANTIBACTERIANO, COMPOSICIÓN QUE LO COMPRENDE Y USO PARA TRATAR INFECCIONES BACTERIANAS, del 23 de Abril de 2020, de UNIVERSIDAD AUTÓNOMA DE CHILE: Se provee de un polipéptido de SEQ ID NO. 1 denominada como COR- X1 y una composición antibacteriana que comprende este polipéptido, opcionalmente un segundo agente […]
Células huéspedes modificadas y usos de las mismas, del 22 de Abril de 2020, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una célula huésped que comprende: i. un ácido nucleico que codifica una glicosiltransferasa derivada de un racimo rfb de Pseudomonas; ii. un ácido nucleico […]
Proteínas insecticidas y métodos para su uso, del 12 de Febrero de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Una construcción de ADN que comprende una molécula de ácido nucleico heteróloga que codifica un polipéptido de PIP-72 que tiene actividad insecticida contra el gusano de […]
Composiciones y métodos para la retirada de biopelículas, del 14 de Agosto de 2019, de UNIVERSITY OF SOUTHERN CALIFORNIA: Un agente interferente que inhibe, compite o valora la unión de una proteína o polipéptido DNABII a un ADN microbiano para su uso en un método de inhibición, prevención […]
Anticuerpos anti-EpCAM y métodos de uso, del 24 de Julio de 2019, de Viventia Bio Inc: Un anticuerpo que se une a la molécula de adhesión de células epiteliales (EpCAM) que comprende: (i) una cadena pesada que tiene una secuencia de aminoácidos […]
Construcciones de proteína USPA2 y usos de las mismas, del 5 de Junio de 2019, de GLAXOSMITHKLINE BIOLOGICALS SA: Una proteína que consiste en la fórmula I: A-(R1)m-(B)n (fórmula I) en la que: A es un fragmento inmunogénico de UspA2 de Moraxella […]
Procedimiento de oxidación biocatalítico con producto génico alkL, del 20 de Febrero de 2019, de EVONIK DEGUSSA GMBH: Procedimiento para la oxidación de una sustancia orgánica utilizando al menos una enzima oxidativa y al menos un producto génico alkL, caracterizado porque el producto […]