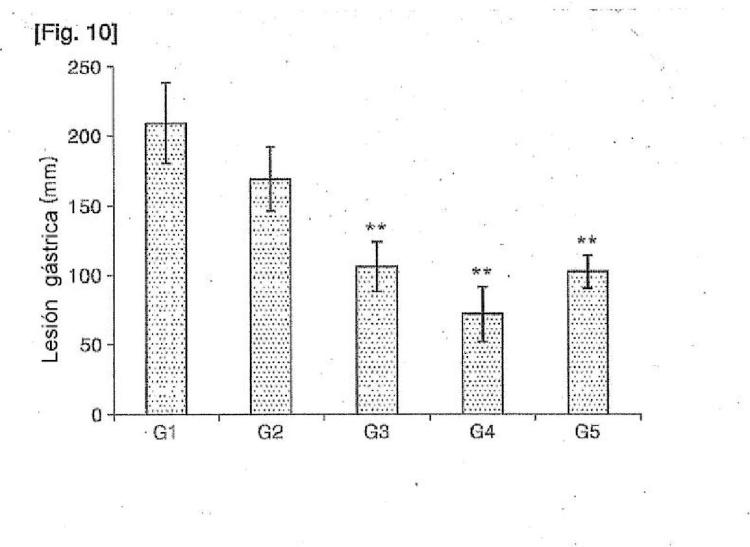
Composición que comprende S-alil-L-cisteína como principio activo para prevenir o tratar lesiones de la mucosa gástrica inducidas por fármacos.
S-alil-L-cisteína, sal farmacéuticamente aceptable de S-alil-L-cisteína,
o solvato o hidrato de la misma como principio activo para su uso en la prevención o el tratamiento de lesiones de la mucosa gástrica inducidas por un fármaco, en la que el fármaco es etanol, aspirina o indometacina.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2010/006506.
Solicitante: Pharmaking Co., Ltd.
Nacionalidad solicitante: República de Corea.
Dirección: 363 Ogung-ri Gamgok-myeon Eumseong-gun, Chungcheongbuk-Do 369-852 REPUBLICA DE COREA.
Inventor/es: KWAK,WIE-JONG, KIM,SOON BAE, KIM,GWANG SOON, KIM,WAN BAE, BANG,SUNG HYE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A23L1/30
- A23L1/305
- A61K31/198 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Alfa-amino-ácidos, p. ej. alanina, ácido etilendiamino tetraacético (EDTA) (betaína A61K 31/205; prolina A61K 31/401; triptófano A61K 31/405; histidina A61K 31/4172; péptidos no degradados en aminoácidos individuales A61K 38/00).
- A61K36/8962 A61K […] › A61K 36/00 Preparaciones medicinales de constitución indeterminada que contienen sustancias procedentes de algas, líquenes, hongos o plantas o sus derivados, p. ej. medicinas tradicionales basadas en plantas. › Allium, p. ej. cebolla, puerro, ajo o cebolleta.
- A61K47/26 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Hidratos de carbono, p. ej. alcoholes de azúcares, amino azúcares, ácidos nucleicos, mono-, di- u oligo-sacáridos; Sus derivados, p. ej. polisorbatos, ésteres de ácidos grasos sorbitano o glicirricina.
- A61K47/38 A61K 47/00 […] › Celulosa; Sus derivados.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
- A61K9/08 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Soluciones.
- A61K9/10 A61K 9/00 […] › Dispersiones; Emulsiones.
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- A61K9/20 A61K 9/00 […] › Píldoras, pastillas o comprimidos.
- A61K9/28 A61K 9/00 […] › Grageas; Píldoras o comprimidos con revestimientos.
- A61P1/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 1/00 Medicamentos para el tratamiento de trastornos del tracto alimentario o del aparato digestivo. › para úlceras, gastritis o reflujo esofágico p.ej. antiácidos, inhibidores de la secreción ácida, protectores de la mucosa.
- A61P31/04 A61P […] › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
PDF original: ES-2553592_T3.pdf



Patentes similares o relacionadas:
Nueva sal de adición de ácido de 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)-N-metilmetanamina, del 15 de Julio de 2020, de DAEWOONG PHARMACEUTICAL CO., LTD.: Una sal de adición de ácido de 1-(5-(2,4-difluorofenil)-1-((3-fluorofenil)sulfonil)-4-metoxi-1H-pirrol-3-il)-Nmetilmetanamina en la que el ácido es ácido […]
Forma cristalina de un derivado de benzimidazol y un método de preparación del mismo, del 24 de Junio de 2020, de HK INNO.N CORPORATION: Una forma cristalina A de un compuesto representado por la siguiente Fórmula 1 que tiene un patrón de difracción de rayos X en polvo usando radiación Cu-Kα, con picos […]
 Método para inhibir la reabsorción ósea, del 24 de Junio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina o fragmento del mismo para su uso en un método para el tratamiento de un trastorno relacionado con el hueso mediante […]
Método para inhibir la reabsorción ósea, del 24 de Junio de 2020, de AMGEN INC.: Un anticuerpo antiesclerostina o fragmento del mismo para su uso en un método para el tratamiento de un trastorno relacionado con el hueso mediante […]
Agonista de receptores de 5-HT4 para gastroparesia, del 3 de Junio de 2020, de RAQUALIA PHARMA INC: Una composición farmacéutica para su uso en el tratamiento de la gastroparesia que comprende una cantidad terapéuticamente eficaz de ácido 4-{[4-({[4-(2,2,2-trifluoroetoxi)-1,2-bencisoxazol-3-il]oxi}metil)piperidin-1-il]metil}tetrahidro-2H-piran-4-carboxílico […]
Composición para su uso oral en el tratamiento de malestar o enfermedad por reflujo gastroesofágico, del 13 de Mayo de 2020, de Neilos S.r.l: Composición que comprende una mezcla que comprende: (i) alginato de sodio; (ii) carbonato de calcio; (iii) bicarbonato de sodio; (iv) la enzima digestiva actinidina […]
Método de producción de lactoferrina, del 6 de Mayo de 2020, de Perraudin, Jean-Paul: Método de producción de lactoferrina que comprende al menos las etapas de: a) desechar la materia prima que no ha sido tratada a una temperatura superior a 50 ºC y seleccionada […]
DERIVADOS DE 4-FENILDIHIDROPIRIDINA PARA EL TRATAMIENTO Y/O PREVENCIÓN DE UNA INFECCIÓN O ENFERMEDAD CAUSADA POR HELICOBACTER, del 23 de Abril de 2020, de FUNDACION INSTITUTO DE INVESTIGACION SANITARIA ARAGON: Derivados de 4-fenildihidropiridina de fórmula I y composiciones farmacéuticas de los mismos, donde el significado para R1, R2, […]
Composición anti-regurgitación que preserva el tránsito intestinal, del 22 de Abril de 2020, de United Pharmaceuticals S.A: Composición nutricional para lactante o niño, caracterizada por que dicha composición comprende algarroba soluble en frío que presenta una […]