SECUENCIA DE ADN Y PROTEÍNA OPTIMIZADA DE UN ANTICUERPO PARA MEJORAR LA CALIDAD Y EL RENDIMIENTO DE PROTEÍNAS DE FUSIÓN CON ANTICUERPOS EXPRESADAS EN BACTERIAS.
Un polipéptido que comprende una primera secuencia de aminoácidos que comprende los aminoácidos 2-120 de la SEC ID Nº:
11 y una segunda secuencia de aminoácidos que comprende los aminoácidos 136-242 de la SEC ID Nº: 11, en el que dicha primera secuencia de aminoácidos y dicha segunda secuencia de aminoácidos están unidas por un grupo espaciador peptídico
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/005632.
Solicitante: TOPOTARGET GERMANY AG.
Nacionalidad solicitante: Alemania.
Dirección: PAUL-EHRLICH-STRASSE 42-44 60596 FRANKFURT AM MAIN ALEMANIA.
Inventor/es: WELS,Winfried,S, DÄLKEN,Benjamin, SCHWARZ,Sylvia,E.
Fecha de Publicación: .
Fecha Solicitud PCT: 10 de Julio de 2008.
Clasificación Internacional de Patentes:
- C07K14/21 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Pseudomonadaceae (F).
- C07K16/32 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra productos de traducción de oncogenes.
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07K16/18 C07K 16/00 […] › contra materiales animales o humanos.
- C07K16/32 C07K 16/00 […] › contra productos de traducción de oncogenes.
- C12N15/62 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356708_T3.pdf
Fragmento de la descripción:
El anticuerpo-toxina scFv(FRP5)-ETA es una proteína de fusión recombinante que consiste en un fragmento de anticuerpo de cadena sencilla derivado del anticuerpo específico de ErbB2 FRP5, unido por fusión de genes a un fragmento truncado de exotoxina A de Pseudomonas. Se ha descrito en detalle en la bibliografía una actividad antitumoral elevada y selectiva de scFv(FRP5)-ETA contra células cancerosas que expresan ErbB2 in vitro, en modelos 5 animales y en pacientes con cáncer. La producción de scFv(FRP5)-ETA por expresión bacteriana en E. coli usando la metodología actual da como resultado, además del producto principal de scFv(FRP5)-ETA intacto, también un fragmento de scFv(FRP5)-ETA truncado como subproducto. La eliminación completa de este fragmento no deseado usando técnicas de purificación de proteínas clásicas no se ha conseguido hasta la fecha.
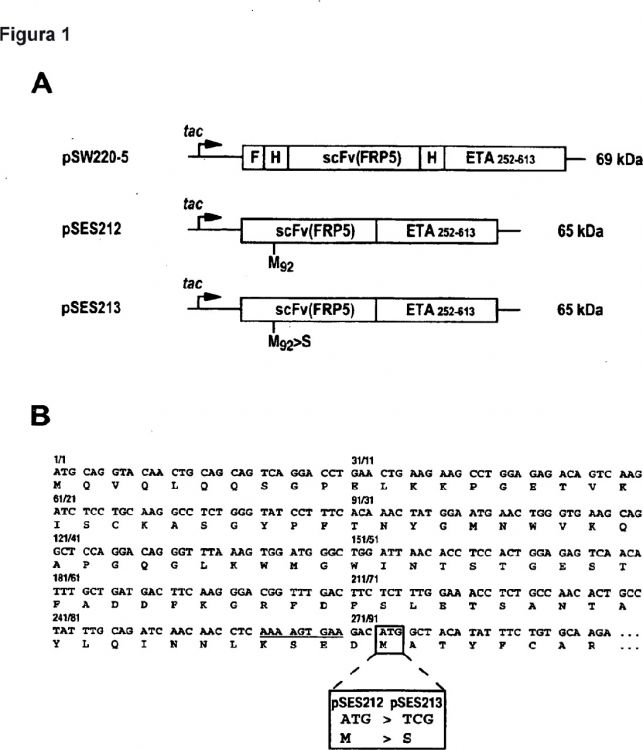
La materia objeto de la invención es una secuencia de ADN optimizada que codifica el fragmento de anticuerpo 10 scFv(FRP5). Esta nueva secuencia evita la generación del subproducto no deseado en el contexto de una proteína de fusión scFv(FRP5)-ETA y posiblemente también otras proteínas de fusión que contienen scFv(FRP5) expresadas en bacterias. La secuencia de ADN del dominio scFv(FRP5) de scFv(FRP5)-ETA se modificó por intercambio de un codón diferente, evitando de este modo un de otro modo posible inicio interno de la traducción de proteína.
ANTECEDENTES DE LA INVENCIÓN 15
Las células epiteliales de la mayoría de órganos expresan típicamente la tirosina quinasa receptora ErbB2 (HER2) a bajos niveles. Sin embargo, en varios tipos de carcinomas, la expresión de ErbB2 está claramente aumentada, con frecuencia como resultado de la amplificación génica. Debido a esta expresión preferente en muchos tumores de origen epitelial, su accesibilidad desde el espacio extracelular y su implicación en el procedimiento de transformación, la tirosina quinasa receptora ErbB2 es una diana preferida para la terapia del cáncer dirigida. 20
Basándose en un derivado de exotoxina A de Pseudomonas truncada que carece del dominio de unión celular endógeno de la toxina, se desarrolló una toxina recombinante que emplea un fragmento de anticuerpo Fv de cadena sencilla del anticuerpo monoclonal específico de ErbB2 FRP5 para la dirigir la toxina ErbB2 (1). En experimentos de destrucción celular in vitro, está molécula de scFv(FRP5)-ETA expresada en bacterias presentaba una actividad antitumoral potente contra un amplio intervalo de células tumorales humanas primarias y establecidas, incluyendo 25 carcinomas de mama y de ovario (1-3), carcinomas de células escamosas (4, 5) y carcinomas de próstata (6). En animales de experimentación, el scFv(FRP5)-ETA inhibía eficazmente el crecimiento de xenoinjertos de tumores humanos establecidos (1, 3-5) y células tumorales de rata y murinas transfectadas de forma estable con construcciones de c-erbB2 humanas (7, 8). En pacientes con cáncer, la inyección intratumoral de scFv(FRP5)-ETA en lesiones cutáneas de tumores que expresan ErbB2 dio como resultado un índice de respuesta del 60%, observándose una 30 regresión completa de los nódulos tumorales inyectados en el 40%, y una reducción parcial en el tamaño de los tumores inyectados en otro 20% de los pacientes (9). En un estudio clínico reciente de fase I, se determinó la dosis máxima tolerada (DMT), la toxicidad limitante de dosis y los parámetros farmacocinéticos de scFv(FRP5)-ETA inyectado por vía intravenosa (10). De este modo, tres de los 18 pacientes mostraban enfermedad estable, y en otros tres pacientes se observaron signos clínicos de actividad en términos de signos y síntomas. 35
SUMARIO DE LA INVENCIÓN
La preparaciones de proteínas terapéuticas para el tratamiento de pacientes humanos deben cumplir niveles de pureza y homogeneidad muy elevados para declararse autorizadas por las autoridades reguladoras. Los subproductos que contaminan preparaciones del compuesto activo pueden causar acontecimientos adversos en un paciente tales como reacciones tóxicas y/o la inducción de respuestas inmunes no deseadas. Por lo tanto, dichos subproductos deben 40 eliminarse en la medida en que sea técnicamente posible, y para cualquier subproducto restante, deben demostrarse individualmente las actividades biológicas posibles o la ausencia de las mismas. Como consecuencia, los costes de producción aumentarán espectacularmente debido a la necesidad de técnicas de purificación sofisticadas y costosas usadas para eliminar dichos subproductos no deseados, y/o debido al ensayo adicional que es necesario si no puede eliminarse un subproducto particular. 45
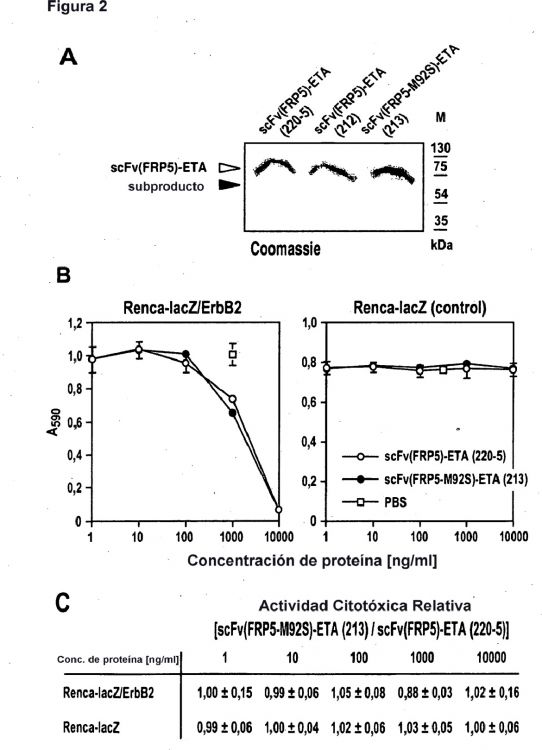
Para la producción del anticuerpo-toxina scFv(FRP5)-ETA para aplicaciones in vivo, hasta ahora se usaba principalmente el vector de expresión bacteriana pSW220-5 (7). Este plásmido codifica una proteína de fusión que consiste en el fragmento de anticuerpo scFV específico de ErbB2 scFv(FRP5) derivado del anticuerpo monoclonal FRP5 (11, 12), fusionado genéticamente con exotoxina A de Pseudomonas truncada (ETA), que representa los restos aminoacídicos 252-613 de la toxina de tipo silvestre. Además, la unidad de expresión de scFv(FRP5)-ETA en el 50 plásmido pSW220-5 incluye secuencias para dos grupos de hexahistidina (His6) y una etiqueta FLAG N-terminal para la purificación y la detección de la proteína (Figura 1A). Las preparaciones de proteína de cultivos de expresión bacteriana transformados con pSW220-5 contienen un producto principal correspondiente al scFv(FRP5)-ETA de longitud completa y un subproducto principal (aproximadamente el 10%) que migra directamente por debajo de la banda principal. Ambas bandas proteicas pueden detectarse en preparaciones de proteína purificadas por tinción con Coomassie de geles de 55 SDS-PAA (véase la Figura 2A, carril izquierdo), y con anticuerpos específicos de ETA en experimentos de inmunotransferencia (no se muestran los datos). Además, experimentos de inmunotransferencia previos pusieron de manifiesto que el subproducto está siendo reconocido por anticuerpos contra la porción de exotoxina A de scFv(FRP5)-ETA. Por lo tanto, se ha pensado que este subproducto se genera durante o después de la expresión por degradación
proteica del scFv(FRP5)-ETA de longitud completa por proteasas bacterianas. Usando técnicas de purificación de proteína convencionales no ha sido posible eliminar hasta ahora este fragmento proteico truncado.
DESCRIPCIÓN DETALLADA DE LA INVENCIÓN Y DE LAS REALIZACIONES EJEMPLARES
Un objeto de la invención es evitar la generación de este fragmento truncado de scFv(FRP5)-ETA sin afectar a las actividades biológicas terapéuticamente pertinentes de la proteína de longitud completa. Tras la aplicación de la 5 presente invención, ya no puede formarse este subproducto no deseado durante la expresión bacteriana. Por lo tanto, pueden producirse ahora fácilmente preparaciones de proteína de mayor pureza.
La presente invención abarca la modificación de la unidad de expresión que codifica el scFv(FRP5)-ETA de tal forma que puede obtenerse una preparación de proteína homogénea a partir de cultivos de expresión bacteriana que carecen del subproducto truncado mencionado anteriormente. Al contrario que las consideraciones previas, los 10 inventores formularon la hipótesis de que el subproducto puede no generarse por degradación proteolítica de la proteína de longitud completa, sino que puede ser el resultado de un inicio alternativo de la traducción de la proteína a partir de un codón AUG interno dentro de la secuencia de scFv(FRP5) del ARNm de scFv(FRP5)-ETA.
En un primer aspecto, la invención se refiere a un polipéptido que comprende una primera secuencia de aminoácidos que comprende los aminoácidos 2-120 de la SEC ID Nº: 11, y una segunda secuencia de aminoácidos que 15 comprende los aminoácidos 136-242 de la SEC ID Nº: 11, en el que dicha primera y segunda secuencia de aminoácidos están unidas por un grupo espaciador peptídico. Preferentemente, el polipéptido de la invención comprende la estructura siguiente:
VH - Sp - VL,
en la que 20
VH es la primera secuencia de aminoácidos,
Sp es el grupo espaciador peptídico, y
VL es la segunda secuencia de aminoácidos.
Por consiguiente, la primera secuencia de aminoácidos está habitualmente en el extremo N-terminal del polipéptido. El polipéptido de la invención es habitualmente un anticuerpo de cadena sencilla en el que el dominio 25 variable de la cadena pesada y... [Seguir leyendo]
Reivindicaciones:
1. Un polipéptido que comprende una primera secuencia de aminoácidos que comprende los aminoácidos 2-120 de la SEC ID Nº: 11 y una segunda secuencia de aminoácidos que comprende los aminoácidos 136-242 de la SEC ID Nº: 11, en el que dicha primera secuencia de aminoácidos y dicha segunda secuencia de aminoácidos están unidas por un grupo espaciador peptídico. 5
2. El polipéptido de acuerdo con la reivindicación 1, en el que dicha primera secuencia de aminoácidos comprende los aminoácidos 2-120 de la SEC ID Nº: 1.
3. El polipéptido de acuerdo con la reivindicación 1 ó 2, en el que dicha primera secuencia de aminoácidos consiste en los aminoácidos 1-120 de la SEC ID Nº: 1.
4. Un polipéptido que comprende una secuencia de aminoácidos seleccionada de la SEC ID Nº: 11 y SEC ID Nº: 10 1 y SEC ID Nº: 12.
5. El polipéptido de acuerdo con una cualquiera de las reivindicaciones anteriores, que comprende además una molécula efectora.
6. El polipéptido de acuerdo con la reivindicación 5, en el que la molécula efectora es un polipéptido que tiene actividad de destrucción celular. 15
7. El polipéptido de acuerdo con la reivindicación 6, en el que el polipéptido que tiene actividad de destrucción celular es una toxina o una variante biológicamente activa de la misma.
8. El polipéptido de acuerdo con la reivindicación 7, en el que la toxina es exotoxina de Pseudomonas o una variante biológicamente activa de la misma.
9. El polipéptido de acuerdo con una cualquiera de las reivindicaciones anteriores, que comprende la secuencia 20 de aminoácidos que se muestra en la SEC ID Nº: 3.
10. El polipéptido de acuerdo con la reivindicación 5, en el que la molécula efectora es una entidad química que tiene actividad de destrucción celular.
11. El polipéptido de acuerdo con la reivindicación 10, en el que la entidad química que tiene actividad de destrucción celular se selecciona del grupo que consiste en fármacos quimioterápicos, compuestos citotóxicos y 25 compuestos citostáticos.
12. El polipéptido de acuerdo con la reivindicación 10, en el que la entidad química que tiene actividad de destrucción celular es una sustancia radiactiva.
13. Un polinucleótido que codifica un polipéptido de acuerdo con una cualquiera de las reivindicaciones 1 a 12.
14. El polinucleótido de acuerdo con la reivindicación 13, que comprende la secuencia de nucleótidos que se 30 muestra en la SEC ID Nº: 2.
15. El polinucleótido de acuerdo con la reivindicación 14, que comprende la secuencia de nucleótidos que se muestra en la SEC ID Nº: 4.
16. Un plásmido o un vector que contiene el polinucleótido de acuerdo con una cualquiera de las reivindicaciones 13 a 15, unido operativamente a una o más secuencias de control de la expresión. 35
17. El plásmido o vector de acuerdo con la reivindicación 16, que contiene además un origen de replicación o una secuencia de replicación autónoma, una o más secuencias marcadoras y, opcionalmente, sitios de restricción adicionales.
18. Una célula huésped transformada con el plásmido o vector de acuerdo con la reivindicación 16 ó 17.
19. La célula huésped de acuerdo con la reivindicación 18, en la que dicha célula huésped es una célula de E. coli. 40
20. Un procedimiento para la preparación de un anticuerpo de cadena sencilla recombinante o un fragmento del mismo, que comprende cultivar una célula huésped de acuerdo con la reivindicación 18 ó 19 en condiciones adecuadas y recuperar el anticuerpo de cadena sencilla recombinante o fragmento del mismo.
21. El uso de un polipéptido de acuerdo con una cualquiera de las reivindicaciones 1 a 12 o de un polinucleótido de acuerdo con una cualquiera de las reivindicaciones 13 a 15, para la fabricación un medicamento para el tratamiento de 45 un trastorno que implica una actividad y/o expresión anormal de ErbB2.
22. El uso de acuerdo con la reivindicación 21, en el que el trastorno a tratar es un cáncer
.23. El uso de acuerdo con la reivindicación 22, en el que el cáncer se selecciona del grupo que consiste en cáncer de mama, cáncer de próstata, cáncer de ovario, carcinoma de células escamosas, cáncer de cabeza y cuello, cáncer pulmonar no microcítico, cáncer de páncreas, cáncer gástrico, cáncer de glándulas salivares, tumores parotídeos, melanoma, carcinoma cervical, cáncer de páncreas, cáncer de colon y colorrectal, cáncer de vejiga, meduloblastoma, cáncer de riñón, cáncer de hígado y cáncer de estómago. 5
24. Un procedimiento para mejorar la producción de un anticuerpo recombinante de cadena sencilla dirigido contra el dominio extracelular de la tirosina quinasa receptora ErbB2, que comprende impedir el inicio de la traducción a partir del codón Nº 92 de la SEC ID Nº: 10.
25. El procedimiento de acuerdo con la reivindicación 24, que comprende modificar en un polinucleótido que comprende la SEC ID Nº: 10 uno o más nucleótidos en las posiciones 262-270 de la SEC ID Nº: 10. 10
26. El procedimiento de acuerdo con la reivindicación 24, que comprende sustituir el codón Nº 92 en la secuencia de nucleótidos de la SEC ID Nº: 10 con un codón que codifique un aminoácido distinto de metionina.
27. El procedimiento de acuerdo con la reivindicación 26, caracterizado porque el aminoácido distinto de metionina es serina.
28. El procedimiento de acuerdo con la reivindicación 24, que comprende delecionar el codón Nº 92. 15
Patentes similares o relacionadas:
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
Anticuerpos contra HER2 biespecíficos, del 1 de Julio de 2020, de MEDIMMUNE, LLC: Un anticuerpo anti-HER2 biespecifico que comprende un primer dominio de union a antigeno de inmunoglobulina y un segundo dominio de union a antigeno de inmunoglobulina, […]
Anticuerpos anti-CD3 y métodos de uso, del 27 de Mayo de 2020, de GENENTECH, INC.: Un anticuerpo anti-CD3 que es un anticuerpo biespecífico, en donde el anticuerpo biespecífico comprende un brazo anti-CD3 que comprende un primer dominio de unión que […]
Anticuerpos anti-CD3 y métodos de uso, del 27 de Mayo de 2020, de GENENTECH, INC.: Un anticuerpo biespecífico que comprende un brazo anti-CD3 que comprende un primer dominio de unión que comprende (a) un dominio VH que comprende una secuencia de aminoácidos […]
Inmunotoxinas de unión a CD20 para inducir la internalización celular y procedimientos que usan las mismas, del 6 de Mayo de 2020, de MOLECULAR TEMPLATES, INC: Una proteína de unión a CD20 que comprende: a) una región de unión a CD20 que comprende una región de unión de tipo inmunoglobulina: (i) capaz […]
Células NK-92 que expresan CAR como agentes terapéuticos celulares, del 6 de Mayo de 2020, de CHEMOTHERAPEUTISCHES FORSCHUNGSINSTITUT GEORG-SPEYER-HAUS: Una célula o línea celular NK-92 específica de ErbB2, que contiene un vector lentiviral que codifica un receptor de antígeno quimérico que comprende […]
Moléculas de fusión anticuerpos-mutante de interferón modificadas, del 6 de Mayo de 2020, de ImmunGene, Inc: Una molécula de fusión genéticamente modificada que comprende un anticuerpo antígeno asociado a tumor (AAT) (Ab) unido a una molécula mutante de interferón alfa (IFN-α), […]
Proteínas que comprenden regiones efectoras de la subunidad A de la toxina Shiga próximas al extremo amino terminal y regiones de unión de tipo inmunoglobulina de reconocimiento celular capaces de unirse específicamente a HER2/neu/ErbB2, del 6 de Mayo de 2020, de MOLECULAR TEMPLATES, INC: Proteína citotóxica que comprende: a) una región de unión de tipo inmunoglobulina que comprende uno o más polipéptidos y es capaz de unirse específicamente a […]