Métodos para la identificación de moléculas que interaccionan con cinasas y para la purificación de proteínas de cinasa.
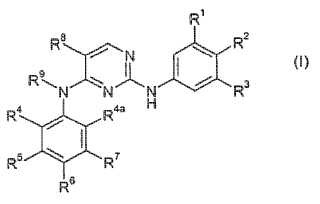
Compuesto de inmovilización de fórmula (I)**Fórmula**
o una sal del mismo,
en la que
uno de R1, R2, R3 es X-(CH2)n-NH2 y los otros dos se seleccionan independientemente del grupo queconsiste en H; halógeno; CN; C(O)OR10; OR10; C(O)R10; C(O)N(R10R10a); S(O)2N(R10R10a);S(O)N(R10R10a); S(O)2R10; S(O)R10; N(R10)S(O)2N(R10aR10b); SR10; N(R10R10a); NO2; OC(O)R10;N(R10)C(O)R10a; N(R10)S(O)2R10a; N(R10)S(O)R10a; N(R10)C(O)N(R10aR10b); N(R10)C(O)OR10a;OC(O)N(R10R10a); alquilo C1-6; alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 yel alquinilo C2-6 opcionalmente sustituidos con uno o más de R11, que son iguales o diferentes.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2010/002050.
Solicitante: Cellzome GmbH.
Nacionalidad solicitante: Alemania.
Dirección: Meyerhofstrasse 1 69117 Heidelberg ALEMANIA.
Inventor/es: HARRISON, JOHN, RAMSDEN,NIGEL, MAJOR,JEREMY, LEGGATE,DANIEL, GRANDI,PAOLA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D239/48 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 239/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,3 o diazina-1,3 hidrogenada. › Dos átomos de nitrógeno.
- C12N11/06 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 11/00 Enzimas fijadas sobre un soporte o inmovilizadas; Células microbianas fijadas sobre un soporte o inmovilizadas; Su preparación. › unidas al soporte por medio de un agente de puenteo.
- C12Q1/48 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que interviene una transferasa.
PDF original: ES-2423804_T3.pdf
Fragmento de la descripción:
Métodos para la identificación de moléculas que interaccionan con cinasas y para la purificación de proteínas de cinasa La presente invención se refiere a compuestos de inmovilización, a productos de inmovilización y a preparaciones de los mismos así como a métodos y usos para la identificación de compuestos que interaccionan con cinasas o para la purificación o identificación de proteínas de cinasa.
Las cinasas catalizan la fosforilación de proteínas, lípidos, azúcares, nucleósidos y otros metabolitos celulares y desempeñan papeles claves en todos los aspectos de la fisiología de células eucariotas. Especialmente, proteína cinasas y lípido cinasas participan en los acontecimientos de señalización que controlan la activación, el crecimiento, la diferenciación y la supervivencia de células en respuesta a mediadores o estímulos extracelulares tales como factores de crecimiento, citocinas o quimiocinas. En general, las proteína cinasas se clasifican en dos grupos, las que fosforilan preferentemente residuos de tirosina y las que fosforilan preferentemente residuos de serina y/o treonina.
Una actividad proteína cinasa inapropiadamente alta está implicada en muchas enfermedades incluyendo cáncer, enfermedades metabólicas y trastornos autoinmunitarios/inflamatorios. Esto puede estar provocado o bien directa o bien indirectamente por el fallo de mecanismos de control debido a mutación, sobreexpresión o activación inapropiada de la enzima. En todos estos casos, se espera que la inhibición selectiva de la cinasa tenga un efecto terapéutico beneficioso.
El complemento de proteína cinasas codificado en el genoma humano comprende 518 miembros de la familia (quinoma) que pueden agruparse en varias subfamilias según la similitud de secuencia (revisión: Manning et al., 2002, The Protein Kinase Complement of the Human Genome, Science 298, 1912-1934) . Se buscan inhibidores de cinasas de molécula pequeña como nuevos agentes terapéuticos anticancerígenos. La comprensión de la selectividad de un inhibidor de cinasa es crucial para el objetivo de desarrollar inhibidores selectivos para cinasas terapéuticamente relevantes (Zhang et al., 2009. Nature Reviews Cancer 9, 28-39) . El repertorio de cinasas seleccionadas como diana por un inhibidor dado puede determinarse obteniendo el perfil de su actividad en ensayos enzimáticos y de unión frente a paneles extensos de cinasas recombinantes, obteniendo el perfil de actividad en ensayos celulares y mediante enfoques de afinidad combinados con detección mediante espectrometría de masas.
Las cinasas también son dianas terapéuticas importantes para el desarrollo de fármacos antiinflamatorios (Cohen, 2009. Current Opinion in Cell Biology 21, 1-8) , por ejemplo las cinasas que están implicadas en la organización de las respuestas inmunitarias adaptativa e innata. Dianas de cinasas de particular interés son los miembros de la familia IRAK y NIK.
Las cinasas asociadas a receptores de interleucina-1 (IRAK) están implicadas de manera crítica en la regulación de redes de señalización intracelular que controlan la inflamación (Ringwood y Li, 2008. Cytokine 42, 1-7) . Se expresan IRAK en muchos tipos de células y pueden mediar en señales de diversos receptores celulares incluyendo receptores tipo toll (TLR) . Se cree que IRAK4 es la proteína cinasa inicial activada posteriormente al receptor de interleucina-1 (IL-1) y todos los receptores tipo toll (TLR) excepto TLR3, e inicia la señalización en el sistema inmunitario innato mediante la activación rápida de IRAK1 y la activación más lenta de IRAK2. Se identificó IRAK1 por primera vez a través de la purificación bioquímica de la actividad cinasa dependiente de IL-1 que se inmunoprecipita conjuntamente con el receptor tipo 1 de IL-1 (Cao et al., 1996. Science 271 (5252) :1128-31) . Se identificó IRAK2 mediante la búsqueda en la base de datos de etiquetas de secuencia expresada humana (EST) de secuencias homólogas a IRAK1 (Muzio et al., 1997. Science 278 (5343) :1612-5) . Se identificó IRAK3 (también denominada IRAKM) usando una secuencia de EST murina que codifica para un polipéptido con homología significativa a IRAK1 para explorar una biblioteca de ADNc de leucocitos de sangre periférica (PBL) activados por fitohemaglutinina humana (Wesche et al., 1999. J. Biol. Chem. 274 (27) :19403-10) . Se identificó IRAK4 mediante búsqueda en la base de datos de secuencias tipo IRAK y PCR de una biblioteca de ADNc universal (Li et al., 2002. Proc. Natl. Acad. Sci. USA 99 (8) :5567-5572) .
Ratones que expresan un mutante catalíticamente inactivo de IRAK4 en lugar de la cinasa de tipo natural son completamente resistentes al choque septicémico desencadenado por varios agonistas de TLR y su respuesta a IL-1 está alterada. Niños que carecen de actividad IRAK4 debido a un defecto genético padecen infecciones recurrentes por bacterias piógenas. Parece que TLR e IL-IR dependientes de IRAK son vitales para la inmunidad infantil contra algunas bacterias piógenas pero desempeñan un papel superfluo en la inmunidad protectora frente a la mayoría de las infecciones en adultos. Por tanto, los inhibidores de IRAK4 pueden ser útiles para el tratamiento de enfermedades inflamatorias crónicas en adultos sin hacerlos demasiado susceptibles a infecciones bacterianas y virales (Cohen, 2009. Current Opinion in Cell Biology 21, 1-8) . Se han desarrollado potentes inhibidores de IRAK4 (Buckley et al., 2008. Bioorg Med Chem Lett. 18 (12) :3656-60) . IRAK1 es esencial para la activación mediada por TLR7 y mediada por TLR9 de IRF7 y la producción de interferón-alfa (IFN-α) lo que sugiere que los inhibidores de IRAK1 pueden ser útiles para el tratamiento de lupus eritematoso sistémico (LES) . IRAK2 se activa posteriormente a IRAK4 y desempeña un papel en la producción de citocinas proinflamatorias. Por tanto, los inhibidores de IRAK2
pueden ser útiles para enfermedades inflamatorias.
La cinasa inductora de NF-kappa-B (NIK) es una serina/treonina cinasa citoplasmática que activa NF-kappa-B principalmente a través de la ruta de NF-kappa-B no canónica (Malinin et al., 1997. Nature 385 (6616) :540-544) . La ruta de NF-kappa-B no canónica o alternativa se activa mediante varios ligandos de la familia de TNF que conducen a actividad y expresión elevada de NIK. Pruebas recientes sugieren que la activación constitutiva de la ruta de NFkappa-B no canónica es una causa frecuente de mieloma múltiple (MM) y resulta de mutaciones inactivantes en TRAF3 y/o expresión elevada de NIK. La expresión potenciada de NIK puede estar provocada por la pérdida de TRAF3 o mutaciones en el propio gen de NIK (Annunziata et al., 2007. Cancer Cell 12 (2) :115-130; Keats et al., 2007. Cancer Cell 12 (2) :131-144) . Por tanto, fármacos que inhiben NIK pueden ser útiles para el tratamiento de este cáncer del sistema inmunitario (Cohen, 2009. Current Opinion in Cell Biology 21, 1-8) .
Otro requisito previo, aunque no necesario en todos los casos, para la identificación de inhibidores de cinasas selectivos es un método que permite determinar la selectividad de diana de estas moléculas. Por ejemplo, puede pretenderse proporcionar moléculas que se unan a e inhiban una diana de fármaco particular pero que no interaccionen con una diana estrechamente relacionada, cuya inhibición podría llevar a efectos secundarios no deseados. Convencionalmente se usan grandes paneles de ensayos enzimáticos individuales para evaluar el efecto inhibidor de un compuesto para cinasas (Davies et al., 2000. Biochemical Journal 351 (Pt 1) :95-105; Bain et al., 2007. Biochemical Journal 408 (3) :297-315) . Más recientemente, se han empleado cinasas o dominios cinasa presentados en bacteriófagos para evaluar la capacidad de un compuesto dado para interaccionar con un conjunto grande de cinasas (Karaman et al., 2008. Nature Biotechnology 26, 127-132) . Además, se han descrito métodos proteómicos químicos que permiten la obtención del perfil de inhibidores de cinasas frente al proteoma (documento WO 2006/134056; Bantscheff et al., 2007. Nature Biotechnology 25, 1035-1044; Patricelly et al., 2007. Biochemistr y 46, 350-358; Gharbi et al., 2007. Biochem. J. 404, 15-21; documento WO2008/015013) .
El documento WO 2007/053452 A1 da a conocer compuestos de biaril-meta-pirimidina que pueden inhibir cinasas, tales como miembros de la familia de Jak cinasa y diversas otras cinasas receptoras y no receptoras específicas. Sin embargo, este documento no está dirigido a productos de inmovilización que son útiles para la identificación de moléculas que interaccionan con cinasas incluyendo la purificación de proteínas de cinasa. Los compuestos de la presente invención difieren de los compuestos dados a conocer en el documento WO 2007/053452 A1 en... [Seguir leyendo]
Reivindicaciones:
1. Compuesto de inmovilización de fórmula (I)
o una sal del mismo, en la que uno de R1, R2, R3 es X- (CH2) n-NH2 y los otros dos se seleccionan independientemente del grupo que consiste en H; halógeno; CN; C (O) OR10; OR10; C (O) R10; C (O) N (R10R10a) ; S (O) 2N (R10R10a) ; S (O) N (R10R10a) ; S (O) 2R10; S (O) R10; N (R10) S (O) 2N (R10aR10b) ; SR10; N (R10R10a) ; NO2; OC (O) R10; N (R10) C (O) R10a; N (R10) S (O) 2R10a; N (R10) S (O) R10a; N (R10) C (O) N (R10aR10b) ; N (R10) C (O) OR10a; OC (O) N (R10R10a) ; alquilo C1-6; alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6 opcionalmente sustituidos con uno o más de R11, que son iguales o diferentes;
X es un enlace químico covalente sencillo; O; S; NH; NHC (O) o C (O) NH;
n es 0; 1; 2; 3; 4; 5 ó 6, cuando X es un enlace químico covalente sencillo o NHC (O) ; y n es 2; 3; 4; 5 ó 6, cuando X es O; S o C (O) NH;
R10, R10a, R10b se seleccionan independientemente del grupo que consiste en H; alquilo C1-6; alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6 opcionalmente sustituidos con uno o más de R12, que son iguales o diferentes;
R11, R12 se seleccionan independientemente del grupo que consiste en halógeno; CN; C (O) OR13; OR13; C (O) R13; C (O) N (R13R13a) ; S (O) 2N (R13R13a) ; S (O) N (R13R13a) ; S (O) 2R13; S (O) R13; N (R13) S (O) 2N (R13aR13b) ; N (R13) S (O) N (R13aR13b) ; SR13; N (R13R13a) ; NO2; OC (O) R13; N (R13) C (O) R13a; N (R13) S (O) 2R13a; N (R13) S (O) R13a; N (R13) C (O) N (R13aR13b) ; N (R13) C (O) OR13a y OC (O) N (R13R13a) ;
R13, R13a, R13b se seleccionan independientemente del grupo que consiste en H; alquilo C1-6; alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6 opcionalmente sustituidos con uno o más halógenos, que son iguales o diferentes;
R4, R5, R6, R7, R4a se seleccionan independientemente del grupo que consiste en H; X1; halógeno;
CN; C (O) OR14; OR14; C (O) R14; C (O) N (R14R14a) ; S (O) 2N (R14R14a) ; S (O) N (R14R14a) ; S (O) 2R14; S (O) R14; SR14; N (R14R14a) ; NO2; OC (O) R14; N (R14) C (O) R14a; N (R14) S (O) 2R14a; N (R14) S (O) R14a; N (R14) C (O) N (R14aR14b) ; N (R14) C (O) OR14a; OC (O) N (R14R14a) ; alquilo C1-6; alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6 opcionalmente sustituidos con uno o más de R15, que son iguales o diferentes,
siempre que uno de R4, R5, R6, R7, R4a sea X1;
R14, R14a, R14b se seleccionan independientemente del grupo que consiste en H; alquilo C1-6; alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6
opcionalmente sustituidos con uno o más de R16, que son iguales o diferentes;
R15, R16 se seleccionan independientemente del grupo que consiste en halógeno; CN; C (O) OR17; OR17; C (O) R17; C (O) N (R17R17a) ; S (O) 2N (R17R17a) ; S (O) N (R17R17a) ; S (O) 2R17; S (O) R17; N (R17) S (O) 2N (R17aR17b) ; N (R17) S (O) N (R17aR17b) ; SR17; N (R17R17a) ; NO2; OC (O) R17; N (R17) C (O) R17a;
N (R17) S (O) 2R17a; N (R17) S (O) R17a; N (R17) C (O) N (R17aR17b) ; N (R17) C (O) OR17a; OC (O) N (R17R17a) ; alquilo C1-6; alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6
opcionalmente sustituidos con uno o más halógenos, que son iguales o diferentes;
R17, R17a, R17b se seleccionan independientemente del grupo que consiste en H; alquilo C1-6;
alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6
5 opcionalmente sustituidos con uno o más halógenos, que son iguales o diferentes;
X1 es N (R1S18a) S (O) 2R18 o N (R18a) S (O) 2N (R18bR18) ;
R9, R18a, R18b se seleccionan independientemente del grupo que consiste en H; alquilo C1-4;
10 cicloalquilo C3-5 y (cicloalquil C3-5) -metilo, estando el alquilo C1-4; el cicloalquilo C3-5 y el (cicloalquil
C3-5) -metilo opcionalmente sustituidos con uno o más halógenos, que son iguales o diferentes;
R18 es T; alquilo C1-6; alquenilo C2-6 o alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6 opcionalmente sustituidos con uno o más de R19, que son iguales o diferentes;
15
R19 es T; halógeno; CN; C (O) OR20; OR20; C (O) R20; C (O) N (R20R20a) ; S (O) 2N (R20R20a) ; S (O) N (R20R20a) ; S (O) 2R20; S (O) R20; N (R20) S (O) 2N (R) 20aR20b) ; N (R20) S (O) N (R20aR20b) ; SR20; N (R20R20a) ; NO2; OC (O) R20; N (R20) C (O) R20a; N (R20) S (O) 2R20a; N (R20) S (O) R20a; N (R20) C (O) N (R20aR20b) ; N (R20) C (O) OR20a; OC (O) N (R20R20a) ; alquilo C1-6; alquenilo C2-6 o alquinilo
20 C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6 opcionalmente sustituidos con uno o
más halógenos, que son iguales o diferentes;
R20, R20a, R20b se seleccionan independientemente del grupo que consiste en H; alquilo C1-6;
alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6
25 opcionalmente sustituidos con uno o más halógenos, que son iguales o diferentes;
T es fenilo; cicloalquilo C3-7; o heterociclilo de 4 a 7 miembros, estando T opcionalmente sustituido con uno o más de R21, que son iguales o diferentes;
30 R21 es halógeno; CN; C (O) OR22; OR22; oxo (=O) , estando el anillo al menos parcialmente saturado; C (O) R22; C (O) N (R22R22a) ; S (O) 2N (R22R22a) ; S (O) N (R22R22a) ; S (O) 2R22; S (O) R22; N (R22) S (O) 2N (R22aR22b) ; N (R22) S (O) N (R22aR22b) ; SR22; N (R22R22a) ; NO2; OC (O) R22; N (R22) C (O) R22a; N (R22) S (O) 2R22a; N (R22) S (O) R22a; N (R22) C (O) N (R22aR22b) ; N (R22) C (O) OR22a; OC (O) N (R22R22a) ;
alquilo C1-6; alquenilo C2-6 o alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6
35 opcionalmente sustituidos con uno o más halógenos, que son iguales o diferentes;
R22, R22a, R22b se seleccionan independientemente del grupo que consiste en H; alquilo C1-6;
alquenilo C2-6 y alquinilo C2-6, estando el alquilo C1-6; el alquenilo C2-6 y el alquinilo C2-6
opcionalmente sustituidos con uno o más halógenos, que son iguales o diferentes;
40
R8 es H; F; Cl; Br; CN; alquilo C1-4; CH2F; CHF2; CF3; OH; OCH3; NO2; NH2; NHCH3; N (CH3) 2 o NO2.
2. Compuesto de inmovilización según la reivindicación 1, seleccionado del grupo que consiste en
y
3. Método para la preparación de un producto de inmovilización, en el que al menos un compuesto de inmovilización según la reivindicación 1 ó 2 se inmoviliza sobre un soporte sólido, en particular en el que el
soporte sólido se selecciona del grupo que consiste en agarosa, agarosa modificada, perlas de Sepharose (por ejemplo Sepharose activada con NHS) , látex, celulosa y partículas ferro o ferrimagnéticas.
4. Método según la reivindicación 3, en el que el producto de inmovilización resulta de una unión covalente directa o mediada por ligador del compuesto de inmovilización al soporte sólido, en particular en el que el 10 ligador es un grupo alquileno C1-10, que está interrumpido o terminado opcionalmente por uno o más átomos o grupos funcionales seleccionados del grupo que consiste en S, O, NH, C (O) O, C (O) y C (O) NH y estando el ligador opcionalmente sustituido con uno o más sustituyentes seleccionados independientemente del grupo que consiste en halógeno, OH, NH2, C (O) H, C (O) NH2, SO3H, NO2 y CN, en particular en el que dicha inmovilización se produce mediante el grupo amino primario en el residuo X
(CH2) n-NH2 para uno de R1, R2, R3 en la fórmula (I) según la reivindicación 1.
5. Producto de inmovilización, que puede obtenerse mediante el método según cualquiera de las reivindicaciones 3 ó 4.
a) proporcionar una preparación proteica que contiene una variedad de cinasas,
b) poner en contacto la preparación proteica con el producto de inmovilización según cualquiera de las 30 reivindicaciones 5 ó 6 y con un compuesto dado en condiciones que permiten la formación de uno o más complejos diferentes entre una de las cinasas y el producto de inmovilización, y
c) detectar el complejo o los complejos formados en la etapa b) .
8. Método para la identificación de un compuesto que interacciona con cinasa, que comprende las etapas de:
a) proporcionar dos alícuotas de una preparación proteica que contiene una variedad de cinasas,
b) poner en contacto una alícuota con el producto de inmovilización según cualquiera de las 40 reivindicaciones 5 ó 6 en condiciones que permiten la formación de uno o más complejos diferentes entre una de las cinasas y el producto de inmovilización,
c) poner en contacto la otra alícuota con el producto de inmovilización según cualquiera de las reivindicaciones 5 ó 6 y con un compuesto dado en condiciones que permiten la formación de uno o más 45 complejos diferentes entre una de las cinasas y el producto de inmovilización, y
d) determinar la cantidad del complejo o de los complejos formados en las etapas b) y c) .
9. Método para la identificación de un compuesto que interacciona con cinasa, que comprende las etapas de:
a) proporcionar dos alícuotas que comprenden cada una al menos una célula que contiene una variedad de cinasas, b) incubar una alícuota con un compuesto dado,
c) recoger las células de cada alícuota,
d) lisar las células con el fin de obtener preparaciones proteicas,
e) poner en contacto las preparaciones proteicas con el producto de inmovilización según cualquiera de las reivindicaciones 5 ó 6 en condiciones que permiten la formación de uno o más complejos diferentes entre una de las cinasas y el producto de inmovilización, y
f) determinar la cantidad del complejo o de los complejos formados en cada alícuota en la etapa e) .
10. Método según cualquiera de las reivindicaciones 7 a 9, en el que la variedad de cinasas incluye uno o más miembros de la familia IRAK, preferiblemente IRAK 1 o IRAK 4. 15
11. Método según cualquiera de las reivindicaciones 7 a 9, en el que la variedad de cinasas incluye NIK.
12. Método según cualquiera de las reivindicaciones 8 a 11, en el que una cantidad reducida del complejo
formado en la alícuota incubada con el compuesto en comparación con la alícuota no incubada con el 20 compuesto indica que dicha cinasa es una diana del compuesto.
13. Método según cualquiera de las reivindicaciones 8 a 11, en el que la cantidad del complejo se determina mediante la separación de la cinasa del producto de inmovilización y la posterior detección de la cinasa separada o la posterior determinación de la cantidad de la cinasa separada, en particular en el que la cinasa se detecta o la cantidad de la cinasa se determina mediante métodos de espectrometría de masas o de inmunodetección, preferiblemente con un anticuerpo dirigido contra la cinasa.
14. Método según cualquiera de las reivindicaciones 7 a 13, en el que dicho compuesto dado se selecciona del
grupo que consiste en compuestos sintéticos o fármacos sintéticos orgánicos, más preferiblemente 30 fármacos orgánicos de molécula pequeña y compuestos de molécula pequeña naturales.
15. Método según cualquiera de las reivindicaciones 7 a 14, en el que el compuesto dado es un inhibidor de cinasa.
16. Método según cualquiera de las reivindicaciones 7 a 15, en el que el suministro de una preparación proteica incluye las etapas de recoger al menos una célula que contiene cinasas y lisar la célula.
17. Método según cualquiera de las reivindicaciones 7 a 16, en el que las etapas de la formación del complejo se realizan en condiciones esencialmente fisiológicas. 40
18. Método para determinar la presencia de una o más cinasas en una muestra, que comprende las etapas de:
a) proporcionar una preparación proteica de la que se espera que contenga dicha una o más cinasas,
b) poner en contacto la preparación proteica con el producto de inmovilización según cualquiera de las reivindicaciones 5 ó 6 en condiciones que permiten la formación de un complejo entre una de las cinasas y el producto de inmovilización, y
c) detectar si una o más cinasas han formado un complejo con el producto de inmovilización. 50
19. Uso del compuesto de inmovilización según cualquiera de las reivindicaciones 1 ó 2 o del producto de inmovilización según cualquiera de las reivindicaciones 5 ó 6 para la identificación de compuestos que interaccionan con cinasas o para la purificación de cinasas.
Patentes similares o relacionadas:
Glicoproteínas sialiladas, del 25 de Marzo de 2020, de MOMENTA PHARMACEUTICALS, INC: Procedimiento para producir una preparación de glicoproteínas que comprenden regiones Fc que comprenden glicanos ramificados que comprenden un brazo α1,3 […]
Procedimientos para determinar si un paciente logrará una respuesta después de la radioterapia, del 14 de Agosto de 2019, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE (INSERM): Un procedimiento para determinar si un paciente que padece un cáncer logrará una respuesta después de la radioterapia que comprende las etapas de: i) determinar […]
Métodos para medir actividad enzimática, útiles para determinar la viabilidad celular en muestras no purificadas, del 24 de Julio de 2019, de Momentum Bioscience Limited: Un kit de ensayo para uso en un método para la detección de la actividad de la polimerasa como un indicador de la presencia de un microrganismo […]
Conjugados de proteína-agente activo y método para preparar los mismos, del 26 de Junio de 2019, de LegoChem Biosciences, Inc: Conjugado anticuerpo-agente activo, en el que el anticuerpo tiene un resto de aminoácido que puede ser reconocido por una isoprenoide transferasa, en el que el agente […]
ADN polimerasas de tipo A modificadas, del 19 de Junio de 2019, de Kapa Biosystems, Inc: Una ADN polimerasa Taq modificada que cataliza la polimerización de desoxinucleótidos y: (a) tiene una secuencia de aminoácidos que es al menos un 95 % idéntica a la […]
Sistemas y procedimientos para predecir la respuesta al minoxidil para el tratamiento de la alopecia androgenética, del 5 de Junio de 2019, de Follea International Ltd: Procedimiento de selección de un tratamiento para un sujeto que padece alopecia androgenética, que comprende: (i) realizar un ensayo para medir la actividad […]
Método para determinar la respuesta del cáncer a tratamientos dirigidos al receptor del factor de crecimiento epidérmico, del 8 de Mayo de 2019, de THE GENERAL HOSPITAL CORPORATION: Una proteína del EGFR que comprende una o más variaciones o mutaciones que confieren capacidad de respuesta a la terapia con inhibidores de la tirosina […]
Método para determinar la respuesta del cáncer a tratamientos dirigidos al receptor del factor de crecimiento epidérmico, del 8 de Mayo de 2019, de THE GENERAL HOSPITAL CORPORATION: Una sonda seleccionada de: A. una sonda capaz de distinguir la presencia de una variación o variaciones particulares en el dominio de la quinasa del gen erbB1 de un paciente […]