Suministro de formulaciones viscosas por inyección sin aguja.
Un dispositivo para el suministro de un principio activo farmacéutico,
que comprende:
un inyector sin aguja y
una formulación que tiene una viscosidad superior a 10 cS aproximadamentem a 20ºC;
en el cual el inyector sin aguja comprende:
un recipiente que contiene la formulación;
un accionador y una pieza impulsora que puede desplazarse una cierta trayectoria para lograr que aproximadamente0,5 ml de la formulación o más puedan suministrarse desde el recipiente, en 0,5 segundos o menos;
en el cual la formulación se suministra a través de una boquilla, que comprende un canal y una abertura de salidaconfigurada para lograr una relación del largo del canal al diámetro de la abertura de salida inferior a 10.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/044778.
Solicitante: ZOGENIX, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3829 POINT EDEN WAY HAYWARD, CA 94545 ESTADOS UNIDOS DE AMERICA.
Inventor/es: FARR, STEPHEN, J., BOYD,BROOKS M, MUDUMBA,SUJATA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61M5/30 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › A61M 5/00 Dispositivos para introducir agentes en el cuerpo vía subcutánea, intravenosa o intramuscular; Accesorios correspondientes, p. ej. dispositivos de llenado o de limpieza, reposa-brazos (conectores o acoplamientos para tubos, válvulas o conjuntos de derivación, especialmente concebidos para uso médico A61M 39/00; recipientes especialmente adaptados para fines médicos o farmacéuticos A61J 1/00). › Jeringas para inyección por proyección, sin aguja, p. ej. utilizables con ampollas o cartuchos intercambiables.
PDF original: ES-2437581_T3.pdf
Fragmento de la descripción:
Suministro de formulaciones viscosas por inyección sin aguja Campo de la invención La presente invención se refiere al suministro de formulaciones viscosas mediante una inyección sin aguja, para 5 aplicaciones parenterales y aplicaciones farmacéuticas de otra índole. Se enumeran diversas clases de formulaciones y vehículos por su aplicabilidad para el suministro sin aguja.
Antecedentes de la invención El desarrollo de fármacos modernos significa que el mercado para los fármacos inyectables está creciendo, dado que la mayoría de estas moléculas son demasiado grandes y frágiles como para ser suministradas por otros 10 métodos, tales como la vía oral. Sin embargo, muchas de estas moléculas son difíciles de formular en soluciones estables que sean lo suficientemente concentradas como para inyectar una cantidad eficaz en una dosis con un tamaño razonable (< 1 ml) . Como resultado de ello, la formulación puede ser bastante viscosa, a menudo, hasta 10.000 veces más espesa que el agua, es decir de 10.000 cS (centistokes) o más. También, con la llegada de las estrategias de liberación controlada, se han abierto nuevas áreas para el desarrollo y el suministro de las formulaciones. En el caso de las aplicaciones parenterales, la viscosidad de las formulaciones mejoradas ha sido un problema en lo que respecta a varias formulaciones de liberación controlada. Los líquidos cuyas viscosidades superan significativamente un cierto nivel dado de tamaño de aguja y temperatura son difíciles, sino inviables, de inyectar con una aguja y jeringa convencionales.
Las formulaciones viscosas que contienen polímeros, por ejemplo, se emplean para la liberación controlada de fármacos después de una inyección subcutánea (s.c.) , intradérmica (i.d.) o intramuscular (i.m.) . Estas formulaciones son notablemente difíciles de inyectar y, a menudo, dolorosas para el paciente. La dificultad en la inyección se relaciona con el arrastre viscoso de la formulación a medida que recorre toda la extensión de la aguja. En consecuencia, se emplean agujas de grueso calibre (lo cual produce niveles de dolor aún mayores) , aunque de todos modos el tiempo de aplicación de la inyección puede ubicarse en el orden de algunos minutos o más.
La capacidad de inyectar un fármaco incorporado en un polímero en una zona localizada y hacer que el polímero forme un “depot” [depósito] del fármaco semisólido presenta una serie de ventajas. Entre estas ventajas pueden mencionarse la facilidad de aplicación y el suministro localizado y prolongado del fármaco. Por estos motivos, se ha desarrollado un gran número de sistemas de suministro poliméricos in situ y se los ha investigado para utilizar en el suministro de una amplia variedad de fármacos.
En la actualidad, hay pocos materiales sintéticos o poliméricos naturales que se pueden usar para el suministro controlado de los fármacos, lo cual incluye los fármacos de péptidos y proteínas, debido a estrictos requisitos de cumplimiento regulatorio, tales como la biocompatibilidad, la vía de degradación claramente definida y la seguridad de los productos de degradación. Los polímeros biodegradable más investigados y avanzados en lo que respecta a los datos toxicológicos y clínicos son los poli (alfa-hidroxi-ácidos) alifáticos, tales como los ácidos poli (D, L-o L
lácticos) (PLA, poly-lactic acids) y el ácido poli (glicólico) (PGA, polyglycolic acid) y sus copolímeros (PLGA) . Estos polímeros se comercializan en plaza y actualmente se los usa como suturas biorreabsorbibles. Un sistema aprobado por la FDA (Food and Drug Administration, Administración de Alimentos y Fármacos) para la liberación controlada de acetato de leuprolida, el Lupron Depot.TM., también se basa en copolímeros de PLGA. El Lupron Depot.TM. consiste en microesferas inyectables, que liberan acetato de leuprolide durante un período extenso (por ejemplo,
durante de varios días) para el tratamiento del cáncer prostático. En la tabla 2, se brinda una lista de sistemas de liberación controlada de proteínas/péptidos en PLGA.
A. S. Sawhney y J. A. Hubbell, J. Biomed. Mat. Res., 24, 1197-1411 (1990) , sintetizaron terpolímeros de D, L-láctido, glicólido y c-caprolactona, que se degradan rápidamente in vitro. La hidrofilicidad del material aumentó en la copolmerización con un tensioactivo de poloxámero (Pluronic F-68) . Este poloxámero es un copolímero de bloques 45 que comprende un 80 % en peso aproximadamente de un bloque relativamente hidrofóbico de poli (oxipropileno) y un 20 % en peso de un bloque hidrofílico de poli (oxietileno) . La copolimerización con el poloxámero derivó en un material cristalino más fuerte y parcialmente cristalino, que fue mecánicamente estable a las temperaturas fisiológicas (por ejemplo, a 37 grados centígrados) en agua.
Un sistema, que se puede fabricar en solución acuosa es una clase de copolímeros de bloques a los que se ha 50 hecho referencia anteriormente y que se comercializan con la marca Pluronic.TM. Estos copolímeros están compuestos por dos bloques de polímeros diferentes, es decir, bloques hidrofílicos de poli (oxietileno) y bloques hidrofóbicos de (oxipropileno) , para formar un tribloque de poli (oxietileno) -poli (oxipropileno) -poli (oxietileno) . Los copolímeros de tribloques absorben agua para formar geles, que exhiben una conducta de gelificación térmica inversa.
Churchill y colaboradores, en los documentos de patente de los Estados Unidos con los números 4.526.938 y
4.745.160 muestran copolímeros que son autodispersables o bien, que pueden tornarse autodispersables en soluciones acuosas. Estos copolímeros son copolímeros de tribloques ABA o de bloques AB compuestos por
bloques hidrofóbicos A, tales como poliláctido (PLA) o poli (láctido-co-glicólido) (PLGA) , y bloques B hidrofílicos, tales como polietilenglicol (PEG) o polivinilpirrolidona.
Dunn y colaboradores, en el documento de patente con el número 5.324.519, describen la composición de una formulación líquida de un polímero termoplástico y un disolvente orgánico farmacéuticamente aceptable (marca Atrigel) . La composición se administra como un líquido a un sitio de implante, tras lo cual el disolvente se disemina o se disipa en los fluidos acuosos circundantes de los tejidos. El sólido microporoso termoplástico no es soluble en estos fluidos acuosos, de modo que se coagula o solidifica para formar un sólido microporoso o matriz gelatinosa. La composición es una formulación líquida de un copolímero o prepolímero termoendurecido o, preferiblemente un prepolímero biodegradable terminado en éster acrícilo, que es capaz de entrecruzarse in situ para formar un sólido polimérico o copolimérico o matriz gelatinosa.
En el documento de patente de los EE.UU. con el número 6.117.949, Rathi y colaboradores. describen un polímero de tribloques del tipo ABA o BAB, hidrosoluble, biodegradable, constituido por una cantidad principal de un polímero hidrofóbico, conformado por un copolímero poli (láctido-co-glicólido) o polímero poli (láctido) como los bloques A y una cantidad menor de un bloque B de un polímero de polietilenglicol hidrofílico, que posee propiedades de gelificación térmica inversa.
El documento de patente de los EE.UU. con el número 5.980.948 describe una composición que comprende un producto, el cual incluye un agente biológicamente activo, encapsulado en una matriz que comprende un copolímero de poliéter-éster, tales como un copolímero de tereftalato de polietilenglicol / tereftalato de polibutileno. El copolímero de poliéter-éster protege el agente biológicamente activo (que incluye proteínas, péptidos y pequeñas moléculas del fármaco) de la degradación o desnaturalización.
Otra posibilidad interesante para aplicar un sistema inyectable para el suministro de proteínas in situ es el uso de isobutirato de acetato de sacarosa (SAIB, sucrose acetate isobutyrate) . El isobutirato de acetato de sacarosa es un derivado de azúcar altamente lipofílico, que se usa actualmente como un agente estabilizante y emulsionante para las dietas humanas e la industria alimenticia. La denominada tecnología SABERTM fue patentada por Tipton y Richard (Southern Biosystems, Inc.) en 1995. La alta viscosidad del vehículo líquido de isobutirato de acetato de sacarosa se reduce mediante el agregado un disolvente hidrosoluble o miscible en agua, tales como etanol o sulfóxido de dimetilo. Después de la incorporación del fármaco, la composición se inyecta y forma un implante altamente viscoso in situ, que libera el fármaco en el tiempo. El documento de patente de los EE.UU. con el número 5.747.058 describe la formulación de alta viscosidad en mayor detalle.
El documento... [Seguir leyendo]
Reivindicaciones:
1. Un dispositivo para el suministro de un principio activo farmacéutico, que comprende: un inyector sin aguja y una formulación que tiene una viscosidad superior a 10 cS aproximadamentem a 20ºC;
en el cual el inyector sin aguja comprende:
un recipiente que contiene la formulación;
un accionador y una pieza impulsora que puede desplazarse una cierta trayectoria para lograr que aproximadamente 0, 5 ml de la formulación o más puedan suministrarse desde el recipiente, en 0, 5 segundos o menos; en el cual la formulación se suministra a través de una boquilla, que comprende un canal y una abertura de salida 10 configurada para lograr una relación del largo del canal al diámetro de la abertura de salida inferior a 10.
2. El dispositivo de acuerdo con la reivindicación 1, en el cual la formulación tiene una viscosidad de aproximadamente 10.000 cS o mayor.
3. El dispositivo de acuerdo con las reivindicaciones 1 o 2, en la cual la formulación, al inyectarse, forma un implante in situ en forma de un depot que erosiona la superficie.
4. El dispositivo de acuerdo con la reivindicación 3, en el cual el depot libera un compuesto activo a una velocidad constante en el transcurso del tiempo y comprende un polianhidruro y un poli-ortoéster.
5. El dispositivo de acuerdo con cualquiera de las reivindicaciones precedentes, que es un inyector sin aguja, el cual comprende, asimismo, lo siguiente:
una fuente de energía que provee la fuerza a la pieza del dispositivo, con la potencia suficiente como para que la 20 formulación sea expulsada desde la boquilla en alrededor de 0, 1 segundo o menos.
6. El dispositivo de acuerdo con cualquiera de las reivindicaciones precedentes, en el cual la formulación tiene una viscosidad de aproximadamente 100 cS o mayor.
7. El dispositivo de acuerdo con la reivindicación 6, en el cual la formulación tiene una viscosidad de aproximadamente 1000 cS o mayor.
Figura 1. La relación del largo del orificio al largo crítico de la boquilla es inferior a 10 para viscosidades menores que 10.000 cS.
Figura 2. Efecto de la viscosidad sobre el tiempo necesario para aplicar la inyección; comparación de la aplicación con y sin aguja. Ambos métodos administraron 0, 5 ml de un fluido no tixotrópico. Las inyecciones con aguja emplearon una aguja de 23G, con una fuerza manual máxima que podía aplicarse con un probador (aproximadamente 20 N/ 5 lbF) .
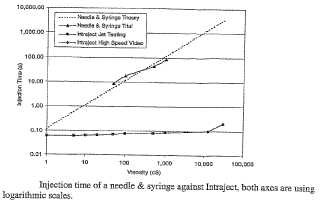
Figura 3. Duración de la aplicación de una inyección con aguja y jeringa, en comparación con Intraject; ambos ejes usan escalas logarítmicas.
Patentes similares o relacionadas:
Aparato para la inoculación transdérmica sin aguja de medicamentos, del 27 de Mayo de 2020, de Lorini, Dante: Aparato para inoculación transdérmica de medicamentos o similares, que se extiende en una dirección longitudinal axial (X-X) entre un extremo frontal para […]
 Mecanismo de inyección utilizando un vial, del 27 de Mayo de 2020, de BECTON, DICKINSON AND COMPANY: Un sistema de administración para dispensar un medicamento que comprende:
una carcasa ;
una primera cámara para […]
Mecanismo de inyección utilizando un vial, del 27 de Mayo de 2020, de BECTON, DICKINSON AND COMPANY: Un sistema de administración para dispensar un medicamento que comprende:
una carcasa ;
una primera cámara para […]
Inyector de seguridad con botón pulsador, del 6 de Mayo de 2020, de ANTARES PHARMA, INC.: Inyector de seguridad con botón pulsador, que comprende: una carcasa que tiene un extremo proximal, un extremo distal separado del extremo proximal, […]
Dispositivo de inyección sin aguja con membrana curvada, del 8 de Abril de 2020, de CROSSJECT: Dispositivo de inyección sin aguja que comprende: - un cuerpo que forma un alojamiento , - un generador de gas , - […]
Inyector sin aguja, del 1 de Abril de 2020, de Medical International Technologies (MIT Canada) Inc: Un inyector sin aguja que comprende: un tambor para recibir un líquido inyectable de una fuente del mismo; un soporte ; una boquilla […]
Moduladores de la actividad del complemento, del 4 de Marzo de 2020, de RA Pharmaceuticals, Inc: Composición farmacéutica que comprende un polipéptido inhibidor de C5 que tiene la secuencia núcleo SEQ ID NO: 1 y un excipiente farmacéuticamente aceptable, en […]
Mecanismo de carga para un inyector sin aguja, del 22 de Enero de 2020, de AcuShot, Inc: Un dispositivo de inyección sin aguja para administrar un medicamento a presión desde un depósito de dosificación a través de un orificio […]
Dispositivo inyector sin aguja con capacidad de carga automática, del 11 de Diciembre de 2019, de MASSACHUSETTS INSTITUTE OF TECHNOLOGY: Un dispositivo de transporte transdérmico sin aguja para transferir una sustancia a través de una superficie de un cuerpo biológico incluyendo: una cámara […]