Composición estabilizada que comprende al menos un compuesto adrenérgico.
Una composición farmacéutica líquida que comprende un compuesto adrenérgico,
en la que el compuestoadrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, y al menos un antioxidante seleccionadode entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito, en la que la proporciónmolar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito,está en el intervalo de 1,31-2,20 y en la que el pH de dicha composición líquida está en el intervalo deaproximadamente 2,0-5,0.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2010/057771.
Solicitante: Alk AG.
Nacionalidad solicitante: Suiza.
Dirección: Industriestrasse 30 8604 Volketswil SUIZA.
Inventor/es: BAILLIE,ALAN J, MACDONALD,KENNETH, PORTEOUS,PAMELA, HENDRY,SIMON.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/137 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Arilalquilaminas, p. ej. Anfetamina, epinefrina, salbutamol, efedrina.
- A61K47/02 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Compuestos inorgánicos.
- A61K9/00 A61K […] › Preparaciones medicinales caracterizadas por un aspecto particular.
PDF original: ES-2432241_T3.pdf
Fragmento de la descripción:
Composición estabilizada que comprende al menos un compuesto adrenérgico Campo de la invención La presente invención se refiere a una composición estabilizada que tiene una estabilidad del período de caducidad significativamente mejorada con una susceptibilidad sustancialmente reducida a la degradación oxidativa, térmica e inducida por la luz. Más particularmente, la presente invención se refiere a una composición estabilizada que comprende al menos un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, y al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito.
Antecedentes de la invención Las soluciones de compuestos adrenérgicos, en particular, de epinefrina y modificaciones de la misma, encuentran una amplia aplicación para fines medicinales. La epinefrina es una de las hormonas neuronales responsables de la regulación del corazón, la presión arterial, la resistencia de las vías respiratorias y el metabolismo energético. La epinefrina genera un efecto inotrópico, en el que aumenta el ritmo cardíaco y la fuerza de contracción del corazón, estrecha los vasos sanguíneos, aumentando así la presión arterial, reduce la resistencia de las vías respiratorias para que sea más fácil respirar, y eleva la glucosa y los ácidos grasos en sangre para suministrar la energía del cuerpo durante el estrés. Sus usos incluyen, al menos, combatir la baja presión arterial durante un choque hemorrágico, alérgico o anafiláctico; abrir las vías respiratorias durante un ataque de asma; restringir la distribución de fármacos administrados a nivel local tales como anestésicos locales; reducir la congestión nasal; y/o ayudar en situaciones de emergencia.
Los compuestos de catecol, tales como la epinefrina, son sensibles a la oxidación en o-quinonas, que pueden reaccionar después formando compuestos muy coloreados. Por tanto, la epinefrina puede reaccionar para formar adrenocromo, un derivado de indol muy coloreado. La velocidad de esta reacción aumenta con el pH, la temperatura y con la presencia de iones metálicos tales como el aluminio de diversos cauchos y el hierro de material de vidrio ámbar. Las soluciones de epinefrina también pueden perder potencia como resultado de la racemización, y la protección de la luz minimiza esta forma de inestabilidad.
La modificación o degradación de las aminas de catecol no es deseable por una serie de razones. La modificación de la amina de catecol genera la pérdida de título del principio activo, la formación de compuestos que pueden tener efectos fisiológicos no deseados y la aparición de un color oscuro, lo que convierte la solución en desagradable y no comercializable. La pérdida inicial de compuesto activo debido a la autoxidación durante la preparación y el envasado de dicha solución es considerable a pesar del hecho de que dichos procedimientos se llevan a cabo en la medida de lo posible a efectos prácticos en una atmósfera inerte, y dicha solución se debe almacenar en refrigeración para disminuir la velocidad de deterioro del compuesto y así prolongar su período de caducidad.
Es una práctica convencional, con el fin de estabilizar los compuestos adrenérgicos tales como las aminas de catecol contra la autoxidación, combinar los mismos con un antioxidante. Los diversos antioxidantes que se han usado para estabilizar la solución de amina de catecol en una variedad de formulaciones, tales como aerosoles, gotas oculares, inyecciones, etc., incluyen: metabisulfito, bisulfito, sulfito, ácido ascórbico, tiglicolato, tioglicerol, cisteína, galato de propilo y sulfoxilato de formaldehído.
Una formulación de epinefrina disponible en el mercado es la formulación Epipen!. La composición de la formulación Epipen!, diseñada para administrar un mínimo de 0, 3 g de epinefrina en un volumen de inyección de
0, 3 ml, es la siguiente:
Epinefrina 1, 1 mg
Cloruro sódico 6, 0 mg
Metabisulfito de sodio 1, 7 mg
Ácido clorhídrico c.s. pH 3, 4
Agua para inyección c.s. 1 ml
El documento GB 425.678 divulga un procedimiento para producir una solución anestésica para la anestesia local sustancialmente estable que contiene una sal de ácido de un anestésico, epinefrina o un equivalente fisiológico que normalmente requiere un ácido para mantenerse estable y un antioxidante, que comprende ajustar el valor de pH de la solución con un tampón, de modo que la solución tenga un valor de pH en un intervalo de aproximadamente 5, 7 a aproximadamente neutro. Se menciona el bisulfito de sodio como antioxidante.
Los documentos GB 930.452 y US 3.149.035 divulgan soluciones farmacéuticas estables de una amina de catecol que comprenden una solución acuosa de la amina de catecol junto con oxina, ácido bórico y bisulfito de sodio, teniendo dichas soluciones un pH de 6, 5-6, 8.
El documento US 3.966.905 divulga soluciones de amina de catecol estabilizadas que comprenden una amina de catecol, una polivinilpirrolidona, borato y un antioxidante fisiológicamente aceptable seleccionado de entre el grupo que consiste en ácido ascórbico, ácido eritórbico, acetilcisteína y tioglicerol, a un pH sustancialmente neutro o ligeramente básico.
El documento CA 981182 divulga la estabilización de l-epinefrina en una solución de anestésico local mediante el uso de una combinación de tres antioxidantes específicos, es decir, bisulfito, ácido ascórbico y tioglicerol, comprendiendo dicha solución un anestésico local seleccionado de entre mepivacaína, bupivacaína y lidocaína, lepinefrina, bisulfito, ácido ascórbico y tioglicerol, y en el que dicha solución es de un pH de aproximadamente 4.
El documento US 2008/0269347 A1 divulga formulaciones de epinefrina que comprenden epinefrina, EDTA y al menos un antioxidante, en las que el antioxidante se selecciona de entre el grupo que consiste en cisteína, ácido cítrico, tioglicerol, acetilcisteína y una combinación de los mismos.
El documento DD-A1-150 694 divulga una formulación que contiene bitartrato de epinefrina y metabisulfito de sodio.
El documento WO 94/13274 divulga formulaciones que contienen clorhidrato de dobutamina y metabisulfito de sodio.
El documento WO 97/16196 divulga una formulación que contiene epinefrina y metabisulfito de sodio.
El documento WO98/2086 divulga una formulación que contiene epinefrina y metabisulfito de sodio.
El documento JP 6 298640 A se dirige a una composición estable para inyección intravenosa que comprende clorhidrato de ritodrina i.a.
El documento US-A-4 734 438 divulga una formulación que contiene norepinefrina y bisulfito de sodio.
Sigue existiendo la necesidad de una composición estabilizada que tenga una mejor estabilidad del período de caducidad con una susceptibilidad sustancialmente reducida a la degradación oxidativa, térmica e inducida por la luz.
Objeto de la invención Es un objeto de las realizaciones de la invención proporcionar una composición farmacéutica que comprende epinefrina o una sal fisiológicamente aceptable de la misma que tiene una mejor estabilidad y, por consiguiente, un mayor período de caducidad.
Sumario de la invención El/los presente/s inventor/es ha/n descubierto que es posible obtener una mejor estabilidad, en particular, una estabilidad frente a la autoxidación y una estabilidad térmica, mediante el uso de al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito, en el que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante y el pH se encuentran en un intervalo especificado.
Así pues, en un primer aspecto, la presente invención se refiere a una composición farmacéutica líquida que comprende un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, y al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito, en la que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito, se encuentra en el intervalo de 1, 31-2, 20 y en la que el pH de dicha composición líquida está en el intervalo de aproximadamente 2, 0-5, 0.
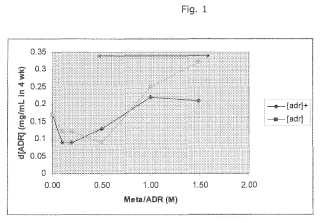
La invención se basa en el sorprendente hallazgo experimental de que la estabilidad de la adrenalina se mejora en el intervalo de proporción de adrenalina con respecto a sulfito de 1, 31-2, 20 en comparación con las proporciones usadas en los productos comerciales convencionales y otras formulaciones de la técnica anterior.
... [Seguir leyendo]
Reivindicaciones:
1. Una composición farmacéutica líquida que comprende un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, y al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito, en la que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito, está en el intervalo de 1, 31-2, 20 y en la que el pH de dicha composición líquida está en el intervalo de aproximadamente 2, 0-5, 0.
2. La composición farmacéutica de acuerdo con la reivindicación 1, en la que el antioxidante está seleccionado de entre el grupo que consiste en bisulfito de sodio y metabisulfito de sodio.
3. La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores, en la que el antioxidante es metabisulfito de sodio.
4. La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores, en la que la proporción molar del al menos un compuesto adrenérgico con respecto al al menos un antioxidante está en el intervalo de 1, 31 a 2, 00, preferentemente de 1, 31 a 1, 80, más preferentemente de 1, 31 a 1, 60, más preferentemente de 1, 31 a 1, 50, y lo más preferentemente de 1, 31 a 1, 40.
5. La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores que tiene un pH en el intervalo de 2, 5-4, 5, preferentemente 3, 0-4, 0, más preferentemente 3, 1-3, 7, y lo más preferentemente 3, 2 a 3, 6.
6. La composición farmacéutica de acuerdo con la reivindicación 5, en la que el pH está en el intervalo de 3, 3-3, 5, más preferentemente 3, 4.
7. La composición farmacéutica de acuerdo con cualquiera de las reivindicaciones anteriores que comprende además uno o más excipientes o aditivos.
8. Una composición farmacéutica líquida que comprende un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, y al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito, en la que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito, está en el intervalo de 1, 31-2, 20 y en la que el pH de dicha composición líquida está en el intervalo de 2, 0-5, 0, para su uso como un medicamento.
9. Un procedimiento para estabilizar una composición farmacéutica líquida que comprende un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, que comprende las etapas de i) proporcionar una solución de un compuesto adrenérgico; ii) añadir al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito; iii) ajustar el pH de la misma hasta un valor en el intervalo de 2, 0-5, 0 opcionalmente mediante la adición de un ácido
o una base, en la que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito, está en el intervalo 1, 31-2, 20.
10. Uso de al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito para la estabilización de una composición farmacéutica líquida que comprende un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, en la que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito, se encuentra en el intervalo de 1, 31-2, 20, y en la que el pH de dicha composición líquida está en el intervalo de aproximadamente 2, 0-5, 0.
11. Un kit que comprende:
i) una composición farmacéutica líquida que comprende un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, y al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito, en la que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito, está en el intervalo de 1, 31-2, 20, y en la que el pH de dicha composición líquida está en el intervalo de aproximadamente 2, 0-5, 0 y ii) un dispositivo de administración.
12. El kit de acuerdo con la reivindicación 11, en el que el dispositivo de administración es una ampolla o un autoinyector.
13. Una composición farmacéutica líquida para su uso en la mejora de al menos un síntoma de una afección médica que requiere un compuesto adrenérgico en un individuo en necesidad del mismo, que comprende un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, y al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto
de sulfito, en la que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito, está en el intervalo de 1, 31-2, 20 y en la que el pH de dicha composición líquida está en el intervalo de aproximadamente 2, 0-5, 0.
14. Una composición farmacéutica líquida para su uso en el tratamiento de la anafilaxia en un individuo en
necesidad de ello, que comprende un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, y al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito, en la que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito, está en el intervalo de 1, 31-2, 20 y en la que el pH de dicha composición líquida está en el intervalo de aproximadamente 2, 0-5, 0.
15. Uso de una composición farmacéutica líquida que comprende un compuesto adrenérgico, en la que el compuesto adrenérgico es epinefrina o una sal fisiológicamente aceptable de la misma, y al menos un antioxidante seleccionado de entre el grupo que consiste en un bisulfito, un metabisulfito y un compuesto de sulfito, en la que la proporción molar del compuesto adrenérgico con respecto al al menos un antioxidante, medida como equivalentes de sulfito, está en el intervalo de 1, 31-2, 20 y en la que el pH de dicha composición líquida está en el intervalo de aproximadamente 2, 0-5, 0, para la fabricación de un medicamento para tratar la anafilaxia en un individuo.
Patentes similares o relacionadas:
 Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Formulaciones de finasterida para la liberación de fármacos en el cabello y el cuero cabelludo, del 29 de Julio de 2020, de POLICHEM SA: Una composición que contiene:
(a) hidroxipropil-quitosano o una sal fisiológicamente aceptable de este en una cantidad de un 0,25 a un 2,0 % […]
Administración intravascular de composiciones de nanopartículas y usos de las mismas, del 29 de Julio de 2020, de ABRAXIS BIOSCIENCE, LLC: Una composición que comprende nanopartículas que comprenden rapamicina y albúmina para su uso en un procedimiento para inhibir la remodelación […]
 Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Inhibidor de galactósido de galectina-3 y su uso para tratar fibrosis pulmonar, del 29 de Julio de 2020, de Galecto Biotech AB: Un dispositivo adecuado para administración pulmonar en el que dicho dispositivo es un inhalador de polvo seco que comprende una composición que comprende un compuesto de […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Matrices de microagujas obtenidas mediante disolución y colada que contienen un principio activo, del 29 de Julio de 2020, de Corium, Inc: Un método para formar una matriz de microprotusiones, que comprende: (a) dispensar en un molde que tiene una matriz de cavidades correspondientes al negativo […]
Potenciador de la conservación, del 29 de Julio de 2020, de DSM IP ASSETS B.V.: Una composición tópica que comprende fitantriol y eritrulosa.
Reducción de tejido adiposo, del 22 de Julio de 2020, de Dobak, John, Daniel: Una formulacion farmaceutica inyectable que comprende: (i) polidocanol en una cantidad del 0,5 % p/v al 2,0 % p/v; e (ii) un alcohol C3-C6 en una cantidad del […]