VACUNAS COMBINADAS CONTRA NEISSERIA MENINGITIDIS.
Un kit que comprende: (a) sacárido capsular conjugado de grupo serológico A de N.
meningitidis, en forma liofilizada; y (b) sacárido(s) capsular(es) de uno o más grupos serológicos C, W135 e Y de N.meningitidis, en forma líquida
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06075175.
Solicitante: CHIRON SRL.
Nacionalidad solicitante: Italia.
Dirección: VIA FIORENTINA, 1,53100 SIENA.
Inventor/es: COSTANTINO, PAOLO.
Fecha de Publicación: .
Fecha Solicitud PCT: 20 de Junio de 2002.
Fecha Concesión Europea: 21 de Julio de 2010.
Clasificación Internacional de Patentes:
- A61K39/095 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Neisseria.
Clasificación PCT:
- A61K39/095 A61K 39/00 […] › Neisseria.
- A61K39/385 A61K 39/00 […] › Haptenos o antígenos, unidos a soportes.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- C12P19/04 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › Polisacáridos, es decir, compuestos que contienen más de cinco radicales sacárido unidos entre ellos por enlaces glucosídicos.
- C12R1/36 C12 […] › C12R SISTEMA DE INDEXACION ASOCIADO A LAS SUBCLASES C12C - C12Q, RELATIVO A LOS MICROORGANISMOS. › C12R 1/00 Microorganismos. › Neisseria.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Finlandia, Chipre.
Fragmento de la descripción:
Vacunas combinadas contra Neisseria meningitidis.
Campo técnico
La presente invención pertenece al campo de las vacunas, en particular frente a la infección y enfermedad por meningococos.
Técnica antecedente
Neisseria meningitidis es un patógeno humano Gram negativo. Coloniza la faringe, provocando meningitis y, ocasionalmente, septicemia en ausencia de meningitis. Está estrechamente relacionado con N. gonorrhoeae, aunque una característica que diferencia meningococos claramente es la presencia de una cápsula de polisacáridos que está presente en todos los meningococos patógenos.
Se han identificado doce grupos serológicos de N. meningitidis (A, B, C, H, I, K, L, 29E, W135, X y Z) de acuerdo con el polisacárido capsular del organismo. El grupo A es el patógeno implicado más frecuentemente en enfermedades epidémicas en el África sub-Sahariana. Los grupos serológicos B y C son responsables de la gran mayoría de casos en EE. UU. Y en la mayoría de países desarrollados. Los grupos serológicos W135 e Y son responsables de los casos restantes en EE.UU. y países desarrollados.
Los polisacáridos capsulares de N. meningitidis se preparan generalmente mediante un procedimiento que comprende las etapas de precipitación del polisacárido (p.ej. utilizando un detergente catiónico), fraccionamiento en etanol, extracción fría de fenol (para eliminar proteínas) y ultracentrifugación (para eliminar LPS) [p.ej. referencia 1].
Una vacuna tetravalente de los polisacáridos de los grupos serológicos A, C, Y, y W135 se conoce hace años [2, 3] y se ha autorizado para uso humano. Aunque efectiva en adolescentes y adultos, induce una respuesta inmune pobre y corta duración de la protección y no se puede utilizar en niños [p.ej. 4]. Ésto es por que los polisacáridos son antígenos independientes de la célula T que inducen una respuesta inmune débil que no se puede estimular. Los polisacáridos en esta vacuna no están conjugados y están presentes a una relación 1:1:1:1 [5] MENCEVAX ACWYTM contiene 50 µg de cada polisacárido purificado una vez reconstituido de su forma liofilizada.
Se han aprobado también los oligosacáridos del grupo serológico C conjugados para su utilización en humanos [p.ej. MenjugateTM; referencia 6]. Sin embargo, se mantiene la necesidad de realizar mejoras en las vacunas conjugadas contra los grupos serológicos A, W135 e Y, y en su manufactura.
Descripción de la invención
La invención proporciona un procedimiento para la purificación de un polisacárido capsular bacteriano, que comprende las etapas de (a) precipitación de dicho polisacárido, seguida de (b) disolución del polisacárido precipitado utilizando etanol. El polisacárido se puede utilizar para preparar vacunas, tales como vacunas conjugadas, en particular contra los grupos serológicos A, W135 e Y de N. meningitidis.
Precipitación y disolución por etanol
Se conocen en el campo muchas técnicas para la precipitación de polisacáridos solubles. Los procedimientos preferidos utilizan uno o más detergentes catiónicos. Los detergentes tienen preferiblemente la siguiente fórmula general:
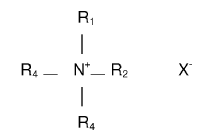
en la que:
R1, R2 y R3 son iguales o diferentes y cada uno significa alquilo o arilo; o R1 y R2 junto con el átomo de nitrógeno al que están unidos forman un anillo heterocíclico saturado de 5- ó 6- miembros, y R3 significa alquilo o arilo; o R1, R2 y R3 junto con el átomo de nitrógeno al que están unidos forman un anillo heterocíclico de 5- ó 6- miembros insaturado en el átomo de nitrógeno,
R4 significa alquilo o arilo, y
X- significa un anión.
Los detergentes preferidos particularmente para la utilización en el procedimiento son sales de tetrabutilamonio y cetiltrimetilamono (p. ej. las sales de bromuro). Se prefiere particularmente el bromuro de cetiltrimetilamonio ("CTAB") [8]. CTAB se conoce también como bromuro de hexadeciltrimetilamonio, bromuro de cetrimonio, Cetavlon y Centimida. Otros detergentes incluyen bromuro de hexadimetrina y sales de miristiltrimetrilamonio.
Los polisacáridos capsulares se liberan al medio durante el cultivo. Por consiguiente, el material de partida para la precipitación será generalmente el sobrenadante de un cultivo bacteriano centrifugado o será un cultivo concentrado.
La etapa de precipitación puede ser selectiva para polisacáridos, pero se coprecipitarán generalmente otros componentes (p. ej. proteínas, ácidos nucleicos, etc.).
El polisacárido precipitado se puede recoger por centrifugación antes de su disolución.
Tras su precipitación, el polisacárido (típicamente en la forma de un complejo con el detergente catiónico) se disuelve. Se prefiere la utilización de un disolvente que sea relativamente selectivo para los polisacáridos con el fin de minimizar los contaminantes (p. ej. proteínas, ácidos nucleicos, etc.). Se ha encontrado que el etanol es ventajoso a este respecto, y es altamente selectivo para el complejo CTAB-polisacárido. Se pueden utilizar otros alcoholes inferiores (p. ej. metanol, propan-1-ol, propan-2-ol, butan-1-ol, butan-2-ol, 2-metil-propan-1-ol, 2-metil-propan-2-ol, dioles, etc.).
Preferiblemente se añade etanol al polisacárido precipitado para obtener una concentración final de etanol (en base al contenido total de etanol y agua) de entre el 50% y 95% (p. ej. alrededor del 55%, 60%, 65%, 70%, 75%, 80%, 85%, o alrededor del 90%), y preferiblemente entre 75% y 95%. La concentración final óptima de etanol puede depender del grupo serológico de la bacteria de la que se obtiene el polisacárido.
El etanol se puede añadir al polisacárido precipitado en forma pura o se puede añadir en una forma diluida con un disolvente miscible (p. ej. agua). Las mezclas de disolventes preferidas son mezclas de etanol: agua, en una relación preferida de entre alrededor de 70:30 y alrededor de 95:5 (p. ej. 75:25, 80:20, 85:15, 90:10).
Comparado con el procedimiento convencional para preparar polisacáridos capsulares, el procedimiento de precipitación en dos etapas seguido por extracción con etanol es más rápido y más simple.
Contrastando con el procedimiento descrito en la referencia 9, el procedimiento utiliza detergentes catiónicos en lugar de detergentes aniónicos. A diferencia del procedimiento de la referencia 10, el polisacárido se redisuelve utilizando etanol, en lugar de por intercambio de cationes utilizando sales de calcio o magnesio. A diferencia del procedimiento de la ref. 11, la precipitación no requiere un soporte inerte poroso. Además, a diferencia de los procedimientos anteriores del campo, se utiliza alcohol para redisolver el polisacárido en lugar de precipitarlo.
El polisacárido capsular bacteriano será generalmente de Neisseria. Preferiblemente de N. meningitidis, que incluye los grupos serológicos A, B, C, W135 e Y. Los grupos serológicos preferidos son A, W135 e Y.
El procedimiento es válido también para preparar polisacáridos capsulares de Haemophilus influenzae (particularmente tipo B, o "Hib") o Streptococcus pneumoniae (neumococo).
Procesamiento adicional del polisacárido disuelto
El polisacárido se puede tratar adicionalmente para eliminar contaminantes tras su disolución. Esto es particularmente importante en situaciones en las que incluso una contaminación menor no es aceptable (p. ej. para la producción de vacunas humanas). Esto requerirá generalmente uno o más etapas de filtración.
Se puede utilizar filtración de profundidad. Ésta es particularmente útil para la clarificación.
Se puede utilizar filtración a través de carbón activado. Ésta es útil para eliminar pigmentos y trazas de compuestos orgánicos. Se puede repetir hasta, por ejemplo, DO275nm< 0,2.
Se puede utilizar filtración por tamaño o utrafiltración.
Una vez filtrado para eliminar contaminantes, el polisacárido se puede precipitar para su tratamiento adicional y/o procesamiento. Esto se puede llevar a cabo convenientemente por intercambio de cationes (p. ej. por la adición de calcio o sales de sodio).
El polisacárido se puede modificar químicamente. Por ejemplo, se...
Reivindicaciones:
1. Un kit que comprende: (a) sacárido capsular conjugado de grupo serológico A de N.meningitidis, en forma liofilizada; y (b) sacárido(s) capsular(es) de uno o más grupos serológicos C, W135 e Y de N.meningitidis, en forma líquida.
2. El kit de la reivindicación 1, en el que uno o más de los sacáridos de (b) está conjugado a una proteína vehículo.
3. El kit de la reivindicación 2, en el que la proteína vehículo es el toxoide de difteria CRM197.
4. El kit de cualquier reivindicación precedente, en el que el sacárido capsular del grupo serológico A de N.meningi- tidis está conjugado a una toxina o toxoide bacteriano.
5. El kit de la reivindicación 4, en el que la toxina o toxoide bacteriano es toxoide de difteria, toxoide de tétanos o el toxoide de difteria CRM197.
6. El kit de cualquier reivindicación precedente, en el que la conjugación es mediante un procedimiento que implica la introducción de grupos amino en el sacárido seguido de la derivatización con un diéster adípico y reacción con la proteína vehículo.
7. El kit de cualquier reivindicación precedente, en el que el sacárido capsular conjugado del grupo serológico A de N.meningitidis tiene una relación sacárido:proteína (p/p) de entre 0,5:1 y 5:1.
8. El kit de cualquier reivindicación precedente, en el que uno o más de los sacáridos está adsorbido a un adyuvante de hidróxido de aluminio.
9. El kit de cualquier reivindicación precedente, en el que el componente (b) comprende un adyuvante de sal de aluminio.
10. El kit de la reivindicación 9, en el que el componente (b) comprende un adyuvante de fosfato de aluminio.
11. El kit de cualquier reivindicación precedente, en el que uno o más de los sacáridos es un oligosacárido.
12. El kit de cualquier reivindicación precedente, en el que el sacárido del grupo serológico A tiene un grado medio de polimerización de entre 10 y 20.
13. El kit de cualquier reivindicación precedente, en el que el componente (b) comprende un sacárido del grupo serológico W135.
14. El kit de la reivindicación 13, en el que el sacárido del grupo serológico W135 sacárido tiene un grado medio de polimerización de entre 15 y 25.
15. El kit de cualquier reivindicación precedente, en el que el componente (b) comprende un sacárido del grupo serológico Y.
16. El kit de la reivindicación 15, en el que el sacárido del grupo serológico Y tiene un grado medio de polimerización de entre 15 y 25.
17. El kit de cualquier reivindicación precedente, en el que el componente (b) comprende un sacárido del grupo serológico C.
18. El kit de la reivindicación 17, en el que el sacárido del grupo serológico C tiene entre 12 y 22 unidades de repetición.
19. El kit de la reivindicación 17 o reivindicación 18, en el que la relación (p/p) de sacárido del grupo serológico A al sacárido del grupo serológico C es mayor que 1.
20. El kit de la reivindicación 19, en el que la relación (p/p) de sacárido del grupo serológico A al grupo serológico C sacárido es 2:1.
21. El kit de cualquier reivindicación precedente, en el que los sacáridos de (b) están entre los grupos serológicos C, W135 e Y de N.meningitidis.
22. El kit de la reivindicación 21, en el que la relación (p/p) para los sacáridos de los grupos serológicos A:C: W135:Y es 2:1: 1:1.
23. El kit de cualquier reivindicación precedente, en la forma de dos viales.
24. El kit de cualquier reivindicación precedente, que comprende además un antígeno de sacárido de Haemophilus influenzae B.
25. El kit de cualquier reivindicación precedente, en el que la dosis está entre 5 y 20 µg por sacárido por dosis.
26. Un procedimiento para preparar una vacuna que comprende sacáridos capsulares conjugados de al menos dos de los grupos serológicos A, C, W135 e Y de N.meningitidis, que comprende una etapa de mezclar (i) un conjugado liofilizado de sacárido capsular del grupo serológico A de N.meningitidis con (ii) conjugado(s) en forma líquida de capsular sacárido(s) capsular(es) de uno o más de los grupos serológicos C, W 135 e Y de N.meningitidis.
27. El procedimiento de la reivindicación 26, en el que los sacáridos de (ii) están entre los grupos serológicos C, W135 e Y de N.meningitidis.
28. El procedimiento de la reivindicación 27, en el que la relación (p/p) para los sacáridos de los grupos serológicos A:C:W135:Y es 2:1:1:1.
29. El procedimiento de una cualquiera de las reivindicaciones 26 a 28, en el que los sacáridos están conjugados al toxoide de difteria CRM197.
30. El procedimiento de una cualquiera de las reivindicaciones 26 a 29, en el que la conjugación es mediante un procedimiento que implica la introducción de grupos amino en el sacárido seguido de la derivatización con un diéster adípico y reacción con la proteína vehículo.
31. El procedimiento de una cualquiera de las reivindicaciones 26 a 30, en el que uno o más de los sacáridos es 7 son un oligosacárido.
32. El procedimiento de una cualquiera de las reivindicaciones 26 a 31, en el que uno o más de los sacáridos está adsorbido a un adyuvante de hidróxido de aluminio.
33. El procedimiento de una cualquiera de las reivindicaciones 26 a 32, en el que la vacuna comprende un adyuvante de fosfato de aluminio.
34. El procedimiento de una cualquiera de las reivindicaciones 26 a 32, en el que la vacuna comprende un antígeno de sacárido de Haemophilus influenzae B, proteínas del grupo serológico B de N.meningitidis o preparaciones OMV.
35. El procedimiento de una cualquiera de las reivindicaciones 26 a 34, en el que la dosis está entre 5 y 20 µg por sacárido por dosis.
Patentes similares o relacionadas:
Procedimientos y composiciones de glucoconjugación, del 13 de Mayo de 2020, de PFIZER INC.: Un glucoconjugado unido a (2-((2-oxoetil)tio)etil)carbamato (eTEC) de acuerdo con la fórmula (I): **(Ver fórmula)** en la que los átomos que comprenden el espaciador […]
Bacterias mutantes para la producción de módulos generalizados para antígenos de membrana, del 13 de Mayo de 2020, de GLAXOSMITHKLINE BIOLOGICALS SA: Un procedimiento para preparar vesículas a partir de una bacteria gramnegativa en el que al menos una proteína que contiene un dominio catalítico LytM se inactiva […]
Proteína de enlace del factor H meningocócico utilizada como adyuvante, del 6 de Mayo de 2020, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una composición inmunogénica que comprende dos antígenos meningocócicos fHBP diferentes, ambos adsorbidos al adyuvante de hidroxifosfato de aluminio, en donde (i) […]
Nuevas composiciones inmunogénicas para la prevención y tratamiento de enfermedad meningocócica, del 11 de Marzo de 2020, de WYETH HOLDINGS LLC: Una composición que comprende al menos una proteína que comprende una secuencia de aminoácidos que tiene identidad de secuencia mayor de 80 % con la […]
Vacunas de polipéptidos para protección amplia contra linajes meningocócicos hipervirulentos, del 18 de Diciembre de 2019, de GLAXOSMITHKLINE BIOLOGICALS SA: NadA de N.meningitidis recombinante en forma trimérica, en donde la NadA consiste de la secuencia de aminoácidos de la SEQ ID NO: 2.
Meningococo que sobreexpresa NadA y/o NHBA y vesículas de la membrana externa derivadas del mismo, del 23 de Octubre de 2019, de GLAXOSMITHKLINE BIOLOGICALS SA: Un meningococo que expresa NadA y opcionalmente NHBA, en el que el meningococo es isogénico con una cepa parental, excepto por una modificación genética […]
Composiciones y métodos para mejorar la inmunogenicidad de los conjugados de polisacárido-proteína, del 23 de Octubre de 2019, de Kanvax Biopharmaceuticals Ltd: Un conjugado de polisacárido-proteína que comprende una proteína transportadora quimérica y un antígeno polisacárido, en donde la proteína […]
Polipéptidos de fHbp meningocócicos modificados, del 16 de Agosto de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Un polipéptido que comprende una secuencia de aminoácidos que tiene al menos un 80 % de identidad de secuencia con la SEQ ID NO: 5, en el […]