CUANTIFICACION DE NIVELES DE CARTININA EN PACIENTES DE DIALISIS.
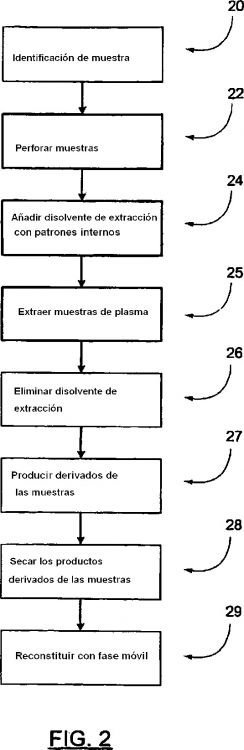
Un procedimiento para cuantificar los niveles de concentración de carnitina libre,
acilcarnitinas totales y carnitina total en muestras de plasma de pacientes de diálisis, usando espectrometría de masas en cascada, comprendiendo dicho procedimiento:
obtener una pluralidad de muestras de curva de calibración que contienen plasma dializado que tiene mezcladas en el mismo concentraciones conocidas de carnitina libre;
preparar una pluralidad de muestras de paciente que contienen plasma recogido de un paciente y dichas muestras de curva de calibración para análisis, lo que comprende extraer las muestras de paciente y las muestras de curva de calibración con una disolución de alcohol que contiene patrones internos marcados;
analizar dichas muestras de paciente para cuantificar concentraciones de carnitina libre y acilcarnitinas con relación a las de los patrones internos para producir datos de paciente, y analizar dichas muestras de curva de calibración para cuantificar concentraciones de carnitina libre y acilcarnitinas con relación a las de los patrones internos para producir datos de curva de calibración;
comparar dichos datos de paciente con dichos datos de curva de calibración para obtener datos de concentración de carnitina, incluyendo dichos datos de concentración de carnitina concentración de carnitina libre, concentración de acetilcarnitina y concentración de acilcarnitinas totales para cada muestra de paciente; y
corregir dicha concentración de carnitina libre y dicha concentración de acetilcarnitina para obtener la concentración de carnitina libre cuantificada, concentración de acilcarnitina total cuantificada, y concentración de carnitina total cuantificada para cada muestra de paciente, en las que al corregir la concentración de carnitina libre se tiene en cuenta la hidrólisis de acilcarnitinas en carnitina libre y al corregir la concentración de acetilcarnitina se tiene en cuenta la interferencia de ácido glutámico, y en las que la concentración de carnitina total cuantificada se determina sumando dicha concentración de acilcarnitinas totales cuantificadas y dicha concentración de carnitina libre cuantificada
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/029821.
Solicitante: SIGMA-TAU PHARMACEUTICALS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 9841 WASHINGTONIAN BLVD. SUITE 500,GAITHERSBURG MD 20878.
Inventor/es: CHACE,DONALD,H, FORNASINI,GIANFRANCO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/68A12
- G01N33/92 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen lípidos, p. ej. colesterol.
Clasificación PCT:
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Clasificación antigua:
- A61B1/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61B DIAGNOSTICO; CIRUGIA; IDENTIFICACION (análisis de material biológico G01N, p.ej. G01N 33/48). › Instrumentos para proceder al examen médico de las cavidades o conductos del cuerpo por inspección visual o fotográfica, p. ej. endoscopios (examen de las cavidades o conductos del cuerpo utilizando ondas ultrasónicas, sónicas o infrasónicas A61B 8/12; instrumentos endoscópicos para la toma de muestras celulares o para biopsias A61B 10/04; con fines quirúrgicos A61B 17/00; instrumentos quirúrgicos endoscópicos A61B 17/94; instrumentos quirúrgicos que utilizan un haz láser dirigido a lo largo o a través de un conducto flexible A61B 18/22 ); Dispositivos de iluminación al efecto (para los ojos A61B 3/00).
Fragmento de la descripción:
Cuantificación de niveles de carnitina en pacientes de diálisis.
Campo de la invención
La presente invención se refiere a procedimientos para cuantificar el nivel de deficiencia de carnitina en pacientes de modo que se puede seguir fácilmente y con precisión la evolución de las concentraciones de carnitina a lo largo del tiempo en un paciente dado. En particular, la presente invención trata de procedimientos para cuantificar las concentraciones de carnitina y el nivel de deficiencia de carnitina en pacientes que se someten a tratamientos de diálisis.
Antecedentes de la invención
La carnitina es una sustancia que se encuentra naturalmente en el cuerpo humano, que se requiere en el metabolismo de la energía a nivel celular. Se ha puesto de manifiesto que tiene un papel en el transporte de ácidos grasos a mitocondrias para ayudar a producir energía y en la eliminación de residuos tóxicos de las células. Hay estudios que indican que más del 70% de la carnitina presente en el plasma de un paciente de hemodiálisis se elimina durante una sola sesión de diálisis. Se piensa que este alto porcentaje de pérdida de carnitina por un paciente durante la sesión de hemodiálisis es atribuible al relativamente bajo peso molecular, alta solubilidad en agua, e insuficiente unión a proteína del compuesto. Se cree que los niveles de carnitina disminuyen aun más en pacientes de enfermedad renal en etapa final ("ESRD") por la reducida síntesis renal y la reducida ingesta de carne y alimentos lácteos. Así pues, los niveles de carnitina de pacientes de diálisis, y en particular de pacientes de enfermedad renal en etapa final que se someten a diálisis, generalmente disminuyen regularmente a lo largo del tiempo.
El agotamiento de los niveles de carnitina en tejido es una destacada consecuencia a largo plazo de repetidas pérdidas de carnitina del plasma. Así pues, el agotamiento de carnitina en tejido es experimentado por pacientes que se someten a sucesivas sesiones de diálisis a lo largo de un período de tiempo prolongado. El agotamiento de carnitina del tejido es indeseable porque se asocia como posible factor causante de muchas complicaciones sanitarias asociadas con la diálisis, que incluyen cardiomiopatía, arritmias, debilidad muscular, y fatiga general.
Según se describe en las patentes de EE.UU. 6.335.369 y 6.429.230 de Cavazza (en adelante "las patentes de Cavazza"), se puede usar la administración de levocarnitina (o L-carnitina) de modo beneficioso para tratar la deficiencia de carnitina en pacientes de ESRD (también conocidos como "pacientes urémicos crónicos") que se someten a diálisis regular. Según las patentes de Cavazza, se puede administrar levocarnitina o una de sus sales a pacientes de ESRD que se someten a diálisis periódica para prevenir o tratar la deficiencia de carnitina. Se enseña que esto de puede lograr, entre otros, administrando una dosis eficaz de L-carnitina intravenosamente por la vía de un tubo de retorno venoso después de cada sesión de diálisis del paciente de ESRD. Las patentes de Cavazza enseñan que la iniciación de terapia de inyección de L-carnitina de este tipo para tratar de la deficiencia de carnitina puede ser provocada por pacientes que demuestran concentraciones de carnitina en plasma pre-diálisis que están por debajo de lo normal (niveles normales de concentración de carnitina son 40-50 µmol/l). Se enseña que la administración intravenosa de este tipo de L-carnitina a pacientes de ESRD que se someten a tratamientos de diálisis da como resultado aumento de concentraciones de carnitina en plasma. Adicionalmente, se puede prevenir la deficiencia de carnitina en pacientes de ESRD que se están sometiendo a diálisis mediante la administración intravenosa de levocarnitina provocada por niveles de concentración de carnitina en plasma que tienden hacia la deficiencia de carnitina. Los procedimientos para la prevención mediante tratamiento de deficiencia de carnitina según se enseñan en las patentes de Cavazza hacen posible corregir la pérdida de carnitina en plasma que podría tener lugar en caso contrario durante una sesión de diálisis.
A fin de gestionar el suministro terapéutico de L-carnitina a pacientes de diálisis, sería beneficioso para los médicos tener un procedimiento preciso y fiable, así como rápido y de bajo coste, para vigilar el nivel de carnitina en plasma en pacientes antes de una sesión de diálisis dada, después de una sesión de diálisis dada, y/o durante una sesión de diálisis dada. Las técnicas actuales disponibles para medir niveles de carnitina en el plasma de un paciente incluyen ensayos enzimáticos, cromatografía líquida de alta presión ("HPLC"), y espectrometría de masas en cascada ("MS/MS"). Sin embargo, estas técnicas para cuantificar niveles de carnitina en plasma generalmente no proporcionan el análisis de alta producción, bajo coste, y alta sensibilidad y precisión necesario para implementación en gran escala para gestionar terapias de reemplazo de levocarnitina para pacientes que se someten a diálisis.
Todas las técnicas contemporáneas para medir niveles de carnitina en pacientes sufren distintos inconvenientes. Los ensayos enzimáticos son muy sensibles, pero son extremadamente consumidores de tiempo para realizarlos y, por lo tanto, no son fácilmente adaptables para uso a gran escala por las clínicas de diálisis. Además, los ensayos enzimáticos sólo pueden proporcionar cuantificación de niveles de carnitina libre (L-carnitina) y carnitina total en una muestra de plasma y no proporcionan resultados sobre acilcarnitinas individuales tales como carnitinas de cadena larga, que son marcadores útiles del estado metabólico de los pacientes de ESRD que se someten a diálisis para seleccionar terapias adecuadas. Además, la determinación de niveles de carnitina total usando ensayos enzimáticos se tiene que llevar a cabo separadamente de la determinación de niveles de carnitina libre debido al uso necesario de hidrólisis química antes de la cuantificación.
Se ha demostrado que los procedimientos de HPLC que implican producción de derivados específicos pre-columna y detección por fluorescencia son suficientemente sensibles para permitir la determinación de niveles para varias acilcarnitinas individuales. Sin embargo, los procedimientos de HPLC siguen siendo costosos y muy consumidores de tiempo, en gran parte porque la preparación de muestra requiere procedimientos elaborados, multi-etapa. Además, la determinación de niveles de acilcarnitina de cadena larga y de cadena muy larga no se puede llevar a cabo mediante HPLC. Adicionalmente HPLC sufre por el hecho de que la cuantificación de los niveles de carnitina total requiere una marcha analítica separada que incluye hidrólisis química de la muestra.
Principalmente, los procedimientos tanto de HPLC como de ensayos enzimáticos que se pueden usar para determinación precisa y fiable de niveles de carnitina requieren muestras biológicas que se hayan mantenido congeladas durante el almacenamiento y expedición después de la recogida. Como es comprensible, este factor hace difícil la utilización de estos procedimientos en un laboratorio remoto.
Con respecto a la cuantificación mediante MS/MS de niveles de carnitina, se ha usado MS/MS con ionización por electropulverización para identificar perfiles anormales de carnitina en niños a partir de muestras de sangre. En particular, la patente de EE.UU. Nº. 6.268.605 (correspondiente a WO 02/04945) de Chace ("la patente 605") describe un procedimiento para investigación genética de niños usando espectrometría de masas en cascada ("MS/MS"). Según la patente 605, se toma sangre de un paciente infantil, y se colocan manchas en pequeñas cantidades sobre un trozo de papel de filtro que se seca y se envía a un laboratorio. A continuación se reconstituye la sangre en el laboratorio y se hace pasar a través de un espectrómetro de masas de ionización por electropulverización con un patrón interno para identificar perfiles metabólicos potencialmente anormales de aminoácidos y acilcarnitinas. Al recoger muestras secas de sangre sobre papel de filtro, el procedimiento que enseña la patente 605 permite la transferencia económica, sin refrigerar de muestras de sangre desde el médico hasta un laboratorio remoto para su análisis. Esto permite a su vez que se use un único espectrómetro de masas situado remotamente para manejar un gran volumen de muestras, aprovechando con ello la economía de escala.
Aunque la MS/MS de ionización por electropulverización de muestras secas de sangre según se enseña en la patente 605 es un mecanismo fiable, de bajo coste y de alta producción...
Reivindicaciones:
1. Un procedimiento para cuantificar los niveles de concentración de carnitina libre, acilcarnitinas totales y carnitina total en muestras de plasma de pacientes de diálisis, usando espectrometría de masas en cascada, comprendiendo dicho procedimiento:
2. El procedimiento de la reivindicación 1, en el que dichas muestras de paciente se preparan colocando manchas de dicho plasma recogido de dicho paciente sobre papel de filtro y secando las muestras para obtener muestras de plasma secadas sobre papel de filtro.
3. El procedimiento de la reivindicación 2, en el que dicho papel de filtro se segmenta de modo que una sola hoja puede contener una pluralidad de muestras secas de un paciente dado.
4. El procedimiento de la reivindicación 3, en el que dicha pluralidad de muestras secas de un paciente dado se seleccionan entre el grupo que está constituido por muestras de plasma de sesión de pre-diálisis, muestras de plasma de sesión de post-diálisis, muestras de plasma de sesión de media-diálisis, y combinaciones de las mismas.
5. El procedimiento de una cualquiera de las reivindicaciones 2 a 4, en el que dichas muestras de plasma secadas sobre papel de filtro se obtienen por la vía de correo para cuantificación.
6. El procedimiento de una cualquiera de las reivindicaciones 2 a 5, en el que dicho papel de filtro que contiene gotas secas de muestras de paciente se puede almacenar y transportar a temperatura ambiente durante aproximadamente una semana después de ser recogido de dicho paciente antes de ser analizado.
7. El procedimiento de una cualquiera de las reivindicaciones 1 a 6, en el que dicho paciente es un paciente de enfermedad renal en etapa final que se somete a sesiones de diálisis periódicas, y dichas muestras de paciente comprenden plasma recogido de dicho paciente antes de una sesión de diálisis.
8. El procedimiento de una cualquiera de las reivindicaciones 1 a 7, que comprende además obtener una pluralidad de muestras de control de calidad, y preparar y analizar dichas muestras de control de calidad para producir datos de control de calidad.
9. El procedimiento de la reivindicación 8, en el que dichos datos de control de calidad se utilizan para hacer un ajuste afinado de los parámetros de equipo para dicha espectrometría de masas en cascada.
10. El procedimiento de la reivindicación 8 o la 9, en el que dichas muestras de control de calidad contienen plasma dializado.
11. El procedimiento de la reivindicación 10, en el que dicho plasma dializado tiene mezcladas en el mismo concentraciones conocidas de carnitina libre y acetilcarnitina.
12. El procedimiento de la reivindicación 8, en el que dichas muestras de control de calidad comprenden especímenes de plasma dializado seco que tienen en los mismos concentraciones conocidas de carnitina libre y acetilcarnitina.
13. El procedimiento de una cualquiera de las reivindicaciones 10 a 12, en el que dichas muestras de control de calidad comprenden gotas de dicho plasma secadas sobre papel de filtro.
14. El procedimiento de una cualquiera de las reivindicaciones 1 a 13, en el que dichas muestras de curva de calibración comprenden especímenes de plasma dializado seco que tienen en los mismos concentraciones conocidas de carnitina libre.
15. El procedimiento de una cualquiera de las reivindicaciones 1 a 13, en el que dichas muestras de curva de calibración comprenden gotas de dicho plasma secadas sobre papel de filtro.
16. El procedimiento de una cualquiera de las reivindicaciones 1 a 15, en el que dichos patrones internos marcados contenidos en la disolución de alcohol que se usa para extraer las muestras de paciente se seleccionan entre el grupo constituido por [D9]carnitina, [D3]acetilcarnitina, [D3]propionilcarnitina, [D3]butirilcarnitina, [D9]isovalerilcarnitina, [D3]octanoilcarnitina, [D9]miristoilcarnitina y [D3]palmitoilcarnitina.
17. El procedimiento de una cualquiera de las reivindicaciones 1 a 16, en el que dichas muestras de plasma comprenden manchas secas de plasma sobre papel de filtro, dicha preparación de dicha pluralidad de muestras de plasma comprende perforar un disco de dicha mancha seca de plasma para cada muestra de plasma, y dichas concentraciones cuantificadas tienen en cuenta un volumen estimado de dichas muestras de plasma que se recupera de dichos discos de perforación.
18. El procedimiento de una cualquiera de las reivindicaciones 1 a 17, en el que dicha preparación de dicha pluralidad de muestras comprende producir derivados con un alcohol acidificado de muestras de plasma recuperadas.
19. El procedimiento de una cualquiera de las reivindicaciones 1 a 18, en el que dicha concentración de acilcarnitina total cuantificada se determina sumando una pluralidad de ésteres butílicos de acilcarnitina.
20. El procedimiento de una cualquiera de las reivindicaciones 1 a 19, que comprende además seguir la evolución de cualquier cambio en dichas concentraciones cuantificadas para un paciente dado a lo largo del tiempo cuantificando los niveles de carnitina libre, acilcarnitinas y carnitina total en muestras de paciente de un paciente dado, en el que dichas muestras se originan a partir de diversas sesiones de diálisis para dicho paciente dado.
21. El procedimiento de una cualquiera de las reivindicaciones 1 a 20, en el que dichas muestras de paciente se preparan colocando manchas sobre papel de filtro y secando muestras de plasma de paciente tomadas en cada sesión de diálisis del paciente.
22. El procedimiento de una cualquiera de las reivindicaciones 1 a 21, en el que corregir dicha concentración de acetilcarnitina comprende medir una concentración de glutamato, y restar dicha concentración de glutamato medida de la concentración de acetilcarnitina.
23. El procedimiento de una cualquiera de las reivindicaciones 1 a 22, en el que corregir dicha concentración de carnitina libre comprende determinar un porcentaje de hidrólisis de acilcarnitinas, determinar una cantidad de acilcarnitinas hidrolizadas a partir de dicho porcentaje, y restar dicha cantidad de acilcarnitinas hidrolizadas de dicha concentración de carnitina libre.
24. El procedimiento de una cualquiera de las reivindicaciones 1 a 23, en el que analizar dichas muestras de curva de calibración para cuantificar concentraciones de carnitina libre y acilcarnitinas incluye producir una curva de calibración para interpolar las concentraciones de analitos de carnitina.
25. El procedimiento de una cualquiera de las reivindicaciones 1 a 24, en el que dichas muestras de curva de calibración comprenden especímenes de plasma dializado seco que tienen en los mismos concentraciones conocidas de carnitina libre.
26. Uso de un procedimiento según se define en una cualquiera de las reivindicaciones 1 a 25 para ayudar a diagnosticar deficiencia de carnitina en un paciente que se somete a sesiones regulares de diálisis.
Patentes similares o relacionadas:
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
TEST DIAGNÓSTICO BIOQUÍMICO PARA TRASTORNO POR DÉFICIT ATENCIONAL E HIPERACTIVIDAD (TDAH)., del 9 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención apunta a una Prueba diagnóstica bioquímica realizada en sangre periférica, que permite el diagnóstico de Trastorno por Déficit […]
ANTICUERPO SÉRICO IGM-PC COMO BIOMARCADOR DE LA ESCLEROSIS MÚLTIPLE, Y NUEVA ELISA ULTRASENSIBLE PARA EL DIAGNÓSTICO DE ESTA ENFERMEDAD, del 2 de Julio de 2020, de FUNDACION UNIVERSITARIA SAN PABLO CEU: Anticuerpo sérico IgM frente a fosfatidilcolina (IgM-PC) para ser utilizado como biomarcador de la esclerosis múltiple (EM) y de las diferentes fases de esta enfermedad, […]
Determinación de lipocalina asociada a gelatinasa de neutrófilos (NGAL) como marcador diagnóstico para trastornos renales, del 17 de Junio de 2020, de ANTIBODYSHOP A/S: Un método de distinción entre una afección que no afecta al riñón, en donde la afección que no afecta al riñón es un trastorno inflamatorio, un […]
Uso de ácidos grasos en procedimientos para detectar cáncer, del 27 de Mayo de 2020, de UNIVERSITY OF LOUISVILLE RESEARCH FOUNDATION, INC.: Un procedimiento para determinar la presencia o ausencia de al menos un tipo de cáncer en un animal, que comprende - determinar las cantidades de lípidos de los lípidos en […]
Solución de sustrato para medir la actividad de lipasa y método y reactivo para medir la actividad lipasa en una muestra, del 11 de Marzo de 2020, de Shino-Test Corporation: Uso de una composicion que comprende un aceite de silicona modificado de tipo modificado con polieter no reactivo de tipo cadena lateral junto con ester de (6'-metilresorufina) […]
Diagnóstico diferencial de enfermedad hepática, del 21 de Noviembre de 2019, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un método para predecir o evaluar el riesgo de progresión de enfermedad hepática en un paciente diagnosticado de enfermedad hepática, que comprende medir el nivel de […]
Métodos y sistemas de uso en diagnósticos neonatales, del 7 de Noviembre de 2019, de Sime Diagnostics Ltd: Un procedimiento para diagnosticar el síndrome de dificultad respiratoria (SDR), el procedimiento comprende los pasos de: a) proporcionar menos […]