Vacuna contra HPV.
Una composición que comprende partículas similares a virus (VLP) de HPV 16 y HPV 18 junto con un excipiente farmacéuticamente aceptable,
para su uso como una vacuna en la prevención de enfermedad o infección relacionada con papilomavirus humano en un sujeto en el que la vacuna se formula para administración a un sujeto de 14 años de edad o por debajo de esa edad de conformidad con un régimen de dos dosis que consiste en una primera dosis y una segunda dosis
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/059820.
Solicitante: GLAXOSMITHKLINE BIOLOGICALS S.A..
Nacionalidad solicitante: Bélgica.
Dirección: RUE DE L'INSTITUT, 89 1330 RIXENSART BELGICA.
Inventor/es: WETTENDORFF, MARTINE ANNE CECILE, STEPHENNE, JEAN, DESCAMPS,DOMINIQUE, GIANNINI,SANDRA, LECRENIER,NICOLAS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos virales.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
PDF original: ES-2519490_T3.pdf
Fragmento de la descripción:
Vacuna contra HPV
Campo de la invención La presente invención se refiere a vacunas contra el virus de papiloma humano (HPV) .
Antecedentes de la invención GardasilTM (Merck & Co Inc) es una vacuna contra HPV que comprende una partícula similar a virus (VLP) de HPV 6 que consiste en una proteína HPV 6 L1, una HPV 11 VLP que consiste en una proteína HPV 11 L1, una HPV 16 VLP que consiste en una proteína HPV 16 L1 y una HPV 18 VLP que consiste en una proteína HPV 18 L1 y un adyuvante de aluminio. Las VLP están presentes en una cantidad de 20 μg, 40 μg, 40 μg y 20 μg, respectivamente, por dosis. La vacuna se administra como un régimen de 3 dosis de conformidad con un programa de 0, 2, 6 meses.
CervarixTM (GlaxoSmithKline) es una vacuna contra HPV que comprende una HPV 16 VLP que consiste en una proteína HPV 16 L1 y una HPV 18 VLP que consiste en una proteína HPV 18 L1 y un adyuvante que contiene hidróxido de aluminio y lípido A de 3-desacil-4'-monofosforilo, también referido como 3D-MPL. Las VLP están presentes en una cantidad de 20 μg cada una por dosis. 3D-MPL está presente en una cantidad de 50 μg por dosis. Esta vacuna también se administra como un régimen de 3 dosis de conformidad con un programa de 0, 1, 6 meses.
Se hace referencia a por ejemplo el Boletín de la Organización Mundial de la Salud, vol. 85, 2007, 719-726.
Sumario de la invención La presente invención es una vacuna mejorada contra HPV que es efectiva cuando se administra como un régimen de 2 dosis.
Por consiguiente, la presente invención se refiere a:
1. Una composición que comprende partículas similares a virus (VLP) de HPV 16 y HPV 18 junto con un excipiente farmacéuticamente aceptable, para su uso como una vacuna en la prevención de enfermedad o infección relacionada con papilomavirus humano en un sujeto en el que la vacuna se formula para administración a un sujeto de 14 años de edad o por debajo de esa edad de conformidad con un régimen de dos dosis que consiste en una primera dosis y una segunda dosis.
2. Una composición para su uso de conformidad con el punto 1 en la que la segunda dosis es para administrarse 2 o 3 meses después de la primera dosis.
3. Una composición para su uso de conformidad con el punto 1 en la que la segunda dosis es para administrarse más de dos meses después de la primera dosis.
4. Una composición para su uso de conformidad con el punto 3 en la que la segunda dosis es para administrarse 6 meses después de la primera dosis.
5. Una composición para su uso de conformidad con cualquiera de los puntos 1 a 4 en la que la vacuna además comprende un adyuvante.
6. Una composición para su uso de conformidad con el punto 5 en la que el adyuvante comprende una sal de aluminio.
7. Una composición para su uso de conformidad con el punto 6 en la que la sal de aluminio es hidróxido de aluminio.
8. Una composición para su uso de conformidad con cualquiera de los puntos 5 a 7 en la que el adyuvante comprende un derivado de lípido A.
9. Una composición para su uso de conformidad con el punto 8 en la que el adyuvante comprende 3D-MPL e hidróxido de aluminio.
10. Una composición para su uso de conformidad con cualquier punto precedente en la que cada una de las 2 dosis más de 20 μg de cada una de HPV 16 VLP y HPV 18 VLP o 20 μg o 40 μg de cada una de HPV 16 VLP y HPV 18 VLP.
11. Una composición para su uso de conformidad con cualquier punto precedente en la que las VLP comprenden L1.
12. Una composición para su uso de conformidad con cualquier punto precedente en la que solo las VLP de los tipos 16
y 18 de HPV están presentes en la vacuna.
13. Una composición para su uso de conformidad con cualquier punto precedente en la que la vacuna es para la prevención de enfermedad o infección relacionada con el virus de papiloma humano en mujeres.
Se divulga además un procedimiento para la fabricación de una vacuna, comprendiendo el procedimiento a) combinar HPV 16 VLP, HPV 18 VLP y un adyuvante para formar una vacuna y b) llenar recipientes de almacenamiento o suministro con una dosis humana de la vacuna que contiene más de 20 μg de HPV 16 VLP y más de 20 μg de HPV 18 VLP.
Se divulga además un procedimiento para la fabricación de una vacuna, comprendiendo el procedimiento a) combinar HPV 16 VLP, HPV 18 VLP y un adyuvante para formar una vacuna y b) llenar recipientes de almacenamiento o suministro con una dosis humana de la vacuna que contiene 30 μg de HPV 16 VLP y 30 μg de HPV 18 VLP.
Se divulga además un procedimiento para la fabricación de una vacuna, comprendiendo el procedimiento a) combinar HPV 16 VLP, HPV 18 VLP y un adyuvante para formar una vacuna y b) llenar recipientes de almacenamiento o suministro con una dosis humana de la vacuna que contiene 40 μg de HPV 16 VLP y 40 μg de HPV 18 VLP.
Se divulga además un procedimiento para la fabricación de una vacuna, comprendiendo el procedimiento a) combinar HPV 16 VLP, HPV 18 VLP y un adyuvante para formar una vacuna y b) llenar recipientes de almacenamiento o suministro con una dosis humana de la vacuna que contiene 60 μg de HPV 16 VLP y 60 μg de HPV 18 VLP.
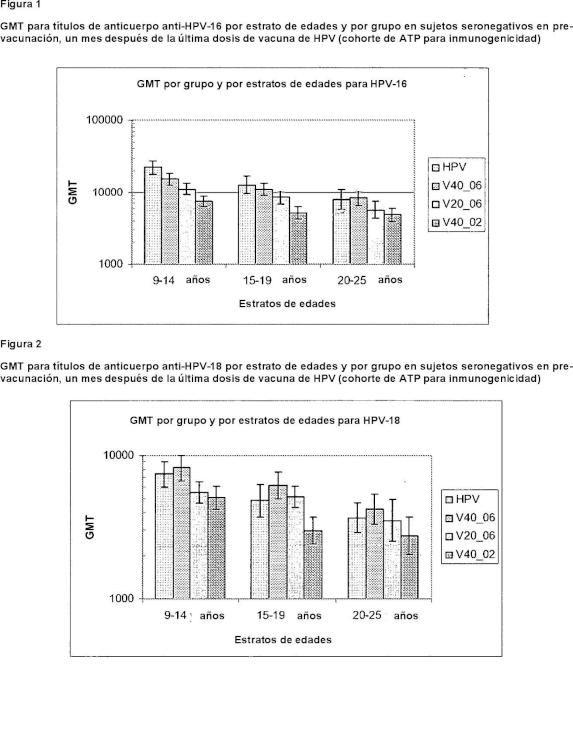
Breve descripción de las figuras La figura 1 muestra la media geométrica de los títulos para títulos de anticuerpo anti-HPV-16 en sujetos que reciben una vacunación de HPV de dos dosis, un mes después de la última dosis de vacuna contra HPV, como se describe en el ejemplo 2.
La figura 2 muestra la media geométrica de los títulos para títulos de anticuerpo anti-HPV-18 en sujetos que reciben una vacunación de HPV de dos dosis, un mes después de la última dosis de vacuna contra HPV, como se describe en el ejemplo 2.
Descripción detallada La invención describe por primera vez una vacuna de dos dosis contra HPV. Se divulga un procedimiento para la prevención de enfermedad o infección relacionada con virus de papiloma humano administrando una vacuna de dos dosis contra HPV. El procedimiento comprende administrar a un individuo que necesita la misma una vacuna que comprende partículas similares a virus (VLP) de HPV 16 y HPV 18 junto con un adyuvante farmacéuticamente aceptable, en el que la vacuna se suministra en dos dosis consecutivas que consisten en una primera dosis y una segunda dosis.
El uso de un régimen de dos dosis comparado con un régimen de tres dosis ofrece la posibilidad de mejorar el acatamiento por el paciente y la posibilidad de vacunación de HPV siendo más compatible con otros programas de vacuna en adolescentes. Dos visitas al médico en vez de tres también ofrece beneficios a los sistemas de cuidados de la salud.
La vacuna se puede administrar en dos dosis en las que cada dosis de la vacuna comprende HPV 16 VLP y HPV 18 VLP en una concentración de más de 20 μg cada una. Cada dosis de la vacuna puede contener, por ejemplo, 30 μg de cada VLP, o 40 μg de cada VLP, o 60 μg de cada VLP, junto con un adyuvante.
La vacuna se puede administrar en dos dosis en las que cada dosis de la vacuna comprende HPV 16 VLP y HPV 18 VLP en una concentración de 20 μg de cada una.
La vacuna se puede administrar en dos dosis en las que cada dosis de la vacuna comprende HPV 16 VLP y HPV 18 VLP en una concentración de 40 μg y 20 μg respectivamente.
La administración de la vacuna puede seguir cualquier programa de 2 dosis, por ejemplo un programa de 0, 1 mes, un programa de 0, 2 meses, un programa de 0, 3, un programa de 0, 4 meses, un programa de 0, 5 meses o un programa de 0, 6 meses. Por ejemplo la segunda dosis se administra entre 2 semanas y 8 meses después de la administración de la primera dosis, por ejemplo entre 1 y 6 meses después de la primera dosis o entre 3 y 8 meses después de la primera dosis. Por lo tanto la segunda dosis se puede administrar por ejemplo un mes o dos meses o tres meses o cuatro meses
La segunda dosis de vacuna se administra más de dos meses después de la primera dosis, por ejemplo 3 o más meses,
un límite superior de 8 meses después de la primera dosis.
Se pueden emplear HPV 16 y HPV 18 VLP, cada una en una cantidad mayor que 20 μg por dosis humana, por ejemplo 30 μg por dosis o mayor que 30 μg por dosis, por ejemplo 40 μg por dosis o 60 μg por dosis u 80 μg por dosis. La cantidad de HPV 16 y 18 VLP por dosis puede ser la misma o diferente. La cantidad de HPV 16 y 18 VLP puede estar cada una independientemente en el intervalo de 25... [Seguir leyendo]
Reivindicaciones:
1. Una composición que comprende partículas similares a virus (VLP) de HPV 16 y HPV 18 junto con un excipiente farmacéuticamente aceptable, para su uso como una vacuna en la prevención de enfermedad o infección relacionada con papilomavirus humano en un sujeto en el que la vacuna se formula para administración a un sujeto de 14 años de edad o por debajo de esa edad de conformidad con un régimen de dos dosis que consiste en una primera dosis y una segunda dosis.
2. Una composición para usar de conformidad con la reivindicación 1 en la que la segunda dosis es para administrarse 2
o 3 meses después de la primera dosis.
3. Una composición para usar de conformidad con la reivindicación 1 en la que la segunda dosis es para administrarse más de dos meses después de la primera dosis.
4. Una composición para usar de conformidad con la reivindicación 3 en la que la segunda dosis es para administrarse 6 meses después de la primera dosis.
5. Una composición para usar de conformidad con cualquiera de las reivindicaciones 1 a 4 en la que la vacuna además comprende un adyuvante.
6. Una composición para usar de conformidad con la reivindicación 5 en la que el adyuvante comprende una sal de aluminio.
7. Una composición para usar de conformidad con la reivindicación 6 en la que la sal de aluminio es hidróxido de aluminio.
8. Una composición para usar de conformidad con cualquiera de las reivindicaciones5 a 7 en la que el adyuvante comprende un derivado de lípido A.
9. Una composición su uso usar de conformidad con la reivindicación 8 en la que el adyuvante comprend.
3. MPL e hidróxido de aluminio.
10. Una composición para su uso de conformidad con cualquier reivindicación precedente en la que cada una de las 2 dosis comprende más de 20 μg de cada una de HPV 16 VLP y HPV 18 VLP o 20 μg o 40 μg de cada una de HPV 16 VLP y HPV 18 VLP.
11. Una composición para usar de conformidad con cualquier reivindicación precedente en la que las VLP comprenden L1.
12. Una composición para usar de conformidad con cualquier reivindicación precedente en la que solo las VLP de los tipos 16 y 18 de HPV están presentes en la vacuna.
13. Una composición para usar de conformidad con cualquier reivindicación precedente en la que la vacuna es para la prevención de enfermedad o infección relacionada con el virus de papiloma humano en mujeres.
Figura 1
GMT para títulos de anticuerpo anti-HPV-16 por estrato de edades y por grupo en sujetos seronegativos en prevacunación, un mes después de la última dosis de vacuna de HPV (cohorte de ATP para inmunogenicidad)
GMT por grupo y por estratos de edades para HPV-16
años años años Estratos de edades Figura 2
GMT para títulos de anticuerpo anti-HPV-18 por estrato de edades y por grupo en sujetos seronegativos en prevacunación, un mes después de la última dosis de vacuna de HPV (cohorte de ATP para inmunogenicidad)
GMT por grupo y por estratos de edades para HPV-18
años años años Estratos de edades
Patentes similares o relacionadas:
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Conectores autoinmolativos no lineales y conjugados de los mismos, del 22 de Julio de 2020, de Byondis B.V: Compuesto conector-farmaco con la formula (I) **(Ver fórmula)** o sal, hidrato o solvato farmaceuticamente aceptables del mismo, donde […]