USO DE UNA SECUENCIA DE NUCLEOTIDOS QUE CODIFICA LA ENZIMA I-SCE I.
SE PROPORCIONA UN ADN AISLADO, QUE CODIFICA PARA LA ENZIMA ISCEI.
DICHA SECUENCIA DE ADN, PUEDE SER INCORPORADA EN VECTORES DE CLONAJE Y EXPRESION, LINEAS CELULARES TRANSFORMADAS Y ANIMALES TRANSGENICOS. LOS CITADOS VECTORES, SON UTILES PARA EL MAPEADO GENETICO Y LA INSERCION DIRIGIDA DE GENES
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP95/04351.
Solicitante: INSTITUT PASTEUR
UNIVERSITE PIERRE ET MARIE CURIE.
Nacionalidad solicitante: Francia.
Dirección: 25-28, RUE DU DOCTEUR ROUX,75724 PARIS CEDEX 15.
Inventor/es: CHOULIKA, ANDRE, NICOLAS, JEAN-FRANCOIS, PERRIN,ARNAUD, DUJON,BERNARD.
Fecha de Publicación: .
Fecha Concesión Europea: 30 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C12N15/66 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Métodos generales para insertar un gen en un vector para formar un vector recombinante, utilizando la escisión y la unión; Utilización de "linkers" no funcionales o de adaptadores, p. ej. "linkers" que contienen la secuencia para una endonucleasa de restricción.
- C12N9/22 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Ribonucleasas.
Clasificación PCT:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- C12N15/11 C12N 15/00 […] › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N15/66 C12N 15/00 […] › Métodos generales para insertar un gen en un vector para formar un vector recombinante, utilizando la escisión y la unión; Utilización de "linkers" no funcionales o de adaptadores, p. ej. "linkers" que contienen la secuencia para una endonucleasa de restricción.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Clasificación antigua:
- A01K67/027 A01K 67/00 […] › Nuevas razas de vertebrados.
- C12N15/11 C12N 15/00 […] › Fragmentos de ADN o de ARN; sus formas modificadas (ADN o ARN no empleado en tecnología de recombinación C07H 21/00).
- C12N15/66 C12N 15/00 […] › Métodos generales para insertar un gen en un vector para formar un vector recombinante, utilizando la escisión y la unión; Utilización de "linkers" no funcionales o de adaptadores, p. ej. "linkers" que contienen la secuencia para una endonucleasa de restricción.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Fragmento de la descripción:
Uso de una secuencia de nucleótidos que codifica la enzima I-Sce I.
Antecedentes de la invención
Esta solicitud divulga una secuencia de nucleótidos que codifica la endonucleasa de restricción I-SceI. Esta solicitud también describe vectores que contienen la secuencia de nucleótidos, células transformadas con los vectores, animales transgénicos con base en los vectores, y líneas de células derivadas de células en los animales. Esta solicitud también describe el uso de I-Sce I para el mapeo de genomas de eucariotas y para recombinación genética in vivo dirigida al sitio.
La habilidad para introducir genes en la línea germinal de mamíferos es de gran interés en biología. La propensión de células de mamífero para tomar ADN añadido en forma endógena y para expresar genes incluidos en el ADN se conoce desde hace muchos años. Los resultados de la manipulación genética son heredados por la descendencia de estos animales. Las células de estos descendientes heredan el gen introducido como parte de su carga genética. Se dice que tales animales son transgénicos.
Los mamíferos transgénicos han suministrado una forma de estudiar la regulación de los genes durante la embriogénesis y en la diferenciación, para estudiar la acción de los genes, y para estudiar la intrincada interacción de las células en el sistema inmunológico. El animal completo es el sistema último de análisis para genes manipulados, que dirigen un proceso biológico complejo.
Los animales transgénicos pueden proporcionar un ensayo general para analizar funcionalmente minuciosamente secuencias de ADN responsables de la regulación específica o de desarrollo del tejido de una variedad de genes. Además, los animales transgénicos proporcionan vehículos útiles para expresar proteínas recombinantes y para generar modelos animales precisos de trastornos genéticos humanos.
Para una discusión general de clonación y expresión génica en animales y en células de animales, ver Old and Primrose, "Principles of Gene Manipulation," Blackwell Scientific Publications, Londres (1989), página 255 y subsiguientes.
Las líneas transgénicas, que tienen una predisposición a enfermedades específicas y trastornos genéticos, son de gran valor en la investigación de los eventos que conducen a estos estados. Es bien conocido que la eficacia del tratamiento de un trastorno genético puede depender de la identificación del defecto genético que es la causa principal del trastorno. El descubrimiento de tratamientos efectivos se puede acelerar suministrando un modelo animal que conducirá a la enfermedad o al trastorno, lo cual permitirá el estudio de la eficacia, seguridad y modo de acción de los protocolos de tratamiento, tal como la recombinación genética.
Uno de los tejidos clave para la comprensión de la recombinación genética es la naturaleza de la etapa de iniciación. Los estudios de recombinación homóloga en bacterias y en hongos han dado lugar a la propuesta de dos tipos de mecanismos de iniciación. En el primer modelo, un corte de la cadena monocatenaria inicia la asimilación de la cadena y la migración de la rama (Meselson y Radding, 1975). Alternativamente, puede ocurrir un rompimiento bicatenario, seguido por un mecanismo de reparación que utiliza una secuencia homóloga no escindida como molde (Resnick y Martin, 1976). Este último modelo ha ganado soporte a partir del hecho de que se incrementa dramáticamente la transformación integradora en levadura cuando el plásmido transformante se linealiza en la región de homología cromosómica (Orr-Weaver, Szostak y Rothstein, 1981) y a partir de la observación directa de un rompimiento bicatenario durante la interconversión de tipo apareamiento (Strathern y colaboradores, 1982). Recientemente, los rompimientos bicatenarios también han sido caracterizados durante recombinación meiótica normal de levadura (Sun y colaboradores, 1989; Alani, Padmore y Kleckner, 1990).
Se han caracterizado diferentes actividades de endonucleasa bicatenaria en levadura: las endonucleasas codificadas por HO y por el intrón están asociadas con funciones de recombinación homóloga, mientras que otras aún tienen funciones genéticas desconocidas (Endo-SceI, Endo-SceII) (Shibata y colaboradores, 1984; Morishima y colaboradores, 1990). La endonucleasa específica del sitio HO inicia la interconversión de tipo apareamiento provocando un rompimiento bicatenario cerca de la unión YZ de MAT (Kostriken y colaboradores, 1983). El rompimiento es posteriormente reparado utilizando las secuencias intactas HML o HMR y resultando en conversión ectópica del gen. El sitio de reconocimiento HO es una secuencia no simétrica degenerada de 24 pb (Nickoloff, Chen, y Heffron 1986; Nickoloff, Singer y Heffron 1990). Esta secuencia ha sido utilizada como un "recombinador" en construcciones artificiales para promover recombinación mitótica y meiótica intra e intermolecular (Nickoloff, Chen y Heffron, 1986; Kolodkin, Klar y Stahl 1986; Ray y colaboradores, 1988, Rudin y Haber, 1988; Rudin, Sugarman, y Haber 1989).
Las endonucleasas específicas de dos sitios, I-Sce I (Jacquier y Dujon, 1985) y I-SceII (Delahodde y colaboradores, 1989; Wenzlau y colaboradores, 1989), que son responsables por la movilidad del intrón en mitocondria, inician una conversión génica que se parece a la conversión inducida por HO (ver Dujon, 1989 para revisión). I-Sce I, que es codificada por el intrón opcional Sc LSU.1 del gen de ARNr 21S, inicia un rompimiento bicatenario en el sitio de inserción del intrón (Macreadie y colaboradores, 1985; Dujon y colaboradores, 1985; Colleaux y colaboradores, 1986). El sitio de reconocimiento de I-Sce I se extiende sobre una secuencia no simétrica de 18 pb (Colleaux y colaboradores, 1988). Aunque las dos proteínas no están obviamente relacionadas por su estructura (HO tiene una longitud de 586 aminoácidos mientras que I-Sce I tiene una longitud de 235 aminoácidos), ambas generan cortes escalonados de 4 pb con proyecciones 3'OH dentro de sus respectivos sitios de reconocimiento. Se ha encontrado que una endonucleasa codificada en el intrón mitocondrial, transcrita en el núcleo y traducida en el citoplasma, genera un rompimiento bicatenario en un sitio nuclear. Los eventos de reparación inducidos por I-Sce I son idénticos a aquellos iniciados por HO.
En resumen, existe la necesidad en el arte de reactivos y métodos para proporcionar modelos de animales transgénicos de enfermedades humanas y trastornos genéticos. Los reactivos se pueden basar en la enzima de restricción I-Sce I y en el gen que codifica esta enzima. En particular, existe la necesidad de reactivos y de métodos para reemplazar un gen natural con otro gen que sea capaz de aliviar la enfermedad o el trastorno genético.
La presente invención cumple con esta necesidad suministrando métodos, animales transgénicos no humanos y células recombinantes como las descritas en el conjunto de las reivindicaciones.
Resumen de la invención
Por lo tanto, esta invención ayuda a satisfacer estas necesidades en el estado del arte. Específicamente, esta solicitud describe un ADN aislado que codifica a la enzima I-SceI. El ADN tiene la siguiente secuencia de nucleótidos:

Esta solicitud también describe una secuencia de ADN que comprende un promotor operativamente enlazado a la secuencia de ADN como se define en este documento, que codifica la enzima I-SceI.
Esta solicitud divulga además a un ARN aislado complementario a la secuencia de ADN como se define en este documento que codifica a la enzima I-Sce I y a las otras secuencias de ADN descritas aquí.
En otra modalidad, se proporciona un vector. El vector comprende un plásmido, bacteriófago, o vector cósmido que contiene la secuencia de ADN como se define aquí, que codifica a la enzima I-SceI.
Además, esta solicitud se relaciona con células eucariotas o de E. coli transformadas con un vector como se define en este documento.
También, esta solicitud se relaciona con animales transgénicos que contienen la secuencia de ADN que codifica la enzima I-Sce I y líneas de células cultivadas a partir de los animales transgénicos.
Esta invención se relaciona con un organismo transgénico en el cual se ha insertado al menos un sitio de restricción para la enzima I-Sce I en un cromosoma del organismo.
La solicitud se relaciona también con un método de mapear genéticamente...
Reivindicaciones:
1. Un método para inducir al menos un rompimiento bicatenario dirigido al sitio en ADN cromosómico de células animales, comprendiendo dicho método
2. El método de la reivindicación 1, en donde dichas células animales son células de mamífero.
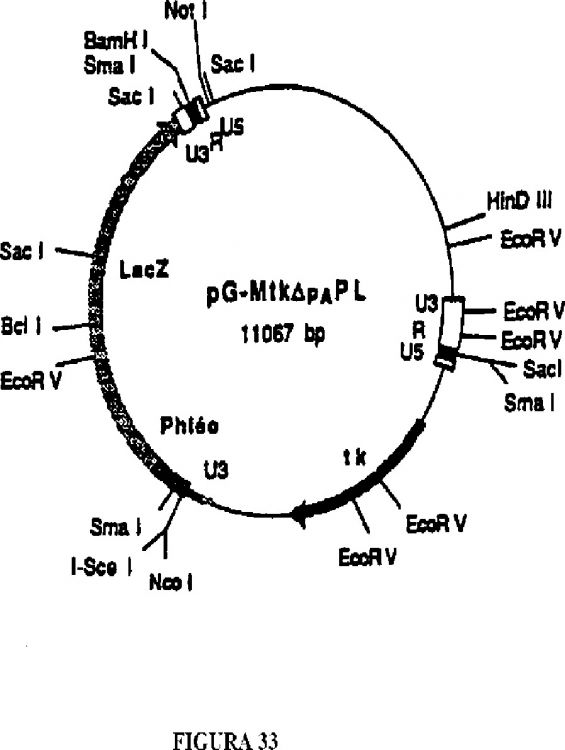
3. El método de la reivindicación 2, en donde dicha célula es una célula NIH3T3 que contiene el virus G-MtkPL.
4. El método de la reivindicación 1, en donde dicho plásmido es pCMV (I-Sce I+)
5. Un método para inducir recombinación homóloga entre ADN cromosómico de células animales y ADN exógeno añadido a dicha célula, comprendiendo dicho método
6. El método de la reivindicación 5, en donde dichas células animales son células de mamífero.
7. El método de la reivindicación 6, en donde dicha célula es una célula NIH3T3 que contiene al virus G-MtkPL.
8. El método de la reivindicación 5, en donde el plásmido que contiene al ADN que codifica a la I-Sce I meganucleasa es pCMV (I-Sce I+).
9. Un método para inducir recombinación homóloga entre ADN cromosómico de una célula animal y ADN exógeno añadido a dicha célula, comprendiendo dicho método
10. El método de la reivindicación 9, en donde dichas células animales son células de mamífero.
11. El método de la reivindicación 9, en donde dicho primer plásmido es pVRneo.
12. El método de la reivindicación 9, en donde dicho segundo plásmido es pCMV (I-Sce I+).
13. Un método para inducir al menos un rompimiento dirigido al sitio en ADN cromosómico de células animales e insertar el ADN que codifica un polipéptido, comprendiendo dicho método
14. Una célula recombinante obtenible por medio del método de cualquiera de las reivindicaciones 1 y 13, con tal de que dicha célula no sea ni una célula germinal humana ni una célula embrionaria humana.
15. Un animal transgénico no humano que comprende una célula transformada por medio del método de cualquiera de las reivindicaciones 1 y 13.
16. Un método para expresar un polipéptido en un animal transgénico no humano, comprendiendo dicho método
17. Una célula madre recombinante que expresa un polipéptido, en donde dicha célula madre puede obtenerse por medio de
con tal de que dicha célula no sea una célula embrionaria humana.
18. Una célula recombinante como la reivindicada en la reivindicación 14, en donde dicho polipéptido es un antígeno foráneo a la célula.
19. Una célula recombinante como la reivindicada en la reivindicación 14, en donde dicha célula es una línea de células de mamífero.
20. Una célula recombinante como la reivindicada en la reivindicación 14, en donde dicha célula es una célula humana del tejido hematopoyético, un hepatocito, una célula de piel, una célula endotelial de vaso sanguíneo o una célula madre.
Patentes similares o relacionadas:
Etiquetado y evaluación de una secuencia diana, del 13 de Mayo de 2020, de RhoDx, Inc: Un método para modificar un ácido nucleico, que comprende: (a) poner en contacto un ácido nucleico de cadena sencilla con una actividad de transferasa […]
Métodos para la expresión recombinante del gen de la beta-glucosidasa, del 29 de Abril de 2020, de Wilmar (shanghai) Biotechnology Research & Development Center Co., Ltd: Una proteína de fusión, en donde dicha proteína de fusión comprende: (a) una proteasa aspártica o un fragmento soluble de la misma, en donde dicho fragmento soluble […]
 Procedimientos y composiciones relacionados con los fragmentos de anticuerpos monocatenarios que se unen a la glucoproteína 72 asociada a tumor (TAG-72), del 25 de Marzo de 2020, de Ohio State Innovation Foundation: Un fragmento de anticuerpo scFv que se une específicamente a la glucoproteína 72 asociada a tumor (TAG-72), donde el fragmento de anticuerpo comprende SEQ ID NO: […]
Procedimientos y composiciones relacionados con los fragmentos de anticuerpos monocatenarios que se unen a la glucoproteína 72 asociada a tumor (TAG-72), del 25 de Marzo de 2020, de Ohio State Innovation Foundation: Un fragmento de anticuerpo scFv que se une específicamente a la glucoproteína 72 asociada a tumor (TAG-72), donde el fragmento de anticuerpo comprende SEQ ID NO: […]
Montaje de ADN mediado por nucleasas, del 8 de Enero de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método in vitro para ensamblar en forma continua dos o más ácidos nucleicos de doble cadena, que comprende: (a) poner en contacto un primer […]
Adaptador vesicular y sus usos en la construcción y secuenciación de una biblioteca de ácidos nucleicos, del 10 de Julio de 2019, de MGI Tech Co., Ltd: Uso de un adaptador vesicular del oligonucleótido para la construcción de una biblioteca de ácidos nucleicos monocatenarios cíclicos en donde dicho adaptador […]
Composiciones y métodos para el ensamblaje de alta fidelidad de ácidos nucleicos, del 24 de Abril de 2019, de Gen9, Inc: Un método de producción de un ácido nucleico objetivo que tiene una secuencia predefinida, comprendiendo el método: proporcionar una pluralidad de fragmentos de […]
Oligonucleótido aislado y su uso en la secuenciación de ácidos nucleicos, del 27 de Marzo de 2019, de MGI Tech Co., Ltd: Un oligonucleótido aislado, que comprende una primera cadena y una segunda cadena, en las que un primer nucleótido terminal en el extremo […]
Adaptador vesicular y usos de este en la construcción y secuenciación de bibliotecas de ácidos nucleicos, del 9 de Enero de 2019, de MGI Tech Co., Ltd: Un adaptador vesicular de oligonucleótido para construir una biblioteca de ácidos nucleicos, que comprende: una región bicatenaria emparejada en 5' en un primer […]