Recogida de muestras biológicas y sistema de transporte y métodos de uso.
Una composición acuosa que incluye los componentes siguientes:
un caotropo presente en una cantidad de entre 0,5 M y 6M;
un detergente presente en una cantidad de entre 0,1% y 1% (peso/vol,), donde el detergente comprende docecilsulfato sódico (SDS), dodecilsulfato de litio (LDS), taurodesoxicolato sódico (NaTDC), taurocolato sódico (NaTC), glicocolato sódico (NaGC), desoxicolato sódico (NaDC), colato sódico, sulfonato de alquilbenceno sódico (NaABS), N-lauril sarcosina (NLS), sales de ácidos carboxílicos, sales de ácidos sulfónicos, sales de ácido sulfúrico, ésteres de ácido fosfórico y polifosfórico, alquilfosfatos, fosfato de monoalquilo (MAP), sales de ácidos perfluorocarboxílicos, detergentes aniónicos o cualquier combinación de estos elementos;
un agente reductor, donde el agente reductor es ß-ME, DTT, DMSO o formamida presente en una cantidad de entre 0,05 M y 0,3 M, o donde el agente reductor es TCEP presente en una cantidad de entre 0,5 mM y 30 mM;
un agente quelante presente en una cantidad de entre 0,5 mM y 50 mM;
un agente tensoactivo presente en una cantidad de entre 0,0001% y 0,3% (peso/vol,), donde el agente tensoactivo comprende cocamidopropil hidroxisultaina, ácidos alquilaminopropiónicos, carboxilatos de imidazolina, betaínas, sulfobetaínas, sultaínas, etoxilatos de alquilfenol, etoxilatos de alcohol, glicoles de polioxipropileno polioxietilenados, mercaptanos polioxietilenados, ésteres de ácido carboxílico de cadena larga, alcanolamidas, glicoles acetilénicos terciarios, siliconas polioxietilenadas, N-alquilpirrolidonas, alquilpoliglicosidasas, polímeros de silicona como Antifoam A®, o polisorbatos como Tween®, o cualquier combinación de estos elementos;
un alcanol de cadena corta presente en una cantidad de entre 1 y 25% (vol,/vol,);
una solución tampón que proporciona a la composición un pH de entre 6 y 7, y
agua libre de nucleasa,
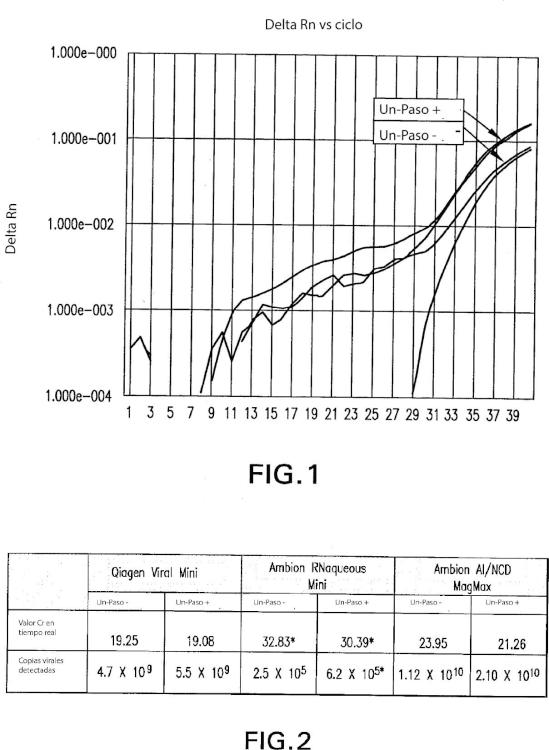
donde los componentes se encuentran presentes todos juntos en una cantidad suficiente como para desnaturalizar proteínas, inactivar nucleasas, eliminar patógenos y no degradar el ácido nucleico de una muestra que se sospecha que contiene agentes patógenos y donde la muestra está en contacto con la composición,
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E12180376.
Solicitante: Longhorn Vaccines and Diagnostics, LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2 Bethesda Metro Center, Suite 910 Bethesda, MD 20814 ESTADOS UNIDOS DE AMERICA.
Inventor/es: FISCHER, GERALD, DAUM,LUKE T.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2552858_T3.pdf


Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]