PROCEDIMIENTOS DE PREPARACIÓN DE NUCLEOSIDOS DE 1,3-DIOXOLANO.
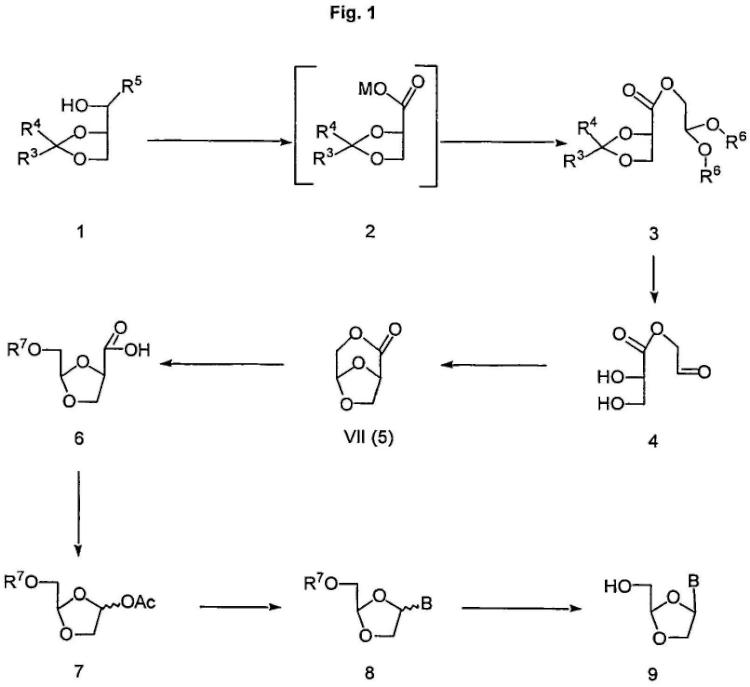
Un procedimiento para preparar compuestos de fórmula VII o VIII:
que comprende las etapas de: a) oxidar glicerol 1,2-O-protegido en una sal de ácido o hidrolizar (R) o (S)-glicerato de metilo 1,2-O- protegido para formar el compuesto intermedio 1 que tiene la fórmula 2; en la que M es un metal; y R 3 y R 4 son independientemente alquilo o aralquilo; b) alquilar el compuesto intermedio 1 con un compuesto de fórmula X'CH 2CH(OR 6) 2, en la que X' es halógeno o pseudo-halógeno, y R 6 es alquilo o aralquilo(C 1-C 20); y c) ciclar con un catalizador ácido, opcionalmente con hidrólisis, el acetal
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/024986.
Solicitante: PHARMASSET, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1860 MONTREAL ROAD TUCKER, GA 30084 ESTADOS UNIDOS DE AMERICA.
Inventor/es: DU, JINFA, WATANABE, KYOICHI, A..
Fecha de Publicación: .
Fecha Solicitud PCT: 6 de Agosto de 2003.
Clasificación Internacional de Patentes:
- C07D317/32 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 317/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen dos átomos de oxígeno como únicos heteroátomos del ciclo. › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos, con a lo más un enlace a un halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
- C07D405/04 C07D […] › C07D 405/00 Compuestos heterocíclicos que contienen a la vez uno o más heterociclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo y uno o más heterociclos que tienen átomos de nitrógeno como único heteroátomo del ciclo. › unidos directamente por un enlace entre dos miembros cíclicos.
- C07D473/04 C07D […] › C07D 473/00 Compuestos heterocíclicos que contienen sistemas cíclicos de purina. › Dos átomos de oxígeno.
- C07D473/16 C07D 473/00 […] › dos átomos de nitrógeno.
- C07D473/20 C07D 473/00 […] › dos átomos de azufre.
- C07D493/08 C07D […] › C07D 493/00 Compuestos heterocíclicos que contienen átomos de oxígeno como únicos heteroátomos del ciclo en el sistema condensado. › Sistemas puenteados.
Clasificación PCT:
- C07D317/32 C07D 317/00 […] › con heteroátomos o con átomos de carbono que tienen tres enlaces a heteroátomos, con a lo más un enlace a un halógeno, p. ej. radicales éster o nitrilo, unidos directamente a los átomos de carbono del ciclo.
- C07D405/04 C07D 405/00 […] › unidos directamente por un enlace entre dos miembros cíclicos.
- C07D473/04 C07D 473/00 […] › Dos átomos de oxígeno.
- C07D473/16 C07D 473/00 […] › dos átomos de nitrógeno.
- C07D473/20 C07D 473/00 […] › dos átomos de azufre.
- C07D493/08 C07D 493/00 […] › Sistemas puenteados.
Clasificación antigua:
- A61K31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2360096_T3.pdf
Fragmento de la descripción:
Referencia cruzada a solicitudes relacionadas
La presente solicitud reivindica prioridad respecto de la solicitud provisional estadounidense n.º 60/401.655 presentada el 6 de agosto de 2002.
Campo de la invención
La presente solicitud pertenece al campo de la Química Farmacéutica y, en particular, proporciona procedimientos para preparar nucleósidos de 1,3–dioxolano, incluyendo las formas D y L enantioméricamente puras.
Antecedentes de la invención
El SIDA, Síndrome de InmunoDeficiencia Adquirida, es una enfermedad catastrófica que ha alcanzado proporciones mundiales. La primera vez que el Centro estadounidense para el Control y la Prevención de Enfermedades (CDC) fue informado acerca del SIDA fue en 1981, cuando dos hombres homosexuales aparentemente sanos contrajeron el Sarcoma de Karposi (SK) y la neumonía por Pneumocystis carinii (NPC), dos enfermedades oportunistas conocidas por afectar únicamente a pacientes inmunodeficientes. Un par de años después, el agente causante del SIDA, un retrovirus asociado a la linfoadenopatía, el Virus de la Inmunodeficiencia Humana (VIH) fue aislado por el Instituto Pasteur en Paris, y posteriormente confirmado por una fuente independiente del Instituto Nacional del Cáncer de Estados Unidos.
Otro virus que supone un grave problema para la salud humana es el virus de la hepatitis B (VHB). El VHB es la segunda causa, únicamente precedida por el tabaco, de cáncer humano. Se desconoce el mecanismo mediante el cual el VHB produce cáncer. Se presupone que puede desencadenar directamente el desarrollo tumoral o desencadenar indirectamente el desarrollo tumoral mediante inflamación crónica, cirrosis y regeneración celular asociada a la infección.
Tras un período de incubación de 2 a 6 meses en el que el huésped no es consciente de la infección, la infección por VHB puede conducir a una hepatitis aguda y un daño del hígado que provoca dolor, ictericia y niveles elevados de determinadas enzimas en sangre. El VHB puede provocar una hepatitis fulminante, una forma que avanza rápidamente, a menudo mortal, de la enfermedad, en la que se destruyen grandes secciones del hígado.
Por lo común, los pacientes se recuperan de la fase aguda de la infección por VHB. En algunos pacientes, sin embargo, se mantienen niveles elevados de antígeno viral en la sangre durante un período prolongado o indefinido, provocando una infección crónica. Las infecciones crónicas pueden conducir a hepatitis persistente crónica. Los pacientes infectados con el VHB persistente crónico son más comunes en los países desarrollados. A mediados de 1991, sólo en Asia, había aproximadamente 225 millones de portadores crónicos del VHB, y en todo el mundo, cerca de 300 millones de portadores. La hepatitis persistente crónica puede provocar fatiga, cirrosis del hígado y carcinoma hepatocelular, un cáncer primario de hígado.
En los países occidentales industrializados, el grupo de alto riesgo para la infección por VHB incluye aquellas personas que están en contacto con portadores del VHB o con sus muestras de sangre. La epidemiología del VHB es muy similar a la del SIDA, y por esta razón la infección por VHB es habitual entre los pacientes infectados con el VIH o SIDA. Sin embargo, el VHB es más contagioso que el VIH.
En 1985, se publicó que el nucleósido sintético 3'–azido–3'–desoxitimidina (AZT, Zidovudina, Retrovir) inhibe la replicación del VIH, y se convirtió en el primer fármaco autorizado por la FDA para usarlo en la lucha contra el SIDA. Desde entonces, una serie de otros nucleósidos sintéticos, incluyendo 2',3'–didesoxinosina (DDI), 2',3'– didesoxicitidina (DDC), 2',3'–didesoxi–2',3'–didehidrotimidina (D4T), (–)–2',3'–didesoxi–3'–tiacitidina (3TC) y 2',3'– didehidro–2',3'–didesoxiguanosina (–)–carbocíclica (carbovir) y su profármaco abacavir, han demostrado ser eficaces contra el VIH. Tras la fosforilación celular en el 5'–trifosfato por parte de la cinasa celular, estos nucleósidos sintéticos se incorporan en una cadena de ADN viral en crecimiento, provocando la terminación de la cadena debido a la ausencia del grupo 3'–hidroxilo. También pueden inhibir la enzima viral transcriptasa inversa.
Ambos, así como 3TC y su análogo de 5–fluorocitosina (FTC) presentan una actividad contra el VHB. Furman, et al., "The Anti–Hepatitis B Virus Activities, Cytotoxicities, and Anabolic Profiles of the (–) and (+) Enantiomers of cis–5– Fluoro–1–[2–(Hydroxymethyl)–1,3–oxathiolane–5–yl]–Cytosine" Antimicrobial Agents and Chemotherapy, diciembre de 1992, pp. 2686–2692; y Cheng, et al., Journal of Biological Chemistry, Volumen 267(20), pp.13938–13942 (1992).
El descubrimiento de que el nucleósido de oxatiolano racémico BCH–189 poseía una potente actividad contra la replicación del Virus de la Inmunodeficiencia Humana (VIH) (Belleau, B. et al., X Conferencia Internacional sobre el SIDA, Montreal, Canadá, 4–9 de junio de 1989, #T.C.O. 1) empujó a que Chu et al. sintetizaran los productos quirales (+)– y (–)–BCH–189 (Tetrahedron Lett., 1991, 32, 3791). Ésta, la lamivudina, conocida también como 3TC o epivir, se usa actualmente a nivel clínico en el tratamiento tanto de la infección por VIH como de la infección por VHB. La 3TC y el interferón son actualmente los únicos fármacos autorizados por la FDA para el tratamiento de la infección por VHB. La resistencia viral se desarrolla comúnmente a los 6 meses del tratamiento con lamivudina en aproximadamente el 14% de los pacientes.
Más tarde, se determinó que el análogo de 5–fluorocitosina, (–)–FTC, es todavía más activo contra el VIH (Choi, W. et al., J. Am. Chem. Soc., 1991, 113, 9377). Más recientemente, se ha descubierto que la forma racémica de FTC o Racivir muestra efectos más beneficiosos contra el VIH o el VHB que (–)–FTC solo (Schinazi, R. F., et al., “Antimicrobial Agents Chemotherapy” 1992, 2423, Patentes estadounidenses n.º 5.204.4665; 5.210.085; 5.914.331; 639.814). El Cis–2–hidroximetil–5–(5–fluorocitosin–1–il)–1,3–oxatiolano (FTC) está siendo actualmente sometido a ensayos clínicos para el tratamiento del VIH y, por separado, del VHB. Véase Schinazi, et al., (1992) "Selective inhibition of human immunodeficiency viruses by racemates and enantiomers of cis–5–fluoro–1–[2–(hydroxymethyl)– 1,3–oxathiolane–5–yl]cytosine" Antimicrob. Agents Chemother. 2423–2431; patente estadounidense n.º 5.210.085; WO 91/11186; WO 92/14743; patente estadounidense n.º 5.914.331 y patente estadounidense n.º 5.814.639.
Estos nucleósidos de 1,3–oxatiolano se fabrican mediante la condensación de la base de purina o pirimidina sililada con un compuesto intermedio de 1,3–oxatiolano. La patente estadounidense n.º 5.204.466 revela un procedimiento para condensar un 1,3–oxatiolano con una pirimidina sililada usando cloruro de estaño como ácido de Lewis, lo que proporciona una β–estereoselectividad casi completa (véase también Choi et al., loc. cit.). Una serie de patentes estadounidenses revelan los procedimientos para la preparación de los nucleósidos de 1,3–oxatiolano mediante la condensación de un éster de ácido 1,3–oxatiolan–2–carboxílico con una base sililada protegida en presencia de un ácido de Lewis basado en silicio, seguida por la reducción del éster en el correspondiente grupo hidroximetilo para proporcionar el producto final (véanse las patentes estadounidenses n.º 5.663.320; 5.693.787; 5.696.254; 5.744.596;
5.756.706 y 5.864.164). Además, estas patentes contienen revelaciones genéricas para la síntesis de nucleósidos de 1,3–dioxolano de una manera similar usando el correspondiente compuesto intermedio de 1,3–dioxolano.
La patente estadounidense n.º 5.272.151 revela un procedimiento que usa un 1,3–oxatiolano 5–O–acilado 2–O– protegido para la preparación de nucleósidos mediante la condensación con una base de purina o pirimidina sililada en presencia de un catalizador de titanio.
La patente estadounidense n.º 6.215.004 revela un procedimiento para producir nucleósidos de 1,3–oxatiolano que incluye condensar metil–5–cloro–1,3–oxatiolano... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para preparar compuestos de fórmula VII o VIII:
**(Ver fórmula)**
que comprende las etapas de:
a) oxidar glicerol 1,2–O–protegido en una sal de ácido o hidrolizar (R) o (S)–glicerato de metilo 1,2–O– protegido para formar el compuesto intermedio 1 que tiene la fórmula 2;
**(Ver fórmula)**
en la que M es un metal; y R3 y R4 son independientemente alquilo o aralquilo;
b) alquilar el compuesto intermedio 1 con un compuesto de fórmula X'CH2CH(OR6)2, en la que X' es halógeno
o pseudo–halógeno, y R6 es alquilo o aralquilo(C1–C20); y
c) ciclar con un catalizador ácido, opcionalmente con hidrólisis, el acetal.
2. El procedimiento según la reivindicación 1, que comprende además la hidrólisis del grupo éster del compuesto de fórmula VII o VIII seguida de la protección del alcohol resultante en condiciones básicas para obtener un compuesto de fórmula 6 (incluyendo los D– y L–isómeros):
**(Ver fórmula)**
en la que R7 es un grupo protector.
3. El procedimiento de la reivindicación 2, en el que R7 es acilo, sililo, alquilo o un grupo aralquilo(C1–C20).
4. El procedimiento de la reivindicación 2, que comprende además la descarboxilación del grupo carboxílico del compuesto 6 y el acoplamiento con una base de purina o pirimidina, seguido de la desprotección para formar un nucleósido de D– o L–dioxolano de fórmula III–VI:
**(Ver fórmula)**
CONH2, CN, CONHR', CH2OH, CH2CN, CH2CH2OH, CF3, CH2CH2F, CH=CHCO2H, CH=CHCO2R', CH=CHCl, CH=CHBr o CH=CHI;
R' es alquilo inferior(C1–C4); cada X y Y es independientemente H, halógeno, OH, OCH3, SH, SCH3, NH2, NHP'. NR'2
o CH3; y
Z es CH o C–X.
5. El procedimiento según la reivindicación 2, en el que la base usada para la hidrólisis del éster de fórmula VII y VIII es una base inorgánica. 6. El procedimiento de la reivindicación 5, en el que la base es una base de metal alcalino o alcalinotérreo acuoso. 7. El procedimiento de la reivindicación 6, en el que la base es NaOH acuoso o KOH acuoso. 8. El procedimiento de la reivindicación 1, en el que la oxidación se realiza usando un agente oxidante seleccionado
del grupo que consiste en NaIO4/RuCl3 hidratado, NaOCl/RuCl3 hidratado, KMnO4, NaIO4, KIO4 y combinaciones de
los mismos. 9. El procedimiento de la reivindicación 4, en el que la descarboxilación se lleva a cabo desde aproximadamente -10°C a 100°C en un disolvente aprótico o agua, o una combinación de los mismos.
10. El procedimiento de la reivindicación 9, en el que el disolvente es un disolvente aprótico. 11. El procedimiento de la reivindicación 10, en el que el disolvente es hexano, ciclohexano, tolueno, acetato de
etilo, THF, dioxano, acetonitrilo, diclorometano, dicloroetano, dietiléter, dimetilformamida (DMF), dimetilsulfóxido (DMSO), dimetilacetamida o una combinación de los mismos. 12. El procedimiento de la reivindicación 1, en el que el catalizador ácido es un ácido de Lewis. 13. El procedimiento de la reivindicación 1, en el que el catalizador ácido es eterato de BF3. 14. El procedimiento de la reivindicación 4 que comprende acoplar la base de purina o pirimidina mediante:
la sililación de la base de purina o pirimidina; y el acoplamiento de la base de purina o pirimidina sililada con el compuesto de fórmula VI en presencia de un ácido de Lewis. 15. El procedimiento de la reivindicación 14, en el que el ácido de Lewis se selecciona del grupo que consiste en tetracloruro de estaño, tetracloruro de titanio o triflato de trimetilsililo.
16. El procedimiento de la reivindicación 14, en el que la base de purina o pirimidina está sililada con hexametildisilazano (HMDS).
17. El procedimiento de la reivindicación 4, que comprende además el aislamiento del nucleósido de fórmula III–VI en forma ópticamente activa. 18. El procedimiento de la reivindicación 17, en el que la forma ópticamente activa se aísla mediante la resolución de una forma racémica mediante técnicas de recristalización, mediante la síntesis a partir de materiales iniciales ópticamente activos, mediante la síntesis quiral o mediante la separación cromatográfica usando una fase estacionaria quiral.
19. El procedimiento de la reivindicación 4, en el que la base de purina o pirimidina se selecciona del grupo que consiste en adenina, N6–alquil–purinas, N6–acilpurinas (en las que acilo es C(O) (alquilo, arilo, alquilarilo o arilalquilo), N6–bencilpurina, N6–halopurina, N6–vinilpurina, purina N6–acetilénica, N6–acil–purina, N6–hidroxialquil– purina, N6–tioalquil–purina, N2–alquilpurinas, N2–alquil–6–tiopurinas, timina, citosina, 5–fluoro–citosina, 5– metilcitosina, 6–azapirimidina, incluyendo 6–aza–citosina, 2– y/o 4–mercapto–pirimidina, uracilo, 5–halouracilo, incluyendo 5–nuorouracilo, C5–alquilpirimidinas, C5–bencil–pirimidinas, C5–halopirimidinas, C5–vinilpirimidina, pirimidina C5–acetilénica, C5–acil–pirimidina, C5–hidroxialquilpurina, C5–amido–pirimidina, C5–cianopirimidina, C5– nitro–pirimidina, C5–aminopirimidina, N2–alquil–purinas, N2–alquil–6–tiopurinas, 5–azacitidinilo, 5–aza–uracililo, triazolopiridinilo, imidazolo–piridinilo, pirrolopirimidinilo y pirazolopirimidinilo.
Patentes similares o relacionadas:
Derivados de bencimidazol como inhibidores Nav 1.7 (subunidad alfa del canal de sodio, dependiente del voltaje, tipo IX (SCN9A)) para tratar el dolor, la disuria y la esclerosis múltiple, del 22 de Julio de 2020, de Sumitomo Dainippon Pharma Co., Ltd: Un compuesto de fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, donde R1a, R1b, R1c, y R1d son independientemente hidrógeno, […]
Compuestos utilizados como inhibidores de la quinasa reordenada durante la transfección (RET), del 1 de Julio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto de acuerdo con la Fórmula (I), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: X es N o CR5; Y es un enlace; […]
Derivados de 4-carboxamido-isoindolinona como inhibidores selectivos de PARP-1, del 27 de Mayo de 2020, de NERVIANO MEDICAL SCIENCES S.R.L.: Un compuesto de fórmula (I): **(Ver fórmula)** en el que: R es hidrógeno o flúor; y n, m, R1 y R2 tienen los significados siguientes: a) n es 0 y m es 0, 1, […]
Análogos de dioxano de uridina para el tratamiento de cáncer, del 22 de Abril de 2020, de MEDIVIR AKTIEBOLAG: Un compuesto representado por la fórmula Ia: **(Ver fórmula)** donde: R1 es OR11, o NR5R5'; R2 es H; R5 es H, C1-C6alquilo, OH, C(=O)R6, OC(=O)R6 […]
Tieno [3,2-d]pirimidinas, furo[3,2,d]pirimidinas y pirrolo[3,2-d]pirimidinas útiles para el tratamiento de infecciones del virus sincitial respiratorio, del 15 de Abril de 2020, de GILEAD SCIENCES, INC.: Un compuesto de Fórmula (III), o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en donde: R2 es F, Cl, OH, NH2, CN y N3; R3 se selecciona […]
3-alcoxi, tioalquilo y amino-4-amino-6-(sustituido)picolinatos y su uso como herbicidas, del 15 de Abril de 2020, de DOW AGROSCIENCES LLC: Un compuesto de Fórmula A: **(Ver fórmula)** en donde Q representa alcoxi C1-C4, haloalcoxi C1-C4, SR3 o NR1R2; X representa H o halógeno; […]
Compuestos de dihidropirimidina-2-ona y usos medicinales de los mismos, del 11 de Marzo de 2020, de JAPAN TOBACCO INC.: Un compuesto de Fórmula [I] o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la que R1 es alquilo C4-8, […]
Dihidropirazoles, composiciones farmacéuticas de los mismos y su uso para el tratamiento de trastornos de fertilidad, del 11 de Marzo de 2020, de MERCK PATENT GMBH: Compuesto de formula (I-B) **(Ver fórmula)** en la que R1 indica Hal, A, CN, -E-fenilo o Het3; R2 indica Hal, A, OA, NH2, CN, SA, SO2A, SO2NH2, O-fenilo […]