PROCEDIMIENTO PARA LA IDENTIFICACIÓN Y EL RECUENTO DE CÉLULAS BIOLÓGICAS.
Un procedimiento para la identificación y el recuento de células biológicas en una muestra,
en particular en una muestra de sangre, caracterizado porque comprende las siguientes operaciones: - mezclar e incubar la muestra con un reactivo que comprende 1) un agente de lisis celular elegido entre al menos un detergente iónico y/o no iónico en una concentración apropiada para lisar los eritrocitos, elegido entre las aminas primarias, los acetatos e hidrocloruros de aminas, las sales de amonio cuaternario y el bromuro de trimetilcetil-amonio; las amidas de diaminas sustituidas, la dietanolaminopropilamina o la dietilamino-propilamida, las amidas de dietilentriamina cicladas, los glicéridos sulfonados; las saponinas, y 2) un colorante apropiado para marcar los ácidos nucleicos intracelulares de las células restantes no lisadas, para realizar, en una sola etapa, la lisis de células de un tipo dado, en particular de células eritrocitarias, la coloración de los ácidos nucleicos intracelulares y la fijación de las células nucleadas; - medir la solución resultante en citometría de flujo con al menos dos parámetros de medida elegidos entre el volumen resistivo, la difracción luminosa en el eje, la transmisión luminosa en el eje, la difusión luminosa ortogonal y la fluorescencia; y - clasificar y contar las células nucleadas en poblaciones, por medio de los parámetros medidos
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E02290387.
Solicitante: ABX.
Nacionalidad solicitante: Francia.
Dirección: PARC EUROMEDECINE, 128, RUE DU CADUCEE, B.P. 7290 34181 MONTPELLIER CEDEX 4 FRANCIA.
Inventor/es: LEFEVRE, DIDIER, CHAMPSEIX, HENRI, VERIAC, SYLVIE.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Febrero de 2002.
Clasificación Internacional de Patentes:
- G01N33/50D6
Clasificación PCT:
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
Clasificación antigua:
- G01N33/50 G01N 33/00 […] › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357524_T3.pdf
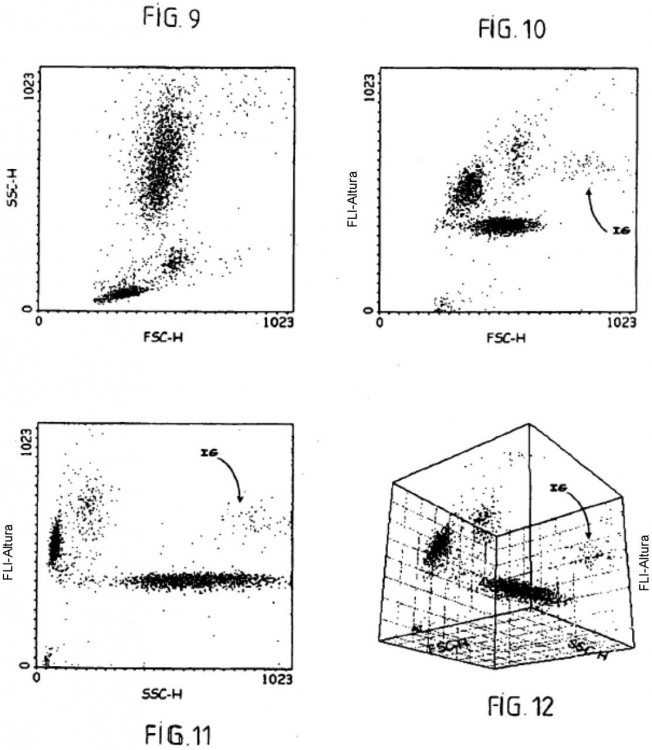
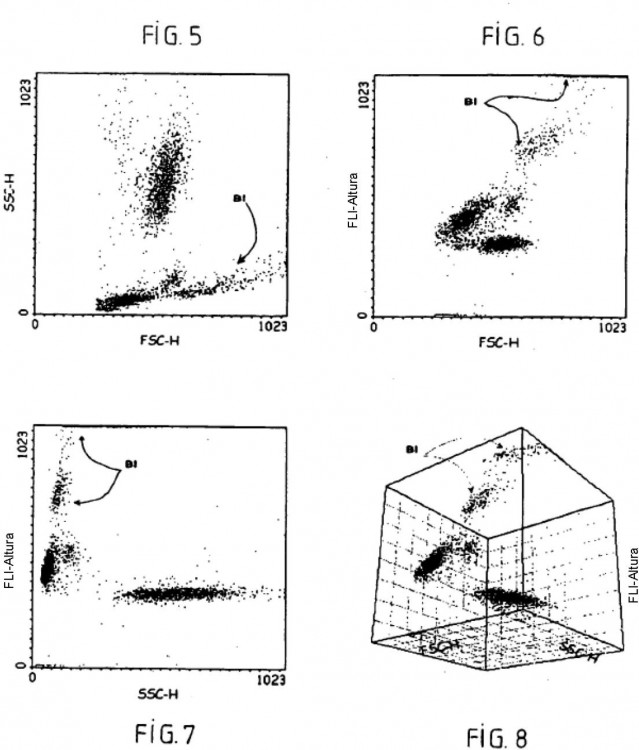
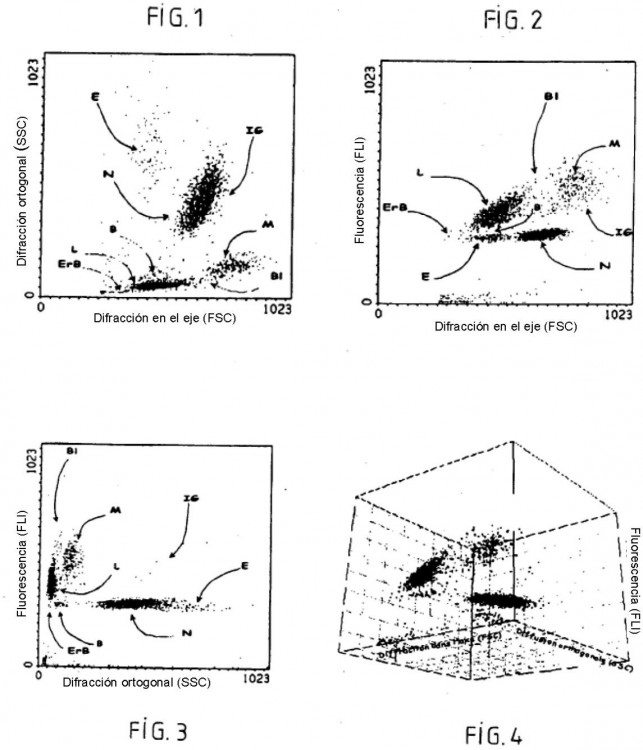
Fragmento de la descripción:
La invención se refiere a los análisis biológicos y especialmente a los análisis de sangre.
Se refiere más particularmente a un reactivo y a un procedimiento para la identificación y el recuento de células biológicas en una muestra, en particular en una muestra de sangre.
La muestra biológica puede ser de sangre humana o animal, o también cualquier otro líquido biológico o 5 preparación biológica.
En el campo de los análisis biológicos, la importancia del diagnóstico de la determinación y del recuento preciso de diferentes poblaciones celulares ha sido reconocida desde hace mucho tiempo. En efecto, la aparición de relaciones de equilibrio anormales entre poblaciones celulares normales de la sangre puede estar correlacionada con la aparición de ciertas enfermedades, por ejemplo reacciones inmunitarias, inflamatorias, etc. De la misma manera, la 10 aparición de poblaciones celulares anormales puede estar correlacionada con la aparición de otras enfermedades, tales como las leucemias, etc.
Los métodos tradicionales de análisis citológico pueden ser variados y comprenden la observación microscópica después de coloración, y eventualmente sedimentación o agregación. La determinación automática de las células sanguíneas ha comenzado a principio de los años 1960 por la separación de las principales poblaciones 15 leucocitarias normales; véase la referencia bibliográfica siguiente: (1) Hallerman L., Thom R., Gerhartz H.: “Elektronische Differentialzählzung von Granulocyten und Lymphocyten nach intervaler Fluochromierung mit Acridinorange”. Verh Deutsch Ges Inn Med 70: 217, 1964.
La separación de los leucocitos se ha realizado en citometría de flujo mediante la utilización de múltiples principios que implican las propiedades ópticas y químicas de las células. Se han fabricado varios autómatas de 20 hematología, utilizando técnicas variadas, como el principio de Coulter para la determinación de los volúmenes, la medida de la luz difractada para la estimación de los tamaños, la medida de la luz difusa a 90º para la determinación de las estructuras internas de las células, y las medidas de fluorescencia o de absorción para la determinación de las afinidades celulares para diversos colorantes; véanse las referencias bibliográficas 2 a 5 siguientes:
(2) Adams L. R., Kamensky L. A.: “Fluorometric Characterization of Six Classes of Human Leukocytes”. Acta Cytol 18: 25 389, 1974;
(3) Shapiro H. M. et al. “Combined Blood Cell Counting and Classification with Fluorochrome Stains and Flow Instrumentation” J. Histochem Cytochem 24. 396-411, 1976;
(4) Terstappen L. W. et al. “Multidimensional Flow Cytometric Blood Cell Differentiation Without Erythrocyte Lysis”. Blood Cells 17: 585-602, 1991; 30
(5) Terstappen L. W., Levin J. “Bone marrow cell differential counts obtained by multidimentional flow cytometry” Blood Cells 18 (2): 311-30, 1992.
La caracterización de las células en las fases precoces del ciclo celular ha interesado desde hace mucho tiempo a los científicos y la cuantificación del contenido de ARN en cada célula se reconoce desde hace mucho tiempo como un parámetro representativo de este ciclo; véanse las referencias bibliográficas 2 a 5 anteriores y las referencias 35 bibliográficas 6 y 7 siguientes:
(6) Traganos F., Darzynkiewickz Z., Sharpless T., Melamed M. R. “Simultaneous Staining of Ribonucleic and Deoxyribonucleic Acids in Unfixed Cells Using Acridine Orange in a Flow Cytofluorometric System” J. Histochem Cytochem 25: 46, 1997;
(7) Pollack A. et al. “Flow Cytometric Analysis of RNA Content in Different Cell Populations Using Pyronin Y and Methyl 40 Green” Citometry, vol. 3, nº 1, pages 28-35, 1982.
En su patente francesa nº 97 01090 del 31 de enero de 1997, el solicitante ha descrito ya una composición, y más particularmente un reactivo de coloración, que permite este tipo de análisis.
Para automatizar tales técnicas, es necesario resolver previamente múltiples problemas como, especialmente, la reducción de los tiempos y del coste de tratamiento de las muestras. Esta reducción puede ser abordada de 45 diferentes maneras, siendo la más evidente la reducción del número de canales para no efectuar más que una sola preparación celular a la vez. Este tipo de técnica ha sido descrita previamente por Léon W. Terstappen (referencia 4 anterior), pero necesita un tiempo de tratamiento y de análisis importante, especialmente para el recuento preciso de las células nucleadas cuya cantidad es normalmente mil veces más pequeña que la de las células eritrocitarias.
Normalmente, para paliar esto, la muestra biológica se divide frecuentemente al menos en dos alícuotas, de las 50 cuales una se prepara a una cierta concentración que permita el estudio de las células eritrocitarias y de las plaquetas, y la otra se prepara a una concentración más alta para el análisis de las células nucleadas.
Estas técnicas conocidas presentan diferentes inconvenientes.
Previamente al análisis, el tratamiento de esta alícuota comprende frecuentemente la destrucción específica de las células eritrocitarias para facilitar la medida de las células restantes. Este método permite obtener más rápidamente los resultados de las observaciones, pero es frenado sin embargo por los tiempos de reacción, de transferencia y de coloración para obtener la preparación deseada. 5
El tiempo de incubación de una suspensión celular en una solución reactiva está especialmente ligado al tiempo que necesitan los principios activos para penetrar en el interior de las células. En la patente francesa 9701090 ya citada, el solicitante ha descrito medios para acelerar esta penetración gracias a la utilización de un aditivo, especialmente de un aditivo del tipo ionóforo, para ayudar a la penetración celular.
El documento EP0343380 utiliza dos colorantes para el recuento de las células biológicas nucleadas. 10
El tiempo de tratamiento varía igualmente en función del número de etapas sucesivas de deberá sufrir la alícuota. La lisis y la coloración de las células se llevan a cabo normalmente en dos etapas sucesivas, en un orden o en otro (véase la patente US 6.004.816).
Estas dos etapas de dilución implican un coste no despreciable en material, asociado con un tiempo de tratamiento mínimo importante. 15
El documento US5232857 utiliza un colorante que no colorea los ácidos nucleicos.
En consecuencia es un objetivo proponer un reactivo para la identificación y el recuento de las células biológicas que supere los inconvenientes citados anteriormente.
En particular es un objetivo proporcionar un reactivo semejante que permita efectuar simultáneamente la lisis de ciertas células, en particular de células eritrocitarias, la fijación de las células nucleadas y la coloración del material 20 intracelular.
Igualmente es un objetivo proporcionar un reactivo semejante que permita realizar estas operaciones en un tiempo restringido para reducir de forma importante los costes y los tiempos de análisis, y el número de reactivos.
Se propone a este efecto un reactivo para la identificación y el recuento de las células biológicas en una muestra, que comprende: 25
- un agente de lisis celular elegido entre al menos un detergente en una concentración eficaz para lisar específicamente un tipo dado de células de la muestra, y
- un colorante apropiado para marcar los ácidos nucleicos intracelulares de las células restantes no lisadas.
Se proporciona así un reactivo de lisis y de coloración simultánea de una muestra biológica, lo que permite obtener en una sola etapa una solución de células que pueda ser analizada, por ejemplo por un sistema de citometría 30 de flujo. Este análisis permite obtener una clasificación y un recuento de las células así tratadas.
De este modo, el reactivo combina una solución reactiva del tipo descrito en la patente francesa 97 01090 con un agente de lisis celular que permite lisar específicamente un tipo dado de células de la muestra, en particular las células eritrocitarias.
La solución reactiva colorante por sí misma, descrita en la patente francesa 97 01090, permite acelerar la 35 permeación a través de la membrana... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para la identificación y el recuento de células biológicas en una muestra, en particular en una muestra de sangre, caracterizado porque comprende las siguientes operaciones:
- mezclar e incubar la muestra con un reactivo que comprende 1) un agente de lisis celular elegido entre al menos un detergente iónico y/o no iónico en una concentración apropiada para lisar los eritrocitos, elegido entre las aminas 5 primarias, los acetatos e hidrocloruros de aminas, las sales de amonio cuaternario y el bromuro de trimetilcetil-amonio; las amidas de diaminas sustituidas, la dietanolaminopropilamina o la dietilamino-propilamida, las amidas de dietilentriamina cicladas, los glicéridos sulfonados; las saponinas, y 2) un colorante apropiado para marcar los ácidos nucleicos intracelulares de las células restantes no lisadas, para realizar, en una sola etapa, la lisis de células de un tipo dado, en particular de células eritrocitarias, la coloración de los ácidos nucleicos intracelulares y la fijación de las células 10 nucleadas;
- medir la solución resultante en citometría de flujo con al menos dos parámetros de medida elegidos entre el volumen resistivo, la difracción luminosa en el eje, la transmisión luminosa en el eje, la difusión luminosa ortogonal y la fluorescencia; y
- clasificar y contar las células nucleadas en poblaciones, por medio de los parámetros medidos. 15
2. El procedimiento según la reivindicación 1, caracterizado porque el colorante es de tipo fluorescente.
3. El procedimiento según una de las reivindicaciones 1 o 2, caracterizado porque el colorante es apropiado para asociarse específicamente con el ácido ribonucleico intracelular y aumentar su fluorescencia, una vez asociado al mismo.
4. El procedimiento según una de las reivindicaciones 1 a 3, caracterizado porque el colorante se elige entre: 20
naranja de tiazol o p-tosilato de 1-metil-4-[(3-metil-2-(3H)-benzotiazoliliden)metil]quinolinio,
azul de tiazol,
diyoduro de 4-[(3-metil-2-(3H)-benzotiazoliliden)metil]-1-[3-(trimetilamonio)propil] quinolinio
yoduro de 3,3'-dimetiloxacarbocianina o yoduro de 3-metil-2-[3-(3-metil-2-(3H)-benzoxasoliliden)-1-propenil]benzoxazolio, 25
tioflavina T,
los colorantes SYTO® y TOTO® (TM Molecular Probes),
bromuro de etidio,
yoduro de propidio,
naranja de acridina, 30
corifosfina O,
auramina O,
los colorantes HOECHST 33258 y HOECHST 33342,
4',6-diamino-2-fenilindol, dihidrocloruro (DAPI),
4',6-(diimidazolin-2-il)-2-fenilindol, dihidrocloruro (DIPI), 35
7-aminoactinomicina D,
actinomicina D, y
LDS 751.
5. El procedimiento según una de las reivindicaciones 1 a 4, caracterizado porque el reactivo comprende además, al menos un agente de penetración a través de la membrana apropiado para favorecer la penetración del 40 colorante en las células a marcar.
6. El procedimiento según la reivindicación 5, caracterizado porque el agente que favorece la penetración a través de la membrana es un compuesto ionóforo de tipo protonóforo y/o antibiótico.
7. El procedimiento según una de las reivindicaciones 1 a 6, caracterizado porque el reactivo comprende además, al menos un agente de fijación en la membrana presente a una concentración de 0,1 % a 10 % (p/v).
8. El procedimiento según la reivindicación 7, caracterizado porque el agente de fijación en la membrana comprende al menos un alcohol y/o un aldehído elegido entre el paraformaldehído y el glutaraldehído.
9. El procedimiento según una de las reivindicaciones 1 a 8, caracterizado porque el reactivo comprende 5 además, al menos un compuesto elegido entre un agente complejante, una sal inorgánica y un sistema tampón.
10. El procedimiento según una de las reivindicaciones 1 a 9, caracterizado porque la medida de resistividad se efectúa por medio de al menos una corriente elegida entre una corriente continua (DC) y una corriente de pulsos o alternativa (RF).
11. El procedimiento según una de las reivindicaciones 1 a 10, caracterizado porque el parámetro de difracción 10 luminosa en el eje es al menos un parámetro elegido entre la difracción de ángulos pequeños y la difracción de ángulos grandes.
12. El procedimiento según una de las reivindicaciones 1 a 11, caracterizado porque las células nucleadas clasificadas son indiferentemente células maduras o inmaduras, normales o anormales.
13. El procedimiento según una de las reivindicaciones 1 a 12, caracterizado porque la calificación de las 15 células nucleadas se realiza mediante un programa de análisis multidimensional con o sin el recurso a una técnica neuronal programada o no.
14. El procedimiento según una de las reivindicaciones 1 a 13, caracterizado porque la muestra es una muestra de sangre humana o animal.
15. El procedimiento según una de las reivindicaciones 1 a 14, caracterizado porque la muestra es una muestra 20 de líquido biológico o una suspensión de células, de origen humano o animal.
Patentes similares o relacionadas:
 MÉTODO DE DISCRIMINACIÓN DE AL MENOS DOS POBLACIONES CELULARES Y APLICACIÓN, del 15 de Abril de 2011, de HORIBA ABX SAS: Un método de discriminación y de recuento de al menos dos poblaciones de elementos biológicos portadores de características biológicas específicas, eventualmente presentes en […]
MÉTODO DE DISCRIMINACIÓN DE AL MENOS DOS POBLACIONES CELULARES Y APLICACIÓN, del 15 de Abril de 2011, de HORIBA ABX SAS: Un método de discriminación y de recuento de al menos dos poblaciones de elementos biológicos portadores de características biológicas específicas, eventualmente presentes en […]
 CUBETA, del 7 de Abril de 2011, de MIGRATA U.K. LIMITED: Microcubeta desechable con por lo menos una cavidad para la determinación espectrofotométrica de hemoglobina en sangre entera sin diluir, caracterizada […]
CUBETA, del 7 de Abril de 2011, de MIGRATA U.K. LIMITED: Microcubeta desechable con por lo menos una cavidad para la determinación espectrofotométrica de hemoglobina en sangre entera sin diluir, caracterizada […]
PROCEDIMIENTO PARA LA DETERMINACIÓN DE CARACTERÍSTICAS Y/O PARA LA CLASIFICACIÓN DE MACRÓFAGOS CIRCULANTES Y SISTEMA DE ANÁLISIS PARA LLEVAR A CABO DICHO PROCEDIMIENTO, del 7 de Febrero de 2011, de HERWIG, RALF: Procedimiento para la determinación de características y/o la clasificación de macrófagos circulantes, que incluye los siguientes pasos: - aislamiento de macrófagos de sangre […]
 REACTIVO DE LISIS PARA RECUENTO SIMULTANEO DE DIFERENTES TIPOS DE CELULAS SANGUINEAS EN UNA MUESTRA DE SANGRE, del 3 de Septiembre de 2010, de CHEMPAQ A/S: Un reactivo que comprende:
- un compuesto estabilizador de la hemoglobina seleccionado del grupo constituido por imidazol, derivados de imidazol, y combinaciones de los […]
REACTIVO DE LISIS PARA RECUENTO SIMULTANEO DE DIFERENTES TIPOS DE CELULAS SANGUINEAS EN UNA MUESTRA DE SANGRE, del 3 de Septiembre de 2010, de CHEMPAQ A/S: Un reactivo que comprende:
- un compuesto estabilizador de la hemoglobina seleccionado del grupo constituido por imidazol, derivados de imidazol, y combinaciones de los […]
 EXPANSION DE POBLACIONES DE CELULAS MADRE RENOVABLES, del 23 de Agosto de 2010, de GAMIDA CELL LTD: Un método de expansión de una población de células madre hematopoyéticas ex vivo, mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas […]
EXPANSION DE POBLACIONES DE CELULAS MADRE RENOVABLES, del 23 de Agosto de 2010, de GAMIDA CELL LTD: Un método de expansión de una población de células madre hematopoyéticas ex vivo, mientras al mismo tiempo, se inhibe sustancialmente la diferenciación de dichas […]
 PROCEDIMIENTO PARA ESTIMAR LA CANTIDAD DE TIPOS CELULARES DE NEUTROFILOS ESPECIFICOS, del 4 de Junio de 2010, de PHADIA AB: Un procedimiento para estimar in vitro la cantidad de células específicas en una muestra de un paciente, en el que se usan moléculas con especificidad celular para calcular […]
PROCEDIMIENTO PARA ESTIMAR LA CANTIDAD DE TIPOS CELULARES DE NEUTROFILOS ESPECIFICOS, del 4 de Junio de 2010, de PHADIA AB: Un procedimiento para estimar in vitro la cantidad de células específicas en una muestra de un paciente, en el que se usan moléculas con especificidad celular para calcular […]
PROCEDIMIENTO INMUNOCROMATOGRAFICO, del 18 de Marzo de 2010, de MITSUBISHI KAGAKU IATRON, INC.: Un procedimiento inmunocromatográfico caracterizado por comprender las etapas de: preparación de una muestra obtenida a partir de sangre entera mediante […]
Cultivo de tejido tridimensional heterogéneamente diferenciado, del 22 de Julio de 2020, de IMBA-INSTITUT FÜR MOLEKULARE BIOTECHNOLOGIE GMBH: Un cultivo de tejido neuronal tridimensional artificial cultivado in vitro que comprende una población heterogénea de células humanas o células de primate no humanas […]