PROCEDIMIENTO PARA EL AISLAMIENTO DE CELULAS MADRE MESENQUIMATICAS DEL FOLICULO PILOSO.
Procedimiento para el aislamiento de células madre mesenquimáticas del folículo piloso,
que comprende las siguientes etapas:
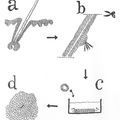
a) escisión de un cabello previamente preparado;
b) aislamiento del bulbo piloso unido de forma acetabular junto con la papila pilosa dérmica;
c) separación de la papila pilosa dérmica y del bulbo piloso;
d) cultivo del bulbo piloso obtenido en la etapa c) para producir células madre mesenquimáticas, presentando las células madre mesenquimáticas una actividad de fosfatasa alcalina;
e) agrupamiento de las células confluentes
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DE03/01863.
Solicitante: HOFFMANN, ROLF.
Nacionalidad solicitante: Alemania.
Dirección: IN DEN ESCHMATTEN 24,79117 FREIBURG.
Inventor/es: HOFFMANN,ROLF, MCELWEE,KEVIN J.
Fecha de Publicación: .
Fecha Concesión Europea: 30 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- C12N5/06B12B
- C12N5/06B12P
Clasificación PCT:
- C12N5/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
Clasificación antigua:
- C12N5/00 C12N […] › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).

Fragmento de la descripción:
Procedimiento para el aislamiento de células madre mesenquimáticas del folículo piloso.
La presente invención se refiere a un procedimiento para el aislamiento de células madre mesenquimáticas del folículo piloso.
Dejando de lado la mucosa, las palmas de las manos y las plantas de los pies, se encuentran folículos pilosos en todo el integumento del ser humano, que representan una unidad funcional compleja autocontenida, un órgano en miniatura. Se diferencian de modo topográfico-anatómico cuatro porciones: a) infundíbulo: sección entre el ostio del folículo piloso y la desembocadura de las glándulas sebáceas en el canal piloso; b) istmo: sección entre la desembocadura de las glándulas sebáceas y el punto de inserción del músculo erector del pelo; c) infrainfundíbulo (parte suprabulbar) sección entre el punto de inserción del músculo erector del pelo hasta el bulbo y d) bulbo piloso incluyendo las papilas. Se estima que una cabeza con pelo alberga aproximadamente 100.000 folículos pilosos que se distribuyen por el cuero cabelludo en grupos de 3-5 folículos pilosos, las denominadas unidades foliculares. Estas unidades foliculares están rodeadas por una trama de fibras de colágeno finas y están separadas entre sí por fibras de colágeno más anchas.
El bulbo piloso en forma de cebolla forma el extremo proximal del folículo piloso en crecimiento y, en los cabellos terminales, llega hasta el tejido graso subcutáneo (Figura 2a. recuadro). Las células de matriz pilosa situadas en el bulbo piloso se diferencian y forman así el tallo. Las células de la matriz son las denominadas "células amplificadoras transitorias", es decir, una población de células que mueren después de una fase de crecimiento proliferativo elevado. En el bulbo piloso proximal la papila pilosa dérmica (Fig. 2b y c), que está alimentada por una fina trama de nervios y vasos, se curva hacia dentro como una cebolla. La papila pilosa dérmica se diferencia de la dermis a ese respecto en que está embebida en una matriz extracelular que es igual en su composición a una membrana basal. Durante la fase de crecimiento del folículo piloso (denominada anagenia) pueden por tanto entrar en contacto directo los fibroblastos individuales de las papilas pilosas dérmicas mediante extensiones celulares con queratinocitos de matriz. En la cabeza de la papila dérmica se asientan melanocitos que, dependiendo del ciclo capilar, presentan actividad de melanogénesis desde el estado de anagenia IV hasta el inicio de la catagenia (fase de regresión). Mediante las células papilares pilosas especializadas, se regula la actividad de los queratinocitos de matriz mediante señales morfogénicas y mitogénicas. Si aparecen disfunciones en este segmento capilar, termina la fase de crecimiento (anagenia) y el folículo entra en la fase de regresión, la catagenia. Así, se observa claramente que los procesos que destruyen los queratinocitos de matriz y la región protuberante suprayacente (zona protuberante) conducen a una pérdida capilar irreversible, mientras que los agentes nocivos que afectan únicamente a la función de las células papilares, determinan el tamaño de las papilas y el grosor de los tallos pilosos para formar. Por tanto, las papilas pilosas mayores se encuentran en pelos de la barba y cada vez más pequeñas en el caso de una alopecia androgénica.
La vaina radicular capilar de tejido conjuntivo (DS= vaina dérmica en inglés), el denominado folículo piloso, está compuesta por dos capas de fibras de colágeno, en las que la interna está dispuesta circularmente alrededor del tallo piloso. La parte externa más gruesa de la vaina radicular mesenquimática contiene fibras elásticas y de colágeno que discurren paralelas al tallo piloso. Adicionalmente, se encuentran como señal de la función táctil del pelo tramas circulares de fibras nerviosas que penetran hasta la membrana cristalina. Las vainas de raíz capilar mesenquimáticas se continúan en el extremo proximal en los denominados acolchamientos papilares.
El tallo piloso está rodeado por vainas radiculares epiteliales encajadas telescópicamente en forma de envoltura. A la altura de la formación y pigmentación del tallo piloso intrafolicular pueden delimitarse fácilmente, en sección transversal, una vaina radicular interna (VRI) y una vaina radicular externa (VRE). La VRI se forma a partir de la capa de Henle externa mayoritariamente doble, la capa de Huxley media multicapa, así como la cutícula. Las tres capas se generan a partir de las células de matriz situadas en el borde exterior del bulbo. Mientras que la vaina radicular externa se continúa directamente en la capa de células basales de la epidermis, la VRI termina aproximadamente a la altura del infundíbulo. Por tanto, la zona distal de paso al recubrimiento epidérmico del ostio folicular piloso presenta un cornificación epidérmica. Directamente por debajo de la desembocadura de las glándulas sebáceas, la VRE limita con la VRI. Un lugar importante de la VRE es el punto de inserción del músculo erector del pelo, la denominada protuberancia. En esta región, así como en posición proximal a ella, se supone el sitio de las células madre epiteliales del folículo piloso. Mediante un corte horizontal a la altura del istmo, se reconocen los cabellos terminales por su tallo piloso más grueso en comparación con la VRI y las vellosidades por sus tallos pilosos finos que son más finos que la VRI.
El folículo piloso está compuesto por dos tipos de células primarias. Un tipo de células se incorpora al inicio de la morfogénesis del folículo piloso a partir del ectodermo embrionario/epidermis, y el otro a partir de la porción mesodérmica. Aunque las células madre epiteliales del folículo piloso se encuentran significativamente dentro de la región denominada "protuberante" (inserción del músculo del folículo piloso) del folículo piloso, era la doctrina aceptada que las células madre mesenquimáticas residían en la papila dérmica. A este respecto, investigaciones anteriores han mostrado que pueden implantarse papilas dérmicas preparadas en segmentos de piel sin pelo y que esto induce la formación de nuevos folículos pilosos (Oliver 1970, Jahoda et al. 1984, Reynolds et al. 1999). Así, el lugar de extracción de las células papilares determina el tipo de cabellos formados (por ejemplo, papilas de pelo de bigote forman de nuevo pelos de bigote en una oreja de ratón). Pueden ponerse también papilas dérmicas (DP en inglés) en los medios de cultivo para elevar el recuento celular. Estas células de DP cultivadas pueden implantarse en zonas de piel sin pelo (por ejemplo, las palmas de las manos) y son capaces incluso aquí de inducir la formación de nuevos folículos pilosos (Messenger 1984). Las células de DP son ciertamente capaces de inducir cabellos, pero no repueblan la región de DSC o DS. DSC significa "copa de vaina dérmica" y reproduce la situación de las células. Además, los cabellos formados mediante las células de DP tienen sólo una corta vida útil.
En el documento WO 99/03505, se muestra que están presentes células madre mesenquimáticas en el bulbo piloso. El documento WO 99/03505 no enseña sin embargo que las células madre mesenquimáticas del bulbo piloso presenten una actividad de fosfatasa alcalina.
La pérdida de cabello es por una parte una etapa del proceso de envejecimiento (alopecia senil), el resultado de mecanismos patológicos activos como en alopecia androgénica, alopecia areata y alopecias cicatrizante/traumática, o la consecuencia de una quimioterapia. La pérdida de cabello se contempla en general en la sociedad bajo una óptica negativa. La gran demanda de terapias para evitar la pérdida de cabello o para reemplazar cabellos ha conducido al desarrollo de una pluralidad de distintos medicamentos, productos y técnicas. En la investigación biológica del cabello, se ha identificado a las papilas dérmicas dentro de la unidad del folículo piloso como una estructura clave que determina el desarrollo y diferenciación del folículo piloso en la embriogénesis y que controla tanto el crecimiento de las fibras pilosas como el ciclo del folículo piloso. En muchas enfermedades de pérdida de cabello, incluyendo la alopecia más conocida, la androgénica, afectan a la papila dérmica factores externos que conducen a que la papila dérmica no pueda mantener erguida la unidad del folículo piloso. Parece ser atribuible en parte a una reducción del tamaño y a la pérdida de células de la papila dérmica. El tamaño reducido de la papila dérmica está en relación directa con el tamaño reducido de los folículos pilosos.
Pueden definirse de manera simplificada las enfermedades...
Reivindicaciones:
1. Procedimiento para el aislamiento de células madre mesenquimáticas del folículo piloso, que comprende las siguientes etapas:
2. Procedimiento según la reivindicación 1, en el que el folículo piloso procede de un mamífero.
3. Procedimiento según la reivindicación 2, en el que el mamífero es un ratón, rata, conejo, conejillo de Indias, cabra, cerdo, vaca o ser humano.
Patentes similares o relacionadas:
 EPIDERMIS CULTIVADA SECRETORA DE FACTORES TERAPEUTICOS PRODUCIDA POR CELULAS MADRE DE PELO Y METODO DE OBTENCION, del 22 de Diciembre de 2009, de SERRANO GOMEZ,FERNANDO: Resulta de la producción de una epidermis cultivada a través del cultivo de pelo arrancado de un paciente afecto de una determinada enfermedad caracterizada […]
EPIDERMIS CULTIVADA SECRETORA DE FACTORES TERAPEUTICOS PRODUCIDA POR CELULAS MADRE DE PELO Y METODO DE OBTENCION, del 22 de Diciembre de 2009, de SERRANO GOMEZ,FERNANDO: Resulta de la producción de una epidermis cultivada a través del cultivo de pelo arrancado de un paciente afecto de una determinada enfermedad caracterizada […]
 Procedimiento y dispositivo para producir un objeto multicelular tridimensional, del 29 de Julio de 2020, de TECHNISCHE UNIVERSITAT BERLIN: Procedimiento para producir un objeto multicelular tridimensional, con los pasos siguientes:
a) introducción de un primer líquido fotopolimerizable […]
Procedimiento y dispositivo para producir un objeto multicelular tridimensional, del 29 de Julio de 2020, de TECHNISCHE UNIVERSITAT BERLIN: Procedimiento para producir un objeto multicelular tridimensional, con los pasos siguientes:
a) introducción de un primer líquido fotopolimerizable […]
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Composiciones mejoradas para hidrogeles, del 22 de Julio de 2020, de Biogelx Limited: Una composición de hidrogel, que comprende una mezcla de los derivados peptídicos primero y segundo en una proporción de 1:4 a 4:1, en donde los primeros derivados […]
Sistemas de conservación y procesamiento de espermatozoides, del 17 de Junio de 2020, de XY, LLC: Un procedimiento para producir una muestra de esperma de mamífero no humano adecuada para la fertilización in vitro, que incluye la etapa de: […]
Producción de tapsigarginas por cultivo en suspensión de células de Thapsia, del 6 de Mayo de 2020, de PHYTON HOLDINGS, LLC: Método de producción de lactonas sesquiterpénicas de la familia de tapsigargina, comprendiendo el método las etapas de: (a) cultivar células vegetales […]
Composición de medio para preparar toxina botulínica, del 6 de Mayo de 2020, de Daewoong Co., Ltd: Una composición de medio libre de EET para su uso en el cultivo de Clostridium botulinum, la composición de medio comprende: peptonas de origen […]
Células virales resistentes y sus usos, del 22 de Abril de 2020, de Sigma-Aldrich Co. LLC: Una línea celular de ovario de hámster chino (CHO) modificada genéticamente en la que la entrada y/o propagación del virus diminuto del ratón (MVM) […]