Método para la purificación de alfa-1-antitripsina.
Un método para purificar alfa-1-antitripsina (AAT) activa a partir de un precipitado proteico que contiene AAT crudo,
que comprende los pasos de:
(a) suspender el precipitado proteico que contiene AAT crudo en un tampón en condiciones que permitan que la AAT se disuelva;
(b) poner en contacto la suspensión que contiene AAT con un agente reductor de disulfuros para producir una suspensión reducida;
(c) poner en contacto la suspensión que contiene AAT reducida con un material que adsorbe proteínas insoluble, sin la adición de una cantidad de sal o sales solubles que provocará que proteínas que de otro modo serían solubles empiecen a precipitar a partir de la solución;
(d) eliminar materiales insolubles de la suspensión que contiene AAT reducida, de modo que se obtenga una solución proteica aclarada; y
(e) aislar el producto que contiene AAT activa resultante;
donde el precipitado proteico que contiene AAT crudo se refiere a cualquier precipitado proteico que contiene AAT preparado mediante uno o más métodos conocidos para precipitar selectivamente proteínas a partir de una solución, ya sea a partir de suero, leche, cultivo celular u otra fuente original.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/040560.
Solicitante: CSL Behring LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1020 First Avenue King of Prussia, PA 19406 ESTADOS UNIDOS DE AMERICA.
Inventor/es: KLING, ROBERT, SMITH, JAMES, R., WEBER,DAVID, KEE,SCOTT M, COOK,PAUL I, FOWLER,SCOTT A.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- B01D15/32 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01D SEPARACION (separación de sólidos por vía húmeda B03B, B03D, mesas o cribas neumáticas B03B, por vía seca B07; separación magnética o electrostática de materiales sólidos a partir de materiales sólidos o de fluidos, separación mediante campos eléctricos de alta tensión B03C; aparatos centrifugadores B04B; aparato de vórtice B04C; prensas en sí para exprimir los líquidos de las sustancias que los contienen B30B 9/02). › B01D 15/00 Procedimientos de separación que implican el tratamientos de líquidos con absorbentes sólidos; Aparatos para ello. › Cromatografía en fase unida, p.ej. con una fase normal unida, una fase inversa o una interacción hidrófoba.
- B01D15/36 B01D 15/00 […] › implicando la interacción iónica, p.ej. intercambio de iones, supresión de iones o exclusión de iones.
- C07K14/81 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Inhibidores de proteasa.
- G01N30/46 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 30/00 Investigación o análisis de materiales por separación en constituyentes utilizando la adsorción, la absorción o fenómenos similares o utilizando el intercambio iónico, p. ej. la cromatografía (G01N 3/00 - G01N 29/00 tienen prioridad). › utilizando más de una columna.
PDF original: ES-2515816_T3.pdf
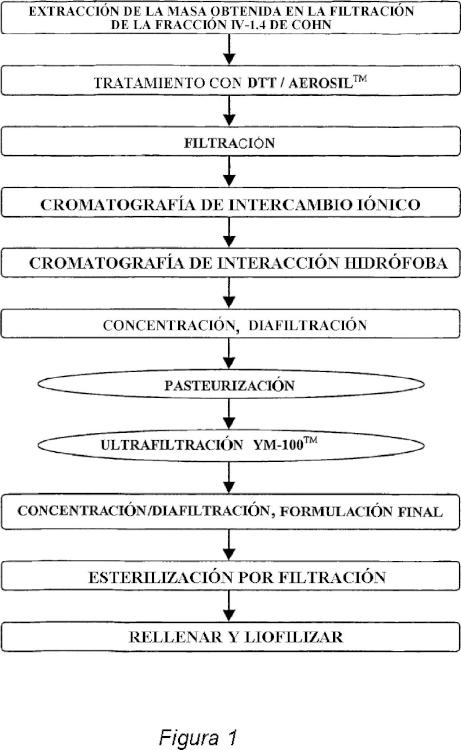
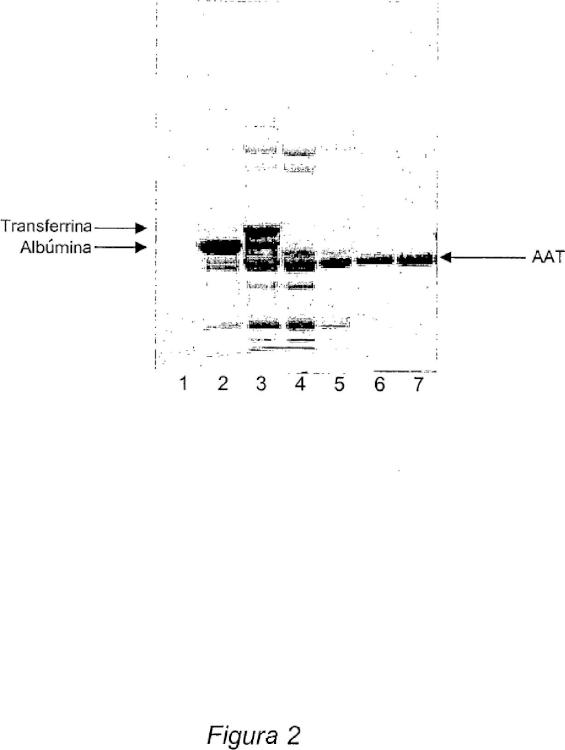
Fragmento de la descripción:
Método para la purificación de alfa-1-antitripsina CAMPO DE LA INVENCIÓN
La invención se refiere a métodos de separación y purificación de proteínas. Más específicamente, la invención se refiere a la separación de alfa-1-antitripsina (AAT, también conocida como inhibidor de la alfa-1 proteinasa, API, y A1-PI) procedente de mezclas de proteínas complejas tales como fracciones de plasma sanguíneo y a métodos para una purificación adicional de la ATT separada de modo que se proporcione una composición adecuada para el uso farmacéutico.
ANTECEDENTES DE LA INVENCIÓN
La alfa-1-antitripsina (AAT) es un inhibidor glucopeptídico de proteasas y se encuentra en el suero humano y otros fluidos. La inhibición de la proteasa por AAT es un componente esencial de la regulación de la proteólisis tisular y la deficiencia de AAT está implicada en la patología de varias enfermedades. Los individuos que heredan una deficiencia de alfa-1 antitripsina, por ejemplo, tienen una mayor probabilidad de padecer enfisema de inicio temprano grave, el resultado de la destrucción no regulada de tejido pulmonar por parte de la elastasa leucocitaria humana. Se ha demostrado que la administración de AAT humana exógena inhibe la elastasa y está asociada con una supervivencia y reducción mayores en la tasa de empeoramiento de la función pulmonar en pacientes deficientes en AAT (Cr y stal et al., Am. J. Respir. Crit. Care Med. 158:49-59 (1998) ; remítase a R. Mahadeva y D. Lomas, Thorax 53:501-505 (1998) para una revisión) .
Debido a su utilidad terapéutica, la producción de AAT comercial ha sido el objeto de una investigación considerable. Se ha avanzado mucho en la producción de AAT recombinante en E. coli (R. Bischoff et al., Biochemistr y 30:34643472 (1991) ) , levadura (K. Kwon et al., J. Biotechnology 42:191-195 (1995) ; Bollen et al., patente de EE. UU. 4.629.567) y plantas (J. Huang et al., Biotechnol. Prog. 17:126-33 (2001) ) y por la secreción en la leche de mamíferos transgénicos (G. Wright et al., Biotechnology, 9:830-834 (1991) ; A.L. Archibald, Proc. Natl. Acad. Sci. USA, 87:5178-5182 (1990) ) . Sin embargo, el aislamiento de AAT a partir de plasma humano constituye en la actualidad el método práctico más eficaz para obtener AAT en cantidad, y el plasma humano es la única fuente aprobada por la FDA.
Se han descrito varios procesos para aislar y purificar AAT a partir de fracciones de plasma humano, que conllevan combinaciones de pasos de precipitación, adsorción, extracción y cromatográficos. Con el fin de minimizar el riesgo de la transferencia de patógenos, se criba el plasma humano combinado destinado a la producción de AAT humana para uso terapéutico para detectar el antígeno superficial de la hepatitis B y para detectar los anticuerpos contra el virus de la inmunodeficiencia humana. Como precaución adicional contra la transmisión de agentes infecciosos, el producto purificado se pasteuriza normalmente calentando a 60 º C durante 10 horas (Mitra et al., Am. J. Med. 84 (sup. 6A) :87-90 (1988) ) y se esteriliza por filtración.
La mayoría de los procesos publicados para el aislamiento de AAT comienzan con una o más fracciones de plasma humano conocido como precipitados de la fracción IV de Cohn, p. ej., fracción IV1 o fracción IV1-4 de Cohn, que se obtienen a partir del plasma como una pasta tras una serie de precipitaciones con etanol y ajustes del pH (E.J. Cohn et al., J. Amer. Chem. Soc., 68:459-475 (1946) ) .
La patente de EE. UU. 3.301.842 describe un método para el aislamiento de AAT a partir de la fracción IV1 de Cohn, donde se añade un derivado de quinolina o acridina a la pasta en un tampón a un pH de 6, se desecha el precipitado y el pH se ajusta a 7.0. Se añade más quinolina o acridina y se recoge el precipitado. Este precipitado se disuelve en un tampón a pH 5.0, se añade cloruro de sodio y se desecha el precipitado resultante. La solución, que contiene AAT, se procesa adicionalmente mediante precipitación con metanol. Como alternativa, se llevan a cabo precipitaciones con sulfato amónico a un pH de 8 y a un pH de 5 con plasma, donde el sobrenadante con un pH de 5 se procesa adicionalmente como anteriormente con aditivos de tipo acridina o quinolina.
Glaser et al., Preparative Biochemistr y , 5:333-348 (1975) , describe un método para aislar AAT a partir de la pasta de la fracción IV1 de Cohn. La pasta se agita en un tampón de fosfato a un pH de 8.5 con el fin de reactivar la AAT, que se desactiva en su mayor parte al pH de 5.2 empleado en el fraccionamiento de Cohn. Tras la diálisis y centrifugación, el sobrenadante se somete a dos tandas de cromatografía de intercambio aniónico a un pH de 6.0 a 7.6 y a un pH de 8.6, seguido por un procesamiento cromatográfico adicional a un pH de 7.6 y a un pH de 8.0 para producir AAT con un rendimiento global de aproximadamente un 30%.
M. H. Coan et al., en las patentes de EE. UU. 4.379.087 y 4.439.358 (remítase también a M. H. Coan et al., Vox Sang., 48:333-342 (1985) ; M. H. Coan, Amer. J. Med., 84 (sup 6A) :32-36 (1988) ; y R. H. Hein et al., Eur. Respir. J., 3 (sup 9) :16s-20s (1990) ) , describen un procedimiento donde la pasta de la fracción IV1 de Cohn se disuelve en un tampón con un pH de 6.5 a 8.5, se añade polietilenglicol y se hace descender el pH hasta el intervalo de 4.6 a 5.7 para precipitar proteínas no deseadas. Tras la centrifugación, se aísla la AAT del sobrenadante por cromatografía de intercambio aniónico. Un procesamiento adicional proporciona un rendimiento de un 45% de AAT con una pureza de aproximadamente un 60%. Los métodos que emplean polietilenglicol como precipitante también se describen en
U.S. 4.697.003, US 4.656.254 y la patente japonesa JP 08099999 descritas más adelante; y también por Hao et al., Proc. Intl. Workshop on Technology for Protein Separation and Improvement of Blood Plasma Fractionation, sept. 79, 1977, Reston, VA.
Dubin et al., Preparative Biochemistr y . 20:63-70 (1990) , describieron una purificación cromatográfica en dos pasos en la cual se eluyó AAT en primer lugar con Blue SEPHAROSE⢠y a continuación se purificó por cromatografía de filtración en gel.
Schultze y Heimburger, en la patente de EE. UU. 3.293.236, describieron una purificación de AAT utilizando cromatografía de intercambio catiónico con un tampón citrato, combinada con fraccionamiento con sulfato amónico de plasma humano.
Lebing y Chen, en la patente de EE. UU. 5.610.285, describieron un proceso de purificación que emplea una cromatografía de intercambio aniónico inicial, seguida por cromatografía de intercambio catiónico a un pH bajo y una fuerza iónica baja, para purificar AAT humana a partir de plasma y fracciones de plasma. La cromatografía catiónica se aprovecha del hecho de que la AAT activa no se une a la columna de intercambio iónico en estas condiciones mientras que proteínas contaminantes, incluidas la albúmina y AAT desnaturalizada, quedan retenidas.
Jordan et al., en la patente de EE. UU. 4.749.783, describieron el aislamiento de AAT a partir de plasma humano utilizando cromatografía de afinidad con anticuerpos monoclonales. Remítase también a Podiarene et al., Vopr. Med. Khim. 35:96-99 (1989) .
Shearer et al., en la solicitud de patente europea EP 0 224 811 y en la patente de EE. UU. 4.656.254 correspondiente, describieron un método mejorado para extraer AAT de la pasta de la fracción IV de Cohn, en el cual la mejora consistía en tratar la pasta con un volumen mayor de tampón, a un pH más elevado, que el que había sido habitual en la técnica anterior. La combinación de un volumen mayor y un pH más elevado aumentó la cantidad de AAT extraída a partir de la pasta. Las proteínas no deseadas se precipitaron añadiendo polietilenglicol, seguido por centrifugación. Se describe un procedimiento alternativo, que es esencialmente el procedimiento de Coan et al., donde tras la adición de polietilenglicol, se ajusta el pH al intervalo de 4.6 a 5.7, y la mezcla acidificada se mantiene durante entre uno y sesenta minutos para precipitar adicionalmente las proteínas no deseadas. La AAT se precipita añadiendo más polietilenglicol y se purifica adicionalmente por cromatografía de intercambio aniónico.
Arrighi et al., en la solicitud europea EP 0717049, describen un proceso donde la pasta de la fracción IV1 se agita en tampón a pH 8.2 a 40 º C durante una hora, seguido por precipitación de proteínas no deseadas con sulfato de amonio. La AAT se aísla del sobrenadante por cromatografía de interacción hidrófoba a pH 7.
Kress et al., en Preparative Biochemistr y 3:541-552 (1973) , dializaron el precipitado procedente de un tratamiento con sulfato de amonio al 80% de plasma humano y a continuación... [Seguir leyendo]
Reivindicaciones:
1. Un método para purificar alfa-1-antitripsina (AAT) activa a partir de un precipitado proteico que contiene AAT crudo, que comprende los pasos de:
(a) suspender el precipitado proteico que contiene AAT crudo en un tampón en condiciones que permitan que la AAT se disuelva;
(b) poner en contacto la suspensión que contiene AAT con un agente reductor de disulfuros para producir una suspensión reducida;
(c) poner en contacto la suspensión que contiene AAT reducida con un material que adsorbe proteínas insoluble, sin la adición de una cantidad de sal o sales solubles que provocará que proteínas que de otro modo serían solubles empiecen a precipitar a partir de la solución;
(d) eliminar materiales insolubles de la suspensión que contiene AAT reducida, de modo que se obtenga una solución proteica aclarada; y
(e) aislar el producto que contiene AAT activa resultante;
donde el precipitado proteico que contiene AAT crudo se refiere a cualquier precipitado proteico que contiene AAT preparado mediante uno o más métodos conocidos para precipitar selectivamente proteínas a partir de una solución, ya sea a partir de suero, leche, cultivo celular u otra fuente original.
2. El método de la reivindicación 1, donde el agente reductor de disulfuros es un ditiol.
3. El método de la reivindicación 2, donde el ditiol es ditiotreitol.
4. El método de la reivindicación 1, donde el material que adsorbe proteínas es un adsorbente de sílice.
5. El método de la reivindicación 4, donde el material que adsorbe proteínas es sílice ahumada.
6. El método de la reivindicación 1, que además comprende un paso de cromatografía de intercambio aniónico.
7. El método de la reivindicación 1, que además comprende un paso de cromatografía de interacción hidrófoba.
8. El método de la reivindicación 1, que además comprende un paso de reducción vírica.
9. El método de la reivindicación 8, donde el paso de reducción vírica comprende pasteurización de aproximadamente 60 a aproximadamente 70 º C.
10. El método de la reivindicación 9, donde el paso de pasteurización se lleva a cabo sobre una solución de AAT que contiene al menos un 40% peso/peso de sacarosa.
11. El método de la reivindicación 10, donde el paso de reducción vírica comprende además una filtración eficaz para eliminar partículas víricas.
12. El método de la reivindicación 1, que además comprende un paso de esterilización.
13. El método de la reivindicación 12, donde el paso de esterilización comprende una filtración eficaz para eliminar bacterias.
14. El método de la reivindicación 1, donde el precipitado proteico que contiene AAT es un precipitado de la fracción IV de Cohn.
15. El método de la reivindicación 1 donde el paso (b) se realiza proporcionando un tampón en el paso (b1) que comprende un agente reductor de disulfuros.
16. El método de cualquier reivindicación precedente donde el producto que contiene AAT activa purificado contiene:
(a) menos de un 6% de proteínas contaminantes basándose en el peso proteico total según se determina por SDS-PAGE,
(b) menos de un 0.2% de IgA;
donde la actividad específica de la alfa-1-antitripsina es al menos 0.99 mg de AAT funcional por miligramo de proteína, cuando se utiliza como un coeficiente de extinción E1% 1cm, 280nm = 5.3; y donde menos de un 8% de la composición tiene un peso molecular mayor que el de la AAT monomérica.
Patentes similares o relacionadas:
Biblioteca de péptidos y su uso, del 8 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Una biblioteca de péptidos que comprende una pluralidad de péptidos diferentes en la que los péptidos comprenden cada uno una secuencia de aminoácidos […]
Composiciones y métodos para el diagnóstico de la artritis reumatoide, del 4 de Marzo de 2020, de Inova Diagnostics, Inc: Un complejo que comprende un polipéptido purificado que comprende una alfa-1-antitripsina humana (hA1AT) carbamilada in vitro, o uno de sus fragmentos, y […]
Método para purificar antitrombina, del 25 de Diciembre de 2019, de Kyowa Kirin Co., Ltd: Método para purificar antitrombina, que comprende las etapas de: (a) adsorber la antitrombina sobre el portador de intercambio aniónico, (b) lavar […]
Aplicación terapéutica de inhibidores de la proteasa de serina de tipo Kazal, del 14 de Agosto de 2019, de CSL BEHRING GMBH: Infestina como un inhibidor de FXII, el cual está ligado a un polipéptido que mejora la semivida en donde el polipéptido que mejora la semivida se obtiene a partir […]
Elementos reguladores de ácido nucleico específicos de hígado y métodos y uso de los mismos, del 24 de Julio de 2019, de VIB VZW: Un elemento regulador de ácido nucleico de 90 nucleótidos o menos para potenciar la expresión génica específica de hígado, que comprende la SEQ ID NO: 3, o una […]
Variantes de inhibidor tisular de la metaloproteinasa tipo tres (TIMP-3), composiciones y métodos, del 10 de Julio de 2019, de AMGEN INC.: Una muteína de TIMP-3 aislada que tiene una región madura que es al menos 90 % idéntica en secuencia de aminoácidos a la región madura de TIMP-3 […]
Composiciones y métodos para el diagnóstico y tratamiento del cáncer, del 3 de Julio de 2019, de BioNTech SE: Un péptido de unión a la Seprasa, que comprende la secuencia de aminoácidos: Tyr Xaa2 Xaa3 Trp Xaa4 Xaa5 Gly Arg Gly Pro en donde Xaa2 es cualquier […]
Fabricación de proteínas inhibidoras inter-alfa (IaIp) a partir de plasma, del 19 de Junio de 2019, de Baxalta GmbH: Un método para preparar una composición de proteína inhibidora inter-alfa (IαIp) enriquecida a partir de plasma, el método comprende las etapas […]