MATERIALES Y METODOS PARA ALTERAR UNA RESPUESTA INMUNOLOGICA A INMUNOGENOS EXOGENOS Y ENDOGENOS, INCLUYENDO CELULAS, TEJIDOS U ORGANOS SINGENEICOS Y NO SINGENEICOS.
Un material implantable, que comprende una matriz biocompatible y células endoteliales ancladas o incluidas,
células de tipo endotelial o sus análogos para ser usado en la reducción de una respuesta inmune o una reacción inflamatoria en un método que comprende la etapa de proporcionar dicho material implantable a un receptor en una cantidad suficiente para reducir la respuesta inmune o la reacción inflamatoria en dicho receptor, en que la matriz tiene una configuración tridimensional de forma que las células ancladas y/o incluidas pueden crear y ocupar un hábitat multi-dimensional
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/015555.
Solicitante: MASSACHUSETTS INSTITUTE OF TECHNOLOGY
PERVASIS THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: FIVE CAMBRIDGE CENTER, KENDALL SQUARE,CAMBRIDGE, MA 02142-1493.
Inventor/es: EDELMAN, ELAZER, R., NUGENT,HELEN,MARIE, METHE,HEIKO.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K39/00D5
- C12N5/06B28
Clasificación PCT:
- A61K35/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sustancias procedentes de mamíferos; Composiciones que comprenden tejidos o células indeterminadas; Composiciones que comprenden células madre no embrionarias; Células modificadas genéticamente (vacunas o preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00).
- C12N5/071 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos de vertebrados, p.ej. células o tejidos humanos.
Fragmento de la descripción:
Materiales y métodos para alterar una respuesta inmunológica a inmunógenos exógenos y endógenos, incluyendo células, tejidos u órganos singeneicos y no singeneicos.
Campo de la invención
Esta invención se dirige a materiales y métodos para modular una respuesta inmunológicamente adversa a un inmunógeno exógeno o endógeno, que incluye un inmunógeno asociado a células, tejidos u órganos. Por ejemplo, la presente invención puede modular una reacción de respuesta inmune o inflamatoria adversa a inmunógenos exógenos o endógenos, que incluyen células, tejidos u órganos no singeneicos o singeneicos, así como para mejorar un estado autoinmune.
Antecedentes de la invención
La investigación sobre xenotrasplantes se ha intensificado durante los últimos años para aliviar la escasez de órganos. Sin embargo, las respuestas inmunes de los hospedantes presentan una enorme barrera para el trasplante entre las especies. Aunque los anticuerpos naturales provocan un rechazo inmediato de estos trasplantes discordantes, la lesión de células endoteliales (EC) y la activación de los vasos injertados que recubren las EC desempeñan una función clave en el inicio del rechazo crónico de injertos. La interrupción de la integridad de la capa endotelial tiene una importancia indudable en numerosos estados, que incluye en trasplantes de tejidos singeneicos y no singeneicos así como enfermedades infecciosas, neoplásticas, inflamatorias y cardiovasculares.
Hasta ahora la inmunomodulación y la aceptación de los trasplantes ha requerido una dependencia de agentes inmunosupresores administrados por vía sistémica. Aunque estos agentes permiten algún grado de aceptación del trasplante, el éxito es limitado y quizás, de forma más significativa, el sistema inmune del paciente queda profundamente comprometido como consecuencia de estos agentes. Por tanto, continúa habiendo una necesidad de materiales terapéuticos y paradigmas de tratamiento que puedan conseguir la ausencia de una inmunomodulación y de efectos de toxicidad y adversos en el sistema inmune de un paciente.
Análogamente, los inmunógenos o estímulos exógenos han planteado un desafío clínico. También, estos pueden dar lugar a acontecimientos inmunológicos adversos o reacciones inflamatorias que necesitan un tratamiento.
Hasta ahora, la gestión clínica de estos acontecimientos adversos se ha basado casi exclusivamente en tratamientos con agentes farmacéuticos que suprimen el sistema inmune de forma no específica.
Las enfermedades autoinmunes y otras enfermedades similares, sin embargo, son otra manifestación clínica de reacciones inflamatorias destacadas o respuestas inmunes adversas. La gestión satisfactoria de estas enfermedades se ha escapado a los facultativos hasta ahora.
Un objeto de la presente invención es proporcionar una solución de ingeniería de tejidos para conseguir una inmunomodulación sin basarse en productos químicos o farmacéuticos que comprometan el sistema inmune de un paciente. Esta solución de ingeniería de tejidos puede ser empleada para alterar, de una manera clínicamente práctica, una respuesta inmune para inmunógenos exógenos y endógenos, que incluyen inmunógenos asociados a células, tejidos u órganos no singeneicos así como singeneicos. Otro objeto de la presente invención es facilitar la aceptación de un paciente de células, tejidos u órganos no singeneicos así como singeneicos. Otro objeto de la presente invención es emplear esta solución de ingeniería de tejidos para modular una reacción inflamatoria como la asociada a lesiones y diversas enfermedades. Otro objeto es utilizar los materiales y métodos de la presente invención para gestionar enfermedades de autoinmunidad y relacionadas.
Nugent et al. (2002) Journal of Vascular Research 39(6): 524-533 describen la implantación de implantes endoteliales alógenos que comprenden una matriz tridimensional basada en colágeno en la que se han sembrado células endoteliales aórticas porcinas y el uso de dichos implantes para inhibir la hiperplasia íntima.
Nugent et al. (1999) Circulation Research 84(4): 384-391 describen la sembradura de células endoteliales aórticas bovinas y porcinas en una matriz tridimensional de colágeno y el uso de la matriz sembrada como un implante para inhibir la hiperplasia íntima.
Sumario de la invención
La presente invención explota el descubrimiento de que las células ancladas y/o incluidas en una matriz biocompatible, preferentemente una que tenga una configuración tridimensional, pueden modular una respuesta inmunológicamente adversa o una reacción inflamatoria respecto a cualquier inmunógeno exógeno o endógeno. Inmunógeno incluye cualquier inmunógeno singeneico o no singeneico, que incluye un inmunógeno asociado a células, tejidos u órganos, así como lesiones, enfermedades y estímulos medioambientales.
La presente invención proporciona un material implantable como se describe en las reivindicaciones.
Breve descripción de los dibujos
Las Figuras 1A, 1B y 1C exponen gráficamente los niveles de anticuerpos específicos PAE en circulación según una realización ilustrativa de la inven- ción.
La Figura 2 expone gráficamente la actividad lítica de esplenocitos según una realización ilustrativa de la invención.
La Figura 3A expone gráficamente las frecuencias de células productoras de citoquinas según una realización ilustrativa de la invención.
La Figura 3B expone pocillos ELISPOT representativos según una realización ilustrativa de la invención.
La Figura 3C expone gráficamente las frecuencias de células T según una realización ilustrativa de la invención.
Las Figuras 4A y 4B representan gráficamente los niveles de células efectoras según una realización ilustrativa de la invención.
Las Figuras 5A, 5B y 5C exponen gráficamente niveles de anticuerpos según una realización ilustrativa de la invención.
La Figura 6 expone gráficamente niveles de esplenocitos según una realización ilustrativa de la invención.
Las Figuras 7A y 7B exponen gráficamente niveles de anticuerpos según una realización ilustrativa de la invención.
Las Figuras 8A y 8B exponen gráficamente la frecuencia de células productoras de citoquinas según una realización ilustrativa de la invención.
Las Figuras 9A y 9B exponen gráficamente niveles de células efectoras según una realización ilustrativa de la invención.
Las Figuras 10A y 10B exponen correlaciones entre la frecuencia esplenocitos productores de citoquinas Th2 y el alcance de la diferenciación de células T en células efectoras según una realización ilustrativa de la invención.
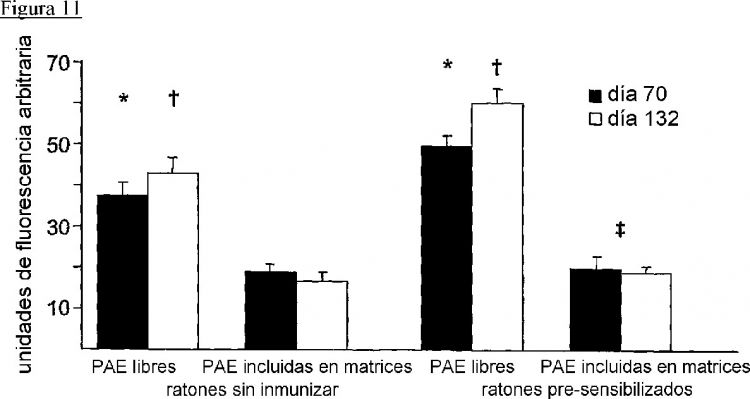
La Figura 11 expone gráficamente el grado de deterioro de células endoteliales según una realización ilustrativa de la invención.
Las Figuras que hacen referencia a PAE, HAE o EC "incluidas" o "incluidas en matrices" significan PAE, HAE o EC ancladas a matrices y/o incluidas en una matriz.
Descripción detallada de la invención
La ingeniería de tejidos es una aproximación prometedora para explotar células endoteliales, células de tipo endotelial o análogos de una terapia celular para enfermedades acompañadas de componentes inmunológicos adversos o tipificadas como tales. Por ejemplo, ciertas enfermedades como, pero sin limitación, las enfermedades vasculares, provocan respuestas inmunológicas adversas y/o reacciones inflamatorias. La presente invención se basa en el descubrimiento de que las células como las células endoteliales, que son ancladas o incluidas en matrices tridimensionales, secretan factores reguladores esenciales que pueden mejorar o modular de algún otro modo una respuesta inmunológica adversa.
El material implantable de la presente invención se desarrolló sobre los principios de la ingeniería de tejidos y representa una nueva aproximación para abordar las necesidades clínicas descritas en la presente memoria descriptiva. El material implantable de la presente invención es único en cuanto que las células viables ancladas y/o incluidas en la matriz biocompatible son capaces de suministrar al sitio de administración múltiples productos basados en células en proporciones fisiológicas bajo un control de la retroalimentación fisiológica. Como se describe en otro lugar en la presente memoria descriptiva, las células adecuadas para ser usadas con el material implantable son células endoteliales...
Reivindicaciones:
1. Un material implantable, que comprende una matriz biocompatible y células endoteliales ancladas o incluidas, células de tipo endotelial o sus análogos para ser usado en la reducción de una respuesta inmune o una reacción inflamatoria en un método que comprende la etapa de proporcionar dicho material implantable a un receptor en una cantidad suficiente para reducir la respuesta inmune o la reacción inflamatoria en dicho receptor, en que la matriz tiene una configuración tridimensional de forma que las células ancladas y/o incluidas pueden crear y ocupar un hábitat multi-dimensional.
2. El material de la reivindicación 1, en el que la etapa de provisión es anterior, coincidente o posterior a la administración a dicho receptor de una o más dosis de una célula, tejido u órgano de un donante singeneico o no singeneico.
3. El material de la reivindicación 1, en el que la etapa de provisión es anterior, coincidente o posterior a la existencia de la respuesta inmune o reacción inflamatoria.
4. Un material implantable, que comprende una matriz biocompatible y células endoteliales, células de tipo endotelial o sus análogos ancladas o incluidas para ser usado en la inducción de aceptación o tolerancia en un paciente en un método que comprende la etapa de proporcionar dicho material implantable de forma anterior, coincidente o posterior al trasplante de células, tejidos u órganos de de autoinjertos, xenoinjertos o aloinjertos, en dicho paciente en una cantidad eficaz para inducir aceptación o tolerancia en dicho paciente, en que la matriz tiene una configuración tridimensional de forma que las células ancladas y/o incluidas pueden crear y ocupar un hábitat multi-dimensional.
5. El material de la reivindicación 4, en el que las células, tejidos u órganos del autoinjerto, xenoinjerto o aloinjerto comprenden células no endoteliales.
6. Un material implantable, que comprende una matriz biocompatible y células endoteliales, células de tipo endotelial o sus análogos ancladas o incluidas, para ser usado en la reducción de la inmunogenicidad de antígenos del donante en un método que comprende la etapa de proporcionar dicho material implantable de forma anterior, coincidente o posterior a la introducción de dicho antígeno del donante en un receptor en una cantidad eficaz para reducir la inmunogenicidad de antígenos del donante, en que la matriz tiene una configuración tridimensional de forma que las células ancladas y/o incluidas pueden crear y ocupar un hábitat multidimensional.
7. El material de la reivindicación 6, en el que la inmunogenicidad de los antígenos del donante es una inmunogenicidad de antígenos de células del donante no endoteliales.
8. El material de la reivindicación 6 o la reivindicación 7, en el dicho donante y receptor son el mismo.
9. Un material implantable, que comprende una matriz biocompatible y células endoteliales ancladas o incluidas, células de tipo endotelial o sus análogos para ser usado en un método para trasplantar a un receptor un trasplante de células, tejidos u órganos singeneicos o no sigeneicos de forma anterior, coincidente o posterior al trasplante, de forma que dicha célula, tejido u órgano singeneico o no singeneico trasplantado no sea rechazado por dicho receptor, en el que la matriz tiene una configuración tridimensional de forma que las células ancladas y/o incluidas pueden crear y ocupar un hábitat multi-dimensio- nal.
10. El material de la reivindicación 9, que comprende células no endoteliales.
11. Un material implantable, que comprende una matriz biocompatible y células endoteliales, células de tipo endotelial o sus análogos ancladas o incluidas, para ser usado en la reducción de una respuesta inmune o una reacción inflamatoria que resulta de la exposición a un inmunógeno exógeno en un método que comprende la etapa de proporcionar dicho material implantable a un receptor en una cantidad suficiente para reducir la respuesta inmune o la reacción inflamatoria en dicho receptor que resulta de la exposición a dicho inmunógeno exógeno, en que la matriz tiene una configuración tridimensional de forma que las células ancladas y/o incluidas pueden crear y ocupar un hábitat multi-dimensional.
12. El material de la reivindicación 1, reivindicación 4 o reivindicación 6, en que dicha etapa de provisión se produce de forma anterior, coincidente o posterior a la administración a dicho paciente de un agente inmunosupresor.
13. El material de la reivindicación 12, en el que dicho agente inmunosupresor reside en dicho material implantable durante la administración coincidente.
14. El material de la reivindicación 9, en el que el método comprende adicionalmente la etapa de administrar un agente inmunosupresor de forma anterior, coincidente o posterior al trasplante.
15. El material para ser usado de la reivindicación 1, reivindicación 4 o reivindicación 6, en que dicho receptor tiene una enfermedad autoinmune.
16. Un material implantable, para ser usado en un método para reducir una respuesta inmune a una célula, tejido u órgano no singeneico, en que dicho material implantable comprende una matriz biocompatible y ancladas o incluidas al mismo, células endoteliales, células de tipo endotelial o sus análogos, en que una cantidad eficaz de dicho material implantable reduce la respuesta inmune del receptor a dicha célula, tejido u órgano no singeneico y en que la matriz tiene una configuración tridimensional de forma que las células ancladas y/o incluidas pueden crear y ocupar un hábitat multi-dimensional.
17. El material de la reivindicación 16, en el que dicha célula, tejido u órgano no singeneico es el del receptor que padece una enfermedad autoinmune.
18. El material de la reivindicación 11, en el que la etapa de provisión es anterior, coincidente o posterior a la existencia de la respuesta inmune o reacción inflamatoria.
19. El material de la reivindicación 11, en el que dicho inmunógeno exógeno se produce de forma natural.
20. El material de la reivindicación 11, en el que dicho inmunógeno exógeno se selecciona entre el grupo que consiste en agentes farmacéuticos, toxinas, implantes quirúrgicos, agentes infecciosos y productos químicos.
21. El material de la reivindicación 11, en el que dicho inmunógeno exógeno es un estímulo exógeno seleccionado entre el grupo que consiste en estrés medioambiental, lesión y exposición.
22. El material de una cualquiera de las reivindicaciones anteriores, en el que las células endoteliales, células de tipo endotelial o análogos de las mismas (a) son células no endoteliales o (b) son análogos no naturales.
23. El material de una cualquiera de las reivindicaciones 1 a 21, en el que las células endoteliales, células de tipo endotelial o sus análogos, cuando están anclados o incluidos en una matriz biocompatible, reducen una respuesta inmune humoral o celular del receptor respecto a una célula, tejido u órgano de un donante no singeneico.
24. El material de una cualquiera de las reivindicaciones 1 a 21, en el que las células endoteliales, células de tipo endotelial o sus análogos, cuando están ancladas o incluidas en una matriz biocompatible exhiben una inmunogenicidad disminuida.
25. El material la reivindicación 24, en el que dicha inmunogenicidad disminuida es una expresión reducida de MHC o una capacidad reducida de unirse, activar o favorecer la maduración de células inmunes innatas, cuando están ancladas o incluidas en una matriz biocompatible, en que dichas células inmunes innatas se seleccionan entre el grupo que consiste en células NK, células dendríticas, monocitos y macrófagos.
26. El material de una cualquiera de las reivindicaciones 1 a 21, en el que las células endoteliales, células de tipo endotelial o sus análogos, cuando están ancladas incluidas en una matriz biocompatible, exhiben una expresión reducida de MHC, moléculas co-estimuladoras o moléculas de adhesión.
27. El material de una cualquiera de las reivindicaciones 1 a 21, en el que las células endoteliales, células de tipo endotelial o sus análogos, cuando están ancladas o incluidas en una matriz biocompatible y son conjuntamente cultivados con una célula dendrítica, inhiben la expresión mediante dicha célula dendrítica de HLA-DR, IL12, receptor de tipo Toll o CD83, favorecen la absorción de dextrano por dichas célula dendrítica o bloquean la proliferación de linfocitos inducidos por células dendríticas.
28. El material de una cualquiera de las reivindicaciones 1 a 21, en el que las células endoteliales, células de tipo endotelial o sus análogos, cuando son conjuntamente cultivadas con células inmunes adaptativas, inhiben la proliferación, activación o diferenciación de dichas células, en que dichas células inmunes adaptativas se seleccionan entre el grupo que consiste en linfocitos B y linfocitos T.
Patentes similares o relacionadas:
MÉTODOS PARA USAR CÉLULAS DERIVADAS DE TEJIDO ADIPOSO EN EL TRATAMIENTO DE AFECCIONES CARDIOVASCULARES, del 6 de Febrero de 2012, de CYTORI THERAPEUTICS, INC: El uso de una composición que comprende una población concentrada de células derivadas de tejido adiposo (ADC) en la fabricación de un medicamento para restablecer […]
 CONSTRUCTOS DE TRASPLANTE TISULAR PREVASCULARIZADOS PARA LA RECONSTRUCCIÓN DE UN ÓRGANO HUMANO O ANIMAL, del 23 de Mayo de 2011, de UroTec GmbH: Procedimiento de fabricación de un constructo de trasplante tisular para reconstruir un órgano humano o animal, en el que el constructo de trasplante tisular consta de una […]
CONSTRUCTOS DE TRASPLANTE TISULAR PREVASCULARIZADOS PARA LA RECONSTRUCCIÓN DE UN ÓRGANO HUMANO O ANIMAL, del 23 de Mayo de 2011, de UroTec GmbH: Procedimiento de fabricación de un constructo de trasplante tisular para reconstruir un órgano humano o animal, en el que el constructo de trasplante tisular consta de una […]
 MODELO ANIMAL DE ANGIOGENESIS HUMANA Y SUS APLICACIONES, del 2 de Febrero de 2011, de UNIVERSIDAD AUTONOMA DE MADRID: La presente invención se relaciona con un modelo animal de angiogénesis humana para la monitorización cuantitativa y no invasiva de dicho proceso de angiogénesis in vivo mediante […]
MODELO ANIMAL DE ANGIOGENESIS HUMANA Y SUS APLICACIONES, del 2 de Febrero de 2011, de UNIVERSIDAD AUTONOMA DE MADRID: La presente invención se relaciona con un modelo animal de angiogénesis humana para la monitorización cuantitativa y no invasiva de dicho proceso de angiogénesis in vivo mediante […]
 XENOTRASPLANTE PARA LA TERAPIA DEL SNC, del 15 de Octubre de 2010, de DIATRANZ LIMITED: Un dispositivo implantable que contiene células vivas recolectadas del plexo coroideo de un mamífero, de las cuales al menos algunas son células epiteliales […]
XENOTRASPLANTE PARA LA TERAPIA DEL SNC, del 15 de Octubre de 2010, de DIATRANZ LIMITED: Un dispositivo implantable que contiene células vivas recolectadas del plexo coroideo de un mamífero, de las cuales al menos algunas son células epiteliales […]
 MEDIO DE CULTIVO DENOMINADO MV06 TANTO PARA CELULAS ENDOTELIALES COMO MIOCARDICAS, del 24 de Febrero de 2010, de INSTITUT DE RECHERCHE EN HEMATOLOGIE ET TRANSPLANTATION: Medio de cultivo denominado MV06 que permite el crecimiento in vitro tanto de células progenitoras endoteliales como de células progenitoras miocárdicas, […]
MEDIO DE CULTIVO DENOMINADO MV06 TANTO PARA CELULAS ENDOTELIALES COMO MIOCARDICAS, del 24 de Febrero de 2010, de INSTITUT DE RECHERCHE EN HEMATOLOGIE ET TRANSPLANTATION: Medio de cultivo denominado MV06 que permite el crecimiento in vitro tanto de células progenitoras endoteliales como de células progenitoras miocárdicas, […]
USO DE VEGF MUTADO PARA LA TERAPIA ANTIANGIOGENICA, del 29 de Septiembre de 2011, de CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA (CIGB): Aplicacion de secuencias oligonucleotídicas y polipeptídicas de moléculas pertenecientes a la familia del factor de permeabilidad vascular (VPF), sus receptores […]
COMPÙESTOS ANTIINFLAMATORIOS, del 16 de Junio de 2011, de LUGER, DR., THOMAS BRZOSKA, DR., THOMAS GRABBE, DR., STEPHAN: Compuesto, seleccionado del grupo constituido por el dipéptido lisina-prolina, el tripéptido lisina-prolina-treonina y sales farmacéuticamente aceptables […]
COMPOSICIÓN FARMACÉUTICA O ALIMENTARIA PARA EL TRATAMIENTO DE PATOLOGÍAS ASOCIADAS A UN RECHAZO DE INJERTO, del 21 de Marzo de 2011, de BIOTECH TOOLS S.A: Composición farmacéutica y/o alimentaria que contiene con un vehículo farmacéutico y/o alimentario adecuado, una proteína de estrés y al menos un epítopo conformacional […]