Locus de la cadena ligera lambda de ratón.
Un ratón en el cual el locus de la cadena ligera lambda del ratón endógeno está funcionalmente silenciada.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2002/002867.
Solicitante: Crescendo Biologics Limited.
Nacionalidad solicitante: Reino Unido.
Dirección: Meditrina Building Babraham Research Campus Babraham Cambridge CB22 3AT REINO UNIDO.
Inventor/es: BRUGGEMANN,MARIANNE, ZOU,XIANGANG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C12N15/13 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Inmunoglobulinas.
PDF original: ES-2305245_T3.pdf



Fragmento de la descripción:
Locus de cadena ligera lambda de ratón.
La presente invención se relaciona con los ratones en los cuales el locus de la cadena ligera (L) endógena de ratón, λ (lambda) y/o el loci de la cadena λ y κ (kappa) han sido funcionalmente silenciados, y con los anticuerpos producidos por tales ratones.
Las células B expresan inmunoglobulinas de superficie (Ig) tanto con cadena L κ (kappa) o λ, una selección la cual determina la exclusión del isotipo. La proporción de anticuerpos que contienen las cadenas L κ o λ varía considerablemente en las diferentes especies pero en el ratón solamente un pequeño por ciento de anticuerpos expresa λ. Los genes de la cadena L son codificados por dos locis diferentes, el loci de la cadena L κ o λ, y el ratón tiene un extensivo número de genes V (variables) κ aguas arriba del gen 5 J (unión) κ y gen κ 1 C (región constante) . Aunque el locus κ es alrededor de 10 veces mayor que el locus λ, con más de 100 genes V, esta complejidad extensiva no es considerada como razón de que la mayoría de los anticuerpos de ratón porten cadena L κ. Puede ser que en el locus de ratón K son simplemente más eficientes los reordenamientos de ADN lo cual es apoyado por el hallazgo de que en la mayoría de las células con V κ reordenados el locus λ está aún en la configuración de la línea germinal mientras que en la mayoría de las células que expresan la cadena L λ el locus κ es tanto productivamente reordenado o suprimido.
Algunas cepas de ratón con locus de cadena L κ han sido descritos. Ellos fueron generados por integración homóloga de un gen marcador selectivo en C κ o remoción diana de C κ ó J κ (ver por ejemplo Zou, X. y otros, 1995, Eur. J. Immunol 25 (8) : 2154-2162) . Silenciando la expresión de la cadena L κ se pierde la ligera en la exclusión del isotipo y la activación de la cadena L y se concluyó que la expresión de κ y λ son eventos separados e independientes. Aunque los ratones homocigotos κ- /- compensan la deficiencia de κ con la producción de λ incrementada sus células esplénicas B y células μ+ en la médula ósea puede ser reducida comparado al ratón normal. Esto puede sugerir que el reordenamiento y expresión de la cadena L λ es quizás un proceso menos eficiente. Sin embargo, a pesar de la pérdida de la cadena L κ estos ratones son saludables y pueden mantener una eficiente respuesta inmune.
Durante el desarrollo de las células B los segmentos de genes que codifican las cadenas Ig H se reordenan primero por recombinación de D a JH en la etapa de pro células B. Esto es seguido por recombinación de VH a D-JH en la etapa de pre B-1 y si una cadena μ H puede parearse con la correspondiente cadena L, que consiste en VpreB y proteína λ5, esta forma un receptor pre células B expresado en la superficie (pre BCR) y la etapa de diferenciación pre B-II. La expresión en la superficie de la célula del receptor pre BCR induce la proliferación y después algunas divisiones de las células grandes B II se diferencian en pequeños restos de células pre B II. La etapa de pre B-II con una definida relación de células pre B grandes y pequeñas han sido identificadas por la expresión en la superficie de la cadena α del receptor IL-2, CD25. En la transición de pre B II a célula B inmadura el reordenamiento V-J de la cadena L ocurre donde la correspondiente cadena L es reemplazada por κ ó λ. En esta etapa las células pueden abandonar la médula ósea para diferenciaciones adicionales en las células del plasma o células de memoria los órganos linfoides secundarios tales como el bazo o nódulos linfáticos.
El desarrollo de las células B sin cadenas L no ha sido completamente dilucidado en el arte anterior. El BCR consiste en dos cadenas de IgH cada una asociada con una cadena L de Ig en conjunto con el correceptor Igα/Igβ. Estas 6 cadenas tienen que ensamblarse correctamente en el retículo endoplasmático (ER) para permitir el transporte y la expresión de la IgM en la superficie celular para progresar al desarrollo de las células B. Las células B inmaduras sin cadena L no son mantenidas y pierden la IgH de la superficie, la expresión de Igα o Igβ conduce a reducir la señal de una actividad transductora la cual puede detener la maduración de las células B. La cadena H, sintetizada antes de la cadena L, es chaperoneada y retenida en el citoplasma pero si la asociación de la cadena L falla una simple cadena H, a pesar de las cadenas L, sufre una rápida degradación intracelular como resultado de un ineficiente transporte desde el ER a Golgi.
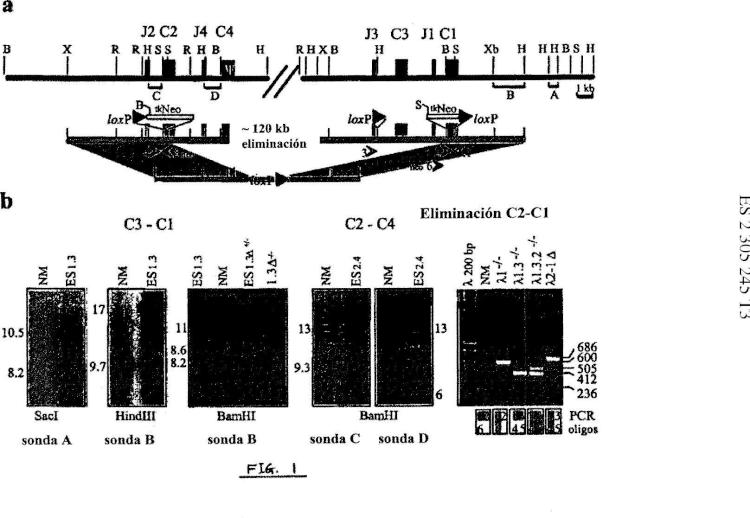
El locus de la cadena ligera lambda λ de ratón tiene alrededor de 200 kb de tamaño y comprende 3 regiones de genes variables (V) y 4 segmentos de unión (J) aguas arriba de 4 regiones de genes constantes (C) , V2 - Vx - J2 - C2 - J4 - C4 - V1 - J3 - C3 - J1 - C1 (Fig. Ia) . El silenciamiento de los locus λ es difícil porque la integración homóloga para suprimir o discapacitar un simple o aún dos genes C λ podría no ser suficiente para prohibir el reordenamiento y expresión de la cadena ligera λ. Para alcanzar esto podría tener que discapacitar 2 regiones C2 y C3-C1 las cuales son de alrededor de 100 kb aparte. C4 es considerada no funcional ya que no ha sido encontrada proteína. Esto significa que 2 construcciones diana tienen que ser ensambladas y homólogamente integradas en el mismo alelo. Una ventaja podría ser el uso de sitios loxP integrados para permitir la supresión mediada por Cre de los locus completos o la eliminación de genes funcionales pertinenentes.
Existe por lo tanto la necesidad de producir ratones en los cuales el locus de la cadena ligera λ sea suprimido. Esto podría también ser atractivo para producir ratones que pierden las cadenas ligeras funcionales para la producción de ratones que producen solamente anticuerpos de cadena pesada -la explotación de ratones que producen anticuerpos humanos-, por ejemplo, es obstaculizada por el problema de que las cadena L lambda de ratón se asocian con una gran proporción de Ig humana expresada (o cadena H) .
WO 98/24884 está dirigido a animales transgénicos no humanos (especialmente ratones) capaces de producir anticuerpos heterólogos.
El ejemplo 28 de WO 98/24884 es un ejemplo teórico e hipotético que describe dos posibles estrategias para la inactivación dirigida de los locus de cadena ligera λ:
En la primera estrategia, la supresión de un segmento grande de 120 kb Jλ2Cλ2 a Jλ1Cλ1 usando un reemplazamiento tipo vector diana y dependiendo de la recombinación homóloga para insertar un marcador selectivo tal como neo podría ser extremadamente difícil sino imposible de alcanzar. Aunque la misma estrategia fue reportada usada exitosamente en WO 98/24884 para lograr la supresión diana de los locus JH, la secuencia del locus JH a ser suprimida y reemplazada por el gen neo fue solamente de unos pocos kilobases de tamaño. La propuesta de extrapolación de esta simple supresión para la supresión dirigida del segmento de 120kb Jλ2Cλ2 a Jλ1Cλ1 puede no ser técnicamente alcanzable. Ciertamente, los inventores creen que nadie ha sido capaz de silenciar el locus de la cadena ligera de ratón A usando esta estrategia a pesar de que algunos grupos (de personas expertas) han intentado hacerlo.
En la segunda estrategia, se sugiere que las dos regiones, viz. Jλ2Cλ2/ Jλ4Cλ4 y Jλ3Cλ3/ Jλ1Cλ1, podrían ser independientemente suprimidas en las mismas células del sistema embrionario (ES) usando vectores diana tipo reemplazo. Otra vez, las regiones propuestas para la supresión son cada una bastante grandes y es dudoso que cada supresión pueda ser exitosamente ejecutada. La probabilidad de ir alcanzando independientemente dos de tales supresiones en la misma célula ES es aún baja. Otra vez, los presentes inventores creen que nadie ha sido capaz de silenciar el locus de la cadena ligera λ de ratón usando esta estrategia a pesar de los intentos que han sido hechos.
La WO 98/24884 no proporciona información suficiente y necesaria para la persona experta para ejecutar la invención actualmente reivindicada. La presente invención demuestra, en primer lugar, la producción actual de un ratón con el locus de la cadena ligera λ silenciado.
La WO 94/02602 describe la producción de anticuerpos xenogénicos en un huésped no humano, el cual preferiblemente no es capaz de producir cadenas pesadas... [Seguir leyendo]
Reivindicaciones:
1. Un ratón en el cual el locus de la cadena ligera λ del ratón endógeno está funcionalmente silenciada.
2. El ratón de acuerdo a la reivindicación 1 en el cual el locus de la cadena ligera λ está eliminado en parte o completamente.
3. El ratón de acuerdo a la reivindicación 1 o la reivindicación 2 en el cual el locus de la cadena ligera λ es funcionalmente silenciado a través de la eliminación de segmentos de genes que codifican para el el locus de la cadena ligera λ.
4. El ratón de acuerdo a cualquiera de las reivindicaciones precedentes en el cual el locus de la cadena ligera κ está funcionalmente silenciado.
5. El ratón de acuerdo a cualquiera de las reivindicaciones precedentes en el cual el locus de la cadena pesada es silenciado por un método de selección de genes (Knout-out) .
6. El ratón de acuerdo a cualquiera de las reivindicaciones precedentes en el cual el loci de la cadena pesada y λ, κ ha sido eliminados o silenciados.
7. El ratón de acuerdo a cualquiera de las reivindicaciones precedentes que porta al menos un transgen el cual comprende uno o mas genes pesados o loci y/o genes de cadenas ligeras o loci de especies heterólogas.
8. El ratón de acuerdo a la reivindicación 7, donde el ratón produce anticuerpos solamente de cadena pesada de especies heterólogas.
9. El ratón de acuerdo a la reivindicación 7 o a la reivindicación 8 donde la especie heteróloga es el humano.
10. Uso de un ratón como es definido en cualquiera de las reivindicaciones precedentes para producir anticuerpos.
11. El uso de acuerdo a la reivindicación 10 donde los anticuerpos son producidos a través de procedimientos de inmunización.
12. El uso de acuerdo a la reivindicación 10 o la reivindicación 11 donde los anticuerpos son humanos.
13. La combinación de dos construcciones diana capaces de producir un ratón en el cual el locus de la cadena ligera λ está funcionalmente silenciado, la primera construcción diana siendo de alrededor de 14kb y en la cual un sitio loxP está insertado en el sitio 3' Hind III de la región J3 y en el cual el tkNeo-loxP está insertado en Cλ1, y la segunda construcción diana siendo de alrededor de 13kb y en la cual el loxP-tkNeo está insertado en la región Cλ2.
14. Un método para producir un ratón como se definió en la reivindicación 1 en el cual el locus de la cadena ligera λ está funcionalmente silenciado, comprendiendo el paso de eliminación de al menos los genes de las regiones constantes C1, C2 y C3 del locus de la cadena ligera λ.
15. El método de la reivindicación 14 donde el loci C2-C4 y C3-C1 son eliminados simultáneamente o secuencialmente.
16. El método de acuerdo a la reivindicación 14 o la reivindicación 15, dicho método usa las construcciones diana de la reivindicación 13.
17. El ratón de acuerdo a la reivindicación 1, el cual tiene una eliminación de los genes de la cadena ligera λ seleccionados de las siguientes parte de la región del locus λ.
(a) C2 y C3-C1; o
(b) C2-C1 (es decir C2-C4-C3-C1) .
Patentes similares o relacionadas:
Anticuerpo biespecífico o mezcla de anticuerpos con cadenas ligeras comunes, del 15 de Julio de 2020, de Jiangsu Alphamab Biopharmaceuticals Co., Ltd: Anticuerpo biespecífico o parte de unión a antígeno del mismo, en el que el anticuerpo biespecífico o la parte de unión a antígeno del mismo tiene una cadena […]
Anticuerpo de PDL-1, composición farmacéutica del mismo y sus usos, del 13 de Mayo de 2020, de Sichuan Kelun-Biotech Biopharmaceutical Co., Ltd: Un anticuerpo monoclonal anti-PDL-1 o un fragmento de unión a antígeno del mismo, en donde, dicho anticuerpo monoclonal anti-PDL-1 tiene […]
Polipéptidos biespecíficos de unión a antígeno, del 29 de Abril de 2020, de X-Body, Inc: Un polipéptido biespecífico de unión a antígeno aislado desprovisto de cadenas ligeras de anticuerpo que comprende una cadena pesada de anticuerpo […]
Anticuerpos anti-CD40, del 29 de Abril de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un anticuerpo anti-CD40 humanizado que tiene una cadena pesada variable y una cadena ligera variable que comprende las secuencias de aminoácidos de SEQ ID NO: 53 y SEQ ID NO: […]
Anticuerpos anti-ricina y sus usos, del 8 de Abril de 2020, de HER MAJESTY THE QUEEN IN RIGHT OF CANADA AS REPRESENTED BY THE MINISTER OF NATIONAL DEFENCE: Un anticuerpo, aislado o purificado, o fragmento de este, que comprende una cadena ligera variable que comprende una CDR L1 de secuencia KASQDINNYLR […]
Moléculas de unión de alta avidez que reconocen MAGE-A1, del 8 de Abril de 2020, de Max Delbrück Centrum für Molekulare Medizin (MDC) Berlin-Buch: Una construcción de reconocimiento de antígenos que es un receptor de células T (TCR), que comprende (i) una región variable de la cadena alfa […]
Composiciones para inhibir la activación del complemento dependiente de MASP-2, del 11 de Marzo de 2020, de OMEROS CORPORATION: Un anticuerpo monoclonal humano aislado, o fragmento de unión a antígeno del mismo, que se une a MASP-2 humana e inhibe la activación del complemento dependiente de MASP-2, […]
Anticuerpos anti-MIF para su uso en el tratamiento de enfermedades inflamatorias, del 19 de Febrero de 2020, de Baxalta Incorporated: Anticuerpo monoclonal o parte de unión a antígeno del mismo que se une específicamente a la región que abarca los aa 50-68 o la región que abarca los aa 86-102 de MIF humano, […]