Insulina estabilizada por halógenos.
Un análogo de insulina que comprende un polipéptido de cadena B que incorpora una fenilalanina monohalogenada en la posición B24.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2009/052477.
Solicitante: CASE WESTERN RESERVE UNIVERSITY.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 10900 Euclid Avenue Cleveland, OH 44106 ESTADOS UNIDOS DE AMERICA.
Inventor/es: WEISS,MICHAEL.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/28 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Insulinas.
- C07K14/62 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Insulinas.
- C12N15/17 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Insulinas.
PDF original: ES-2552636_T3.pdf


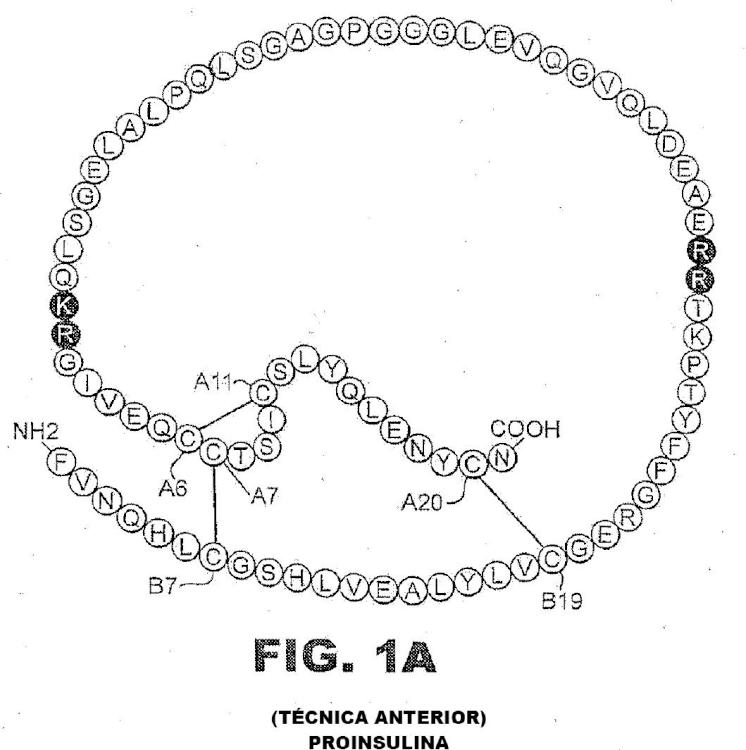
Patentes similares o relacionadas:
Análogos de insulina de cadena sencilla de acción prolongada, del 20 de Diciembre de 2018, de CASE WESTERN RESERVE UNIVERSITY: Un análogo de insulina de cadena sencilla que comprende las secuencias de una cualquiera de las SEQ ID NOS: 4-10.
Análogos de insulina resistentes a proteasas, del 10 de Agosto de 2016, de NOVO NORDISK A/S: Un análogo de insulina que está estabilizado frente a la degradación por parte de una o más enzimas seleccionadas del grupo constituido por: pepsina, quimotripsina, […]
Tratamiento de enfermedades relacionadas con un gen de la insulina (INS) por inhibición de la transcripción antisentido natural en un gen de la insulina (INS), del 11 de Mayo de 2016, de CuRNA, Inc: Un oligonucleótido que se dirige a una transcripción antisentido natural de un gen de la insulina (INS) para su uso como un compuesto terapéutico, donde el oligonucleótido […]
 Solución farmacéutica de albúmina unida no covalentemente e insulina acilada, del 27 de Noviembre de 2015, de NOVO NORDISK A/S: Una formulación farmacéutica inyectable que contiene una insulina acilada y albúmina, caracterizada por que al menos 99% (peso/peso) de la insulina acilada […]
Solución farmacéutica de albúmina unida no covalentemente e insulina acilada, del 27 de Noviembre de 2015, de NOVO NORDISK A/S: Una formulación farmacéutica inyectable que contiene una insulina acilada y albúmina, caracterizada por que al menos 99% (peso/peso) de la insulina acilada […]
USO DE PROTEINAS DE FUSION CUYA PARTE N-TERMINAL ES UN DERIVADO DE HIRUDINA PARA LA PRODUCCION DE PROTEINAS RECOMBINANTES VIA SECRECION POR PARTE DE LEVADURAS., del 1 de Mayo de 2007, de AVENTIS PHARMA DEUTSCHLAND GMBH: Una molécula de ADN de la forma: Px-Sx-Bn-(ZR)-Hir (AsmR) - proteína (Y)-T en la que: Px es cualquier secuencia de ADN promotora, seleccionada de tal modo que los […]
NUEVOS ANALOGOS DE INSULINA CON UNA FIJACION DE ZINC INCREMENTADA., del 16 de Marzo de 2007, de HOECHST MARION ROUSSEL DEUTSCHLAND GMBH: Análogo de insulina o una sal fisiológicamente aceptable del mismo, de fórmula I en la cual (A1-A5) significan los radicales de aminoácido de las […]
PREPARACION DE UNA PROTEINA RECOMBINANTE EN UNA CELULA HUESPED PROCARIOTICA MEDIANTE EL USO DE UN CODON MEJORADO., del 16 de Enero de 2007, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Procedimiento para expresar un gen de fusión LipP-hGH en Staphylococcus carnosus, en el que un gen de hormona de crecimiento humana (hGH) se fusiona a la secuencia […]
CITOQUINA QUE INDUCE APOPTOSIS, del 29 de Junio de 2011, de IMMUNEX CORPORATION: Un polipéptido TRAIL soluble purificado que contiene una secuencia de aminoácidos que es al menos 80% idéntica a una secuencia seleccionada del grupo […]