Inhibidores de unión de E. coli F18+.
Un compuesto para el uso para tratar o prevenir una infección de E.
coli F18+ en cerdos en donde dicho compuesto se une a laE. coliF18+, fimbrias F18, adhesina F18, FedF o dominio de unión del receptor de FedF y en donde dicho compuesto es de la fórmula (I)
[X(Fucα2)Galβ3(Y)TV]n-W (I)
en donde
X está ausente, es Galα3 o es GalNAcα3 y cuando X está ausente, entonces Y está ausente
Y está ausente o es Fucα4;
T está ausente o es ZNAcε3;
y en donde Z es Glc o Gal; y
&epsilo; es α o β;
V está ausente o es un mono- o polisacárido;
n es 1 o mayor; y
W está ausente o es un portador capaz de unir n cadenas de polisacáridos, siendo particularmente dicho portador una proteína, un lípido, un glicolípido, una glicoproteína, un glicoesfingolípido, una ceramida, una lectina, un anticuerpo, una inmunoglobulina, un mímico sintético del portador antes mencionado, una molécula orgánica, una molécula pequeña, un producto químico, una nanopartícula, una perla, o un gel.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/062699.
Solicitante: UNIVERSITEIT GENT.
Nacionalidad solicitante: Bélgica.
Dirección: SINT-PIETERSNIEUWSTRAAT 25 9000 GENT BELGICA.
Inventor/es: CODDENS,ANNELIES, COX,ERIC, TENEBERG,SUSANN EVA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/702 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Oligosacáridos, es decir que tienen entre tres y cinco radicales sacáridos unidos los unos a los otros por enlaces glicosídicos.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
PDF original: ES-2499025_T3.pdf
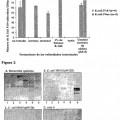

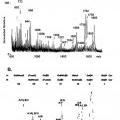


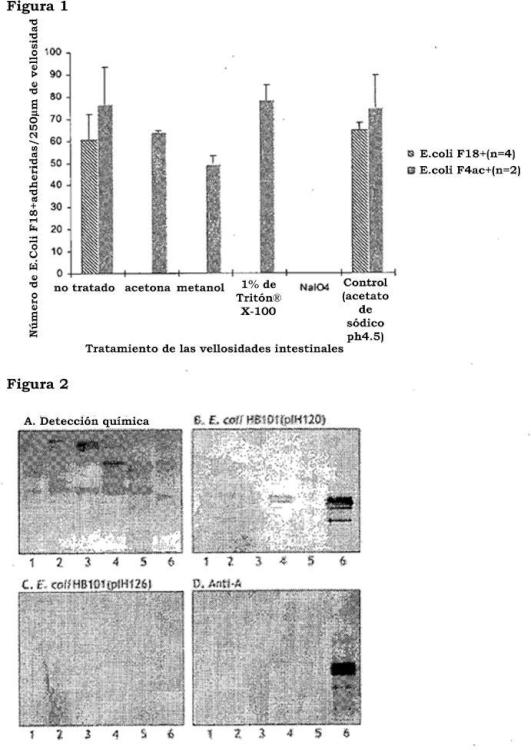
Fragmento de la descripción:
Inhibidores de unión de E. Coli F18+
La presente invención se refiere al determinante de grupo sanguíneo A/B/H en las cadenas de glicoesfingolípidos del núcleo tipo 1 como punto de reconocimiento de la proteína FedF de Escherichia coli F18 enterotoxigénica y verotoxinogénica fimbriada y el uso de compuestos que comprenden tales determinantes para el tratamiento de las infecciones de Escherichia coli F18+ en cerdos y en métodos de tamizaje Antecedentes de la invención Escherichia coli (E. coli) enterotoxigénica (ETEC) y verotoxigénica (VTEC) son importantes causas de enfermedad en el hombre y animales.
Al adherirse a la mucosa, las bacterias se protegen de ser erradicadas por los mecanismos naturales de limpieza del huésped tales como el peristaltismo intestinal y la secreción de fluido. Además, al estar en estrecho contacto con las superficies de las mucosas, las bacterias tienen mejor acceso a los nutrientes disponibles y las toxinas secretadas se entregan cerca de su tejido objetivo. La adherencia a los tejidos del huésped está mediada por adhesinas expresadas en la superficie del organismo microbiano. Se sabe que las adhesinas bacterianas son lectinas que se combinan con carbohidratos complementarios en las superficies de la célula huésped. Las adhesinas bacterianas son parte de las estructuras poliméricas típicas que se denominan fimbrias o pili. Las fimbrias, son filamentos delgados y flexibles con un diámetro de 2 a 4 nm sin agujero axial, mientras que el pili son estructuras rígidas con diámetro de 7-8 nm con agujero axial. Ambos se componen de subunidades principales que conforman el eje fimbrial complementadas con subunidades menores que median la adhesión o que tienen una función estructural. En la mayoría de los casos, la adhesina es una subunidad menor.
Típicamente, las adhesinas consisten en dos dominios: un dominio N-terminal de lectina-carbohidrato específico y un dominio C-terminal de pilina. Las estructuras cristalinas revelan que los dominios de lectina de estas adhesinas fimbriales tienen un pliegue de tipo-inmunoglobulina (tipo Ig) en común, aunque muestran poca o ninguna identidad de secuencia. El dominio C-terminal de pilina conecta la adhesina al eje fimbrial y comparte el pliegue tipo-Ig altamente conservado e incompleto de las otras subunidades fimbriales.
Algunos de los hidratos de carbono que se reconocen por adhesinas bacterianas se determinaron con éxito en el pasado (por ejemplo, los pilis de tipo 1 y P, fimbrias F5, fimbrias F17 y fimbrias S) , mientras que otras estructuras receptoras de carbohidratos permanecen sin resolver como fimbrias F4 y fimbrias F6.
Las adhesinas de pili tipo 1 demuestran especificidad por manosa, pero tienen una considerable mayor afinidad por oligosacáridos tales como Manα3Manβ4GlcNAc y Manα6 (Manα3) Manα6 (Manα3) Man. El receptor biológico para la adhesina de pili tipo 1 (FimH) en el tracto urinario es la glicoproteína uroplaquina Ia cual se expresa fuertemente por las células uroepiteliales diferenciadas. Además, la glicoproteína de Tamm-Horsfall que se secreta en la orina humana es reconocida por pili de tipo 1, proporcionando una primera línea de defensa contra las infecciones del tracto urinario.
E. coli P fimbriada causando infecciones del tracto urinario tienen especificidad por la galabiosa (Gala4Gal) presente en la globoserie de glicolípidos en por ejemplo eritrocitos humanos y células uroepiteliales. El isotipo mínimo del receptor se llama globotriasilceramida (GbO3) , que es el residuo galabiosa enlazado por un residuo de β-glucosa a un grupo ceramida que ancla el receptor en la membrana. Se encontraron además, otros miembros de la globoserie, es decir GbO4 y GbO5, que se reconocen por 3 adhesinas expresadas por los alelos PapG (PapGI, PapGII y PapGIII) , cada adhesina demostrando una especificidad diferente para un isotipo de receptor diferente. Considerando que la mayoría de las lectinas bacterianas reconocen azúcares no reductores terminales, las adhesinas de E. coli P fimbriada reconocen además azúcares internas.
Además del pili P, otras adhesinas manosa-resistente, por ejemplo las fimbrias S, se identificaron en cepas E. coli asociadas con infección séptica o del tracto urinario. Estas fimbrias se unen a siali1 (α2, 3) galactosidasas en varias glicoproteínas de eritrocitos humanos y del epitelio renal, pero no a los lípidos.
Las adhesinas de fimbrias F5, asociadas con E. coli enterotoxigénica que causa diarrea en cerdos, terneros y corderos neonatos, reconocen NeuGcα2-3Galβ4GlcNAc. Esta estructura del receptor glicolípido se aisló primero de los eritrocitos equinos, pero se detecta además en los raspados de la mucosa del intestino de cerdito y ternero, funcionando así como receptor in vivo de E. coli F5+.
No todos los receptores de carbohidratos de cepas patogénicas de E. coli se identificaron en el pasado. Hasta el momento, no se han concluido los estudios que indican la especificidad de unión de E. coli F4+ a carbohidratos. Cada una de las variantes antigénicas F4ab, F4ac y F4ad se une a su propia estructura de carbohidrato. La secuencia Galα3Gal se reconoce por las fimbrias F4ab, mientras que Galβ3GalNAc y Galβ3/4GlcNAc son partes esenciales de los sitios receptores de la variante F4ac.
Las moléculas receptoras de las lectinas fimbriales son de naturaleza de glicoproteína o glicolípido. Para investigar los receptores de glicoproteína involucrados en la adhesión de varias bacterias, se usan técnicas de electroforesis en gel e inmunoelectrotransferencia, seguido por ensayos de superposición. Se identifican los receptores de glicolípidos de la adhesión bacteriana y caracterizan después mediante la separación por cromatografía en capa fina.
Se sabe que los carbohidratos que se reconocen por el pili de tipo 1 y fimbrias S están anclados en las proteínas, mientras que los receptores de carbohidratos para pili P y fimbrias F5 se ubican en los lípidos. Los sacáridos de glicolípidos son más fáciles de determinar ya que cada molécula de lípido lleva sólo porta una cadena de sacárido, a diferencia de las glicoproteínas que pueden tener diversas cadenas de carbohidratos con enlace N o O en una molécula.
La expresión de receptores para las bacterias patógenas se limita a las áreas restringidas del cuerpo, determinando el lugar donde puede producirse la infección. En algunos ejemplos, los receptores se expresan sólo durante un periodo limitado en la vida.
La especificidad de azúcar de fimbrias veces no está determinado únicamente por la adhesina, pero también puede ser modulada por el eje fimbrial.
La interacción entre la adhesina y el receptor pueden activar los procesos de transducción de señales que alteran la expresión génica tanto en las células bacterianas como huésped.
En cerdos recién destetados, la E. coli F18 fimbriada que producen entero- y/o verotoxinas inducen diarrea y/o enfermedad del edema, contando con pérdidas económicas sustanciales en la industria porcina.
Estructuras fimbriales F18 se expresan por cepas E. coli F18+ que median la adhesión con el borde intestinal en cepillo. Las fimbrias F18 se expresan por el agregado de genes fed (fimbrias asociadas con la enfermedad del edema) y típicamente están compuestas de múltiples copias de la principal subunidad FedA mientras que unas subunidades menores de FedF sólo se presentan en pequeñas cantidades. FedF se determinó que es la subunidad adhesiva.
El dominio de unión de FedF está situado en la mitad del amino-terminal de la proteína, como se encuentra en muchas otras adhesinas bacterianas. La región esencial de unión se mapeó entre los aminoácidos 60 y 109 y los residuos de aminoácidos cargados Lis-72, His-88 y His-89 se encontraron que eran importantes para la unión al receptor. Estos residuos pueden estar implicados ya sea directamente en interacción con el receptor o podrían influenciar en la estructura terciaria del bolsillo de unión.
Una etapa crucial en la patogénesis de E. coli F18+ es la unión inicial a un receptor específico (F18R) en el epitelio intestinal porcina. Algunos cerdos se encuentran que son resistentes a la colonización por E. coli F18+ debido a la falta de expresión de F18R. El estado F18R en los cerdos se determina genéticamente con la expresión de control génico de F18R mapeado con el grupo de ligamiento halotano en el cromosoma 6 de cerdo. Este locus contiene dos genes candidatos, es decir, FUT1 y FUT2, que codifican las α (1, 2) fucosiltransferasas y el análisis de la expresión de ambos genes en el intestino delgado porcino reveló que el gen FUT2 se expresó diferencialmente, mientras que el gen FUT1 se... [Seguir leyendo]
Reivindicaciones:
1. Un compuesto para el uso para tratar o prevenir una infección de E. coli F18+ en cerdos en donde dicho compuesto se une a laE. coliF18+, fimbrias F18, adhesina F18, FedF o dominio de unión del receptor de FedF y en donde dicho compuesto es de la fórmula (I)
[X (Fucα2) Galβ3 (Y) TV]n-W (I)
en donde X está ausente, es Galα3 o es GalNAcα3 y cuando X está ausente, entonces Y está ausente Y está ausente o es Fucα4; T está ausente o es ZNAcε3;
y en donde Z es Glc o Gal; y ε es α o β;
V está ausente o es un mono- o polisacárido; n es 1 o mayor; y W está ausente o es un portador capaz de unir n cadenas de polisacáridos, siendo particularmente dicho portador una proteína, un lípido, un glicolípido, una glicoproteína, un glicoesfingolípido, una ceramida, una lectina, un anticuerpo, una inmunoglobulina, un mímico sintético del portador antes mencionado, una molécula orgánica, una molécula pequeña, un producto químico, una nanopartícula, una perla, o un gel.
2. Un compuesto para el uso como el reivindicado en la reivindicación 1, en donde V es UGalβ4Glcβ1; y en donde U está ausente, es Gala4, Galβ3GlcNAcβ3, o (Fucα2) Galβ3GlcNAcβ3.
3. Un compuesto para el uso como el reivindicado en cualquiera de las reivindicaciones 1 o 2 en donde X es Galα3 o GalNAcα3; Z es Glc o Gal y Y está ausente.
4. Un compuesto para el uso como el reivindicado en cualquiera de las reivindicaciones 1 a 3 en donde T es ZNAcε3 y en donde ε es β y Z es Glc.
5. Un compuesto para el uso como el reivindicado en la reivindicación 1, en donde X, Y, T y V están ausentes.
6. Un compuesto para el uso como el reivindicado en cualquiera de las reivindicaciones 1 a 4 en donde dicho compuesto es un compuesto de la Fórmula (Ia)
[X (Fucα2) Galβ3 (Y) ZNAcε3UGalβ4Glcβ1]n-W (Ia)
en donde U está ausente, es Galα4, es Galβ3GlcNAcβ3, o es (Fucα2) Galβ3GlcNAcβ3.
7. Un compuesto para el uso como el reivindicado en cualquiera de las reivindicaciones 1 a 6, en donde n es uno o mas, y en donde W está ausente o en donde W es un portador capaz de unir n cadenas de polisacáridos, particularmente dicho portador que se selecciona a partir del grupo que comprende: una ceramida, un mono- o polisacárido, una proteína, un lípido, un glicolípido, una glicoproteína, un glicoesfingolípido, una lectina, un anticuerpo, una inmunoglobulina, un mímico sintético del portador antes mencionado, una molécula orgánica, una molécula pequeña, un producto químico, una nanopartícula, una perla, o un gel.
8. Un compuesto para el uso como el reivindicado en cualquiera de las reivindicaciones 1 a 7 en donde dicho compuesto es
Fucα2Gal Fucα2Galβ3GlcNAcβ3Galβ4Glc; Galα3 (Fucα2) Galβ3GlcNAcβ3Galβ4Glc; GalNAcα3 (Fucα2) Galβ3GlcNAcβ3Galβ4Glc; GalNAcα3 (Fucα2) Galβ3 (Fucα4) GlcNAcβ3Galβ4Glc;
Galα3 (Fucα2) Galβ3 (Fucα4) GlcNAcβ3Galβ4Glc; GalNAcα3 (Fucα2) Galp3GlcNAcβ3Galβ3GlcNAcβ3Galβ4Glc; GalNAcα3 (Fucα2) Galβ3GalNAcβ3Gala4Galβ4Glc; o GalNAcα3 (Fucα2) Galβ3GalNAcα3 (Fucα2) Galβ3GlcNAcβ3Galβ4Glc; y conjugados polivalentes reductores del extremo de estos.
9. Un compuesto como el definido en cualquiera de las reivindicaciones 1 a 8 para el uso como una medicina.
10. Un compuesto como el definido en cualquiera de las reivindicaciones 1 a 8 para el uso en el tratamiento de infecciones por la E. coli F18+en cerdos particularmente en el tratamiento de diarrea y edema después del destete en cerdos.
11. Un compuesto como el definido en cualquiera de las reivindicaciones 1 a 8 para el uso como el definido en las reivindicaciones 9 o 10, para administración oral.
12. Un método para identificar moléculas que afectan la unión entre la E.coli F18+, fimbrias F18 , adhesina F18 , FedF
o dominio de unión del receptor de FedF y el compuesto como el definido en cualquiera de las reivindicaciones 1 a 8 que comprende:
-poner en contacto la molécula que se prueba con la E. coli F18+, fimbrias F18, adhesinas F18 , FedF o
dominio de unión del receptor de FedF; y dicho compuesto, y
- determinar si dicha molécula afecta la unión de E. coliF18+, fimbrias F18, adhesina F18, FedF o el dominio de unión del receptor de FedF con dicho compuesto.
13. Un método como el reivindicado en la reivindicación 12 que comprende:
- realizar un ensayo de unión en el cromatograma; o
- realizar la prueba de adhesión a las vellosidades; en donde el compuesto o E coli F18 +, fimbrias F18 , adhesinas F18, FedF, el dominio de unión al receptor de FedF o la molécula está presente en un soporte sólido, una célula o tejido.
14. Una composición farmacéutica para el uso en un método de tratamiento que comprende un portador farmacéuticamente aceptable y como un ingrediente activo una cantidad terapéuticamente eficaz de un compuesto como el definido en cualquiera de las reivindicaciones 1 a 8.
15. Un aditivo de alimentos o bebidas que comprende uno o más de los compuestos seleccionados del grupo que consiste de:
[Galα3 (Fucα2) Galβ3GlcNAcβ3Galβ4Glc]n-W; [GalNAcα3 (Fucα2) Galβ3GlcNAcβ3Galβ4Glc]n-W; [GalNAcα3 (Fucα2) Galβ3GlcNAcβ3Galβ3GlcNAcβ3Galβ4Glc]n-W; [GalNAcα3 (Fucα2) Galβ3GalNAcβ3Galα4Galβ4Glc]n-W; y [GalNAcα3 (Fucα2) Galβ3GalNAcα3 (Fucα2) Galβ3GlcNAcβ3Galβ4Glc]n-W,
en donde n es uno o más, y en donde W está ausente o en donde W es un portador capaz de unir n cadenas de polisacáridos, particularmente, dicho portador que se selecciona a partir del grupo que comprende: una ceramida, un mono- o polisacárido, una proteína, un lípido, un glicolípido, una glicoproteína, un glicoesfingolípido, una lectina, un anticuerpo, una inmunoglobulina, un mímico sintético del portador antes mencionado, una molécula orgánica, una molécula pequeña, un producto químico, una nanopartícula, una perla, o un gel.
16. Pienso para cerdos suplementado con uno o más de los compuestos como el definido en la reivindicación 15.
Patentes similares o relacionadas:
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Tratamiento o prevención de infecciones asociadas a biopelículas con agua con cloro libre disponible, del 15 de Julio de 2020, de Sonoma Pharmaceuticals, Inc: Agua con cloro libre disponible (FAC) para su uso en el tratamiento o reducción de la incidencia de una infección en un mamífero provocada por una biopelícula que contiene […]
Formulaciones de azalida acuosas concentradas, del 8 de Julio de 2020, de Sun Pharma Global FZE: Una composición farmacéutica tópica para su uso en el tratamiento de una infección ocular que comprende administrar a un paciente en necesidad del mismo, una cantidad […]
Composición tópica que comprende extractos de boldo y de reina de los prados, destinada a un animal, y sus aplicaciones, del 6 de Julio de 2020, de Virbac SA: Composición tópica para animales, caracterizada por que comprende en un medio fisiológicamente aceptable extractos de boldo Peumus boldus y extractos de reina […]
DERIVADOS DE OLIGOSACÁRIDOS SINTÉTICOS COMO VACUNA CONTRA BORDETELLA PERTUSSIS, del 2 de Julio de 2020, de INSTITUTO FINLAY DE VACUNAS: La presente invención proporciona fragmentos de oligosacáridos sintéticos provenientes del pentasacárido terminal del lipooligosacárido de Bordetella pertussis, un método […]
Inhibidores de lisina gingipaína, del 1 de Julio de 2020, de Cortexyme, Inc: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde Z es ariloximetil-carbonilo sustituido con halógeno; […]
Vacuna de ADN contra pseudotuberculosis en peces marinos, del 1 de Julio de 2020, de NATIONAL UNIVERSITY CORPORATION TOKYO UNIVERSITY OF MARINE SCIENCE AND TECHNOLOGY: Una vacuna de ADN para peces, caracterizada por: - impartir inmunidad contra la pseudotuberculosis causada por Photobacterium damselae subsp. piscicida - que comprende, […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]